Аминокислоты, пептиды и белки - Дэвени Т., Гергей Я. 1976
Анализ белков с помощью низковольтного электрофореза
Электрофорез в полиакриламидном геле
Диск-электрофорез
Принцип метода. Миграция и разделение белков происходят в небольших цилиндрических колонках полиакриламида. [Термин диск-электрофорез происходит от дископодобной формы фрагментов колонки геля, в которых содержатся фракции, а также от английского слова “discontinuous”, которым названа неоднородная (“прерывистая”) буферная система, обычно используемая в этом методе.]
Область применения: фракционирование и определение гомогенности белков (сывороточных белков, ферментов, белковых гормонов и т. д.), нуклеиновых кислот, пептидов и т. д.
ПРИБОРЫ
В продаже имеются приборы нескольких типов. Ниже мы описываем прибор для аналитического электрофореза в полиакриламидном геле, который производит фирма Reanal (Венгрия).
1. Стеклянные трубки для геля и подставка для них. Колонки геля готовят в стеклянных трубках, имеющих длину 100 мм и внутренний диаметр 6 мм. На время полимеризации геля их вставляют в специальную подставку, представляющую собой двухслойную плексигласовую пластинку, в верхнем слое которой высверлены отверстия для трубок (фиг. 12, А). Трубки устанавливают вертикально и закрепляют внизу завинчивающимися плексигласовыми кольцами и резиновыми прокладками (фиг. 12, Б).
2. Прибор для электрофореза. Прибор состоит из верхнего и нижнего резервуаров для буферного раствора (фиг. 13), изготовленных из плексигласа. Верхний резервуар крепится на нижнем плексигласовыми стойками с винтами. В центре каждого резервуара в цилиндрическом патроне из плексигласа помещается угольный электрод, который вместе с патроном можно извлечь из резервуара. В стенке патрона сделаны отверстия для постоянного контакта электродов с буферным раствором независимо от его уровня, поскольку эти отверстия образуют лабиринтную систему. Снизу ко дну верхнего резервуара крепятся 12 стеклянных трубок, заполненных гелем. Они размещаются на равном расстоянии от электрода по кругу с диаметром 100 мм. Таким образом прибор позволяет исследовать одновременно 12 образцов. Трубки крепятся ко дну буферного резервуара с помощью завинчивающихся колец (фиг. 14).
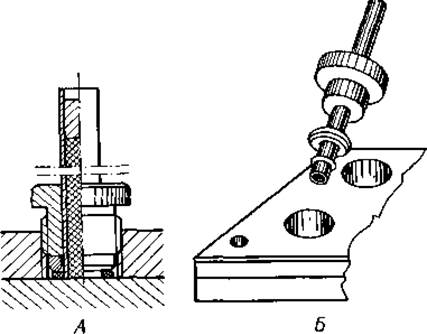
Фиг. 12. Подставка для заполнения стеклянных трубок гелем, входящая в комплект прибора для аналитического диск-электрофореза (описание см. в тексте).
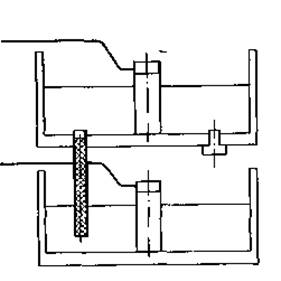
Фиг. 13. Буферные резервуары прибора для аналитического диск-электрофореза.
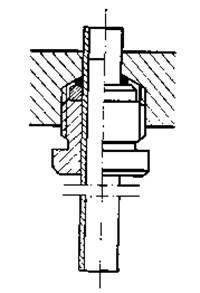
Фиг. 14. Крепление стеклянной трубки с гелем ко дну буферного резервуара.
МЕТОДИКА
1. Приготовление растворов, а) Основные растворы для приготований геля. Раствор Ащ: 36,6 г триса (чистого) растворяют в дистиллированной воде, добавляют 48 мл 1 н. НСl (х. ч.), 0,23 мл N, N, N', N'-тетраметилэтилендиамина (ч.) и дистиллированной водой доводят объем до 100 мл.
Раствор Бщ: 0,735 г N, N'-метиленбисакриламида растворяют в дистиллированной воде, затем добавляют 28,0 г акриламида, доводят объем дистиллированной водой до 100 мл и фильтруют.
Раствор Вщ: 0,14 г персульфата аммония (х. ч.) растворяют в дистиллированной воде и доводят объем до 100 мл.
Растворы Ащ и Бщ можно хранить несколько недель в склянках из темного стекла в холодильнике. Срок использования раствора Вщ — не более недели.
б) Раствор мономеров для приготовления мелкопористого геля (pH 8,9). Смешивают растворы Ащ, Бщ, Вщ и дистиллированную воду в соотношении 1 : 2 : 4 : 1. Если готовят гель для заполнения всех 12 трубок, то каждая часть соответствует 3,5 мл.
в) Электродный буферный раствор (pH 8,3). В дистиллированной воде растворяют 1,2 г триса (х. ч.), 5,76 г глицина (х. ч.) и доводят объем до 200 мл.
г) Раствор амидового черного. 10,0 г амидового черного 10 В растворяют в 7%-ной уксусной кислоте в конечном объеме 1000 мл. Перед использованием раствор красителя следует профильтровать через бумагу. Для отмывки и хранения колонок полиакриламидного геля можно использовать 7%-ный раствор уксусной кислоты.
2. Приготовление геля. Стеклянные трубки закрепляют в подставке. В вакуумной колбе на 50 мл готовят раствор мономеров (б) и удаляют из него воздух, создавая разрежение в колбе с помощью вакуумного насоса. В каждую стеклянную трубку пипеткой вносят по 2 мл раствора мономеров и, чтобы не образовывался мениск, сверху наслаивают 5—8 мм разбавленного в 8 раз раствора Ащ. Полимеризация наступает примерно через 30 мин. Как только она произойдет, между гелем и расположенной выше жидкостью образуется четкая граница. После образования геля слой жидкости удаляют фильтровальной бумагой.
3. Внесение исследуемого образца. Исследуемые растворы, содержащие примерно 1—2 мг белка в 1 мл, разбавляют равным объемом 40 %-ной сахарозы. На каждую колонку полиакриламидного геля наносят 50—100 мкг гомогенного или 200—500 мкг гетерогенного белка или смеси белков. После внесения образца трубки осторожно заполняют электродным буферным раствором. Заполненные трубки монтируют ко дну верхнего резервуара и в каждый резервуар заливают по 1 л соответствующего буферного раствора.
4. Электрофорез. В первые 30 мин электрофореза ток в цепи должен достичь 2 мА и позже не должен превышать 5 мА. Рекомендуется поместить работающий прибор в холодильник. Разделение белков сыворотки продолжается примерно 60—90 мин.
5. Извлечение геля из стеклянных трубок. По окончании электрофореза трубки вынимают из прибора и погружают в кювету, наполненную водой. Под водой между гелем и стеклом спиральным движением вводят узкую лопаточку или упругую проволочку, отслаивая гель от поверхности стекла. Вода проникает между гелем и стеклом, и колонка геля легко извлекается из трубки.
6. Окрашивание. Колонки геля на 1 ч погружают в раствор амидового черного, затем ополаскивают водопроводной водой и переносят в отмывающий раствор. Смену отмывающего раствора производят до полной прозрачности участков геля, не содержащих белка.
Примечания. 1. Основные белки и пептиды анализируют в кислой среде (pH 4,3). Для их фракционирования требуются следующие растворы.
а) Основные растворы для приготовления геля. Раствор Ак: смешивают 48 мл 1 н. КОН (х. ч.) и 17,2 мл уксусной кислоты (х. ч.), прибавляют 4 мл N, N, N', N'-тетраметилэтилендиамина (ч.) и доводят объем дистиллированной водой до 100 мл.
Раствор Бк: смешивают 48 мл 1 н. КОН (х.ч.) и 2,87 мл уксусной кислоты (х. ч.), прибавляют 0,46 мл N, N, N', N'-тетраметилэтилендиамина (ч.) и доводят объем дистиллированной водой до 100 мл.
Раствор Вк: в дистиллированной воде растворяют сначала 0,4 г N, N'-метиленбисакриламида, а затем 60,0 г акриламида, доводят объем до 100 мл и фильтруют.
Раствор Гк: в дистиллированной воде растворяют сначала 2,5 г
N, N'-метиленбисакриламида, а затем 10,0 г акриламида, доводят объем до 100 мл и фильтруют.
Раствор Дк: в 100 мл дистиллированной воды растворяют 4,0 мг рибофлавина и фильтруют перед использованием.
Раствор Ек: в 100 мл дистиллированной воды растворяют 0, 28 г персульфата аммония (х. ч.).
Все растворы, кроме Ек, можно хранить несколько недель в склянках из темного стекла в холодильнике. Срок хранения раствора Ек не должен превышать недели.
б) Раствор мономеров для получения мелкопористого геля (pH 4,3). Смешивают растворы Ак, Вк, Ек и дистиллированную воду в соотношении 1 : 2 : 4 : 1. Если готовят гель для заполнения всех 12 трубок, то каждая часть соответствует 3,5 мл.
в) Раствор мономеров для получения крупнопористого геля (pH 6,8). Смешивают растворы Бк, Гк, Дк и дистиллированную воду в соотношении 1 : 2 : 1 : 4. Во избежание спонтанной полимеризации после добавления раствора Дк следует предохранять смесь от света. Если необходимо заполнить все 12 трубок прибора для диск-электрофореза, то одна часть соответствует 0,4 мл.
г) Электродный буфер (pH 4,5). К 62,4 г ß-аланина (х. ч.) прибавляют 16,0 мл уксусной кислоты (х. ч.) и доводят объем дистиллированной водой до 2 л.
д) Окрашивающий и отмывающий растворы. Используются те же растворы, что и для щелочной системы анализа (см. стр. 90).
Колонку геля готовят точно так же, как и для щелочной системы анализа. Затем на ее верхнюю часть пипеткой наносят 0,2 мл раствора мономеров, предназначенного для приготовления крупнопористого геля. Еще выше осторожно наслаивают 5—8 мм разбавленного в 8 раз раствора Бк. После этого трубки стелем 15—20мин освещают электрическими лампами мощностью 400—500 Вт на расстоянии 15—20 см до наступления полимеризации, о чем можно судить по появлению опалесценции геля. Жидкий слой сверху удаляют фильтровальной бумагой и вместо него наносят исследуемый раствор. В отличие от анализа в щелочной системе исследуемый раствор перед нанесением разводят в 8 раз разбавленным раствором Бк. В остальном все элементы процедуры аналогичны щелочной системе анализа.
2. Одним из наиболее значительных преимуществ этого метода является его пригодность для исследования очень небольших количеств белка или пептидов. Это особенно ценно, например, для анализа разбавленных элюатов, получаемых при хроматографии и гель-фильтрации. Диск-электрофорез позволяет анализировать эти элюаты без предварительного концентрирования.
3. Окрашенные колонки геля можно продолжительное время хранить в пробирках с отмывающим раствором. Результаты фракционирования обычно регистрируют фотографически, причем удобнее всего фотографировать окрашенные колонки в таких пробирках.
4. Диск-электрофорез в акриламидном геле, содержащем мочевину. Раствор А: 8М раствор мочевины (24,0 г перекристаллизованной мочевины растворяют в 50 мл деионизованной воды и муравьиной кислотой доводят pH до 3,2). Раствор Б: 30%-ный цианогум. Раствор В: 0,12 мл N, N, N', N'-тетраметилэтилендиамина (ТЕМЭД) в 25 мл раствора А. Раствор Г: насыщенный раствор персульфата калия.
Приготовление геля. В вакуумной колбе смешивают 7 мл раствора Б, 3,5 мл раствора В и 17 мл раствора А и с помощью вакуумного насоса удаляют из смеси воздух. Затем добавляют 0,7 мл раствора Г и, смешав, заполняют полученным раствором стеклянные трубки прибора для диск-электрофореза, как рекомендуется на стр. 90. Сверху на гелеобразующий раствор наслаивают 5—8 мм дистиллированной воды.
В буферные резервуары заливают раствор 5,5 М мочевины (330,0 г мочевины на 1000 мл воды), доведенный до pH 3,2 муравьиной кислотой.
Внесение исследуемого образца. Исследуемый раствор смешивают с равным объемом 40%-ной сахарозы и наслаивают на гель. Объем наносимого образца не должен превышать 1/30 общего объема геля.
Процедуры электрофореза и окрашивания подобны тем, которые уже описаны на стр. 90.
Цитированная литература
1. Aronsson Т., Grönwall A., Scand. J. Clin. Lab. Invest., 9, 128 (1957).
2. Benhamou E., Pugliese J., Chichn J. C., Amouch P., Presse mеd., 62, 65 (1954).
3. Cremer D., Tiselius, A., Biochem. Z., 320, 273 (1950).
4. Ditterbrandt M., Am. J. Clin. Path., 18, 439 (1948).
5. McDonald H. J., Bermes E. W., Biochim. Biophys. Acta, 17, 290 (1955)
6. Durrum E. L., J. Colloid. Sсi., 6, 224 (1951).
7. Flodin P., Porath J., Biochim. Biophys. Acta, 13, 696 (1954).
8. Folin C., Ciocalteu V., J. Biol. Chem., 73, 627 (1927).
9. Führ J., Hinz O. S., Klin. Wschr., 31, 153 (1953).
10. Führ J., Hinz O. S., Klin. Wschr., 33, 87 (1955).
11. Grassmann W., Hannig K., Hoppe-Seylers Z. Physiol. Chem., 290, 1 (1952).
12. Jencks W. P., Durrum E. I., J. Clin. Invest., 34, 1437(1955).
13. Kabat E. A., Glusman M., Kuaub V., Am. J. Med., 4, 653 (1948).
14. Kawerau E., Analyst, 79, 681 (1954).
15. Kohn J., Protides Biol. Fluids, Elsevier Publ., Co., Amsterdam (1959).
16. Köiw E., Grönwall A., Scand. J. Clin. Lab. Invest., 4, 244 (19521.
17. Köroer G., Klin Wschr., 28, 693 (1950).
18. Kunkel H. G., Tiselius A., J. Gen. Physiol., 35, 89 (1951).
19. Lillie R. D., Burtner H. J., J. Histochem., 1, 8 (1953).
20. Ott H., Die med. Welt, 51, 2697 (1960).
21. Ott H., Electrophorese in Acrylamid Gel, in: Proteides Biol. Fluids, Elsevier Publ. Co., Amsterdam, 1962.
22. Poulik M. D., Edelman G. M., Protides Biol. Fluids, 9, 126 (1961).
23. Pucar Z., Z. Physiol. Chem., 269, 62 (1954).
24. Röttger H., Naturwiss., 39, 451 (1952).
25. Scheurlen P. P., Goli R., Klin. Wschr., 39, 696 (1961).
26. Smithies O., Nature, 175, 307 (1955).
27. Südhof H., Klin. Wschr., 36, 536 (1958).
28. Swahn B., Scand. J. Clin. Lab. Invest., 4, 98 (1952).
29. Uriel J., Scheidegger J. J., Bull. Soc. Chim. Biol., 37, 165 (1955).
Рекомендуемая литература
Bailey J. L., Techniques in Protein Chemistry, Elsevier Publishing Company, Amsterdam, London, New York, 1967. (Имеется перевод 1-го изд.: Дж. Бейли, Методы химии белков, изд-во “Мир”, М., 1965.)
Gordon Н., Electrophoresis of Proteins in Polyacrylamide and Starch Gels North Holland Publ. Co., Amsterdam, London, 1969.
Leach S. J. ed., Physical Principles and Techniques of Protein Chemistry, Part A, Academic Press, New York and London, 1969.
Smith I., Chromatographic and Electrophoretic Techniques, Heinemann, London, 1969.
Wierne R. J., Agar Gel Electrophoresis, Elsevier Publ. Co., Amsterdam, 1965.
Williams C. A., Chase M. W., Methods in Immunology and Immunochemistry, Vol. II, Academic Press, New York, London, 1968.
Wunderly C., in: P. Alexander and P. J. Block, A Laboratory Manual of Analytical Methods of Protein Chemistry, Yol. 2, Pergamon Press, Oxford, 1960. (Вундерли X., в кн. Аналитические методы белковой химии, ИЛ, М., 1963, стр. 151, 167.)