Аминокислоты, пептиды и белки - Дэвени Т., Гергей Я. 1976
Методы средне- и высоковольтного электрофореза
Метод диагонального электрофореза
Выделение пептидов, содержащих цистин
Некоторые боковые группы аминокислотных остатков могут быть модифицированы в специфических реакциях и в результате у них может измениться заряд. Большая часть таких реакций может быть проведена с аминокислотами и пептидами, адсорбированными на бумаге.
Благодаря специфичности этих реакций изменение заряда касается только тех пептидов, которые имеют в своем составе определенную аминокислоту. Поэтому само явление изменения заряда можно использовать для выделения пептидов, содержащих соответствующие аминокислоты из такой многокомпонентной смеси, как ферментативный белковый гидролизат.
Белок, содержащий цистин и, следовательно, имеющий дисульфидные связи, подвергают ферментативному гидролизу. Следует подобрать такой фермент, который обеспечит получение мелких пептидов, т. е. расщепит цепь во многих точках. Наименее пригоден для этой цели трипсин из-за высокой избирательности действия, а также из-за хорошо известной устойчивости белков, содержащих дисульфидные связи, к триптическому гидролизу.
Сначала полученный гидролизат подвергают препаративному электрофорезу на бумаге, например при pH 6,5. Закончив электрофорез, бумагу высушивают и окрашивают контрольную полоску 1 (фиг. 22,А). Ориентируясь по ней, определяют месторасположение тех компонентов гидролизата, которые мигрировали на наибольшее расстояние от линии старта в сторону катода и анода, и в соответствии с этим вырезают полоску 2 шириной 1 см. Ее помещают в эксикатор, содержащий надмуравьиную кислоту [смесь перекись водорода — муравьиная кислота (1:5)], и создают вакуум. Через 2 ч инкубации при комнатной температуре полоску переносят в другой вакуумный эксикатор с NaOH и удаляют пары надмуравьиной кислоты. Затем сухую полоску пришивают к новому листу (фиг. 22,Б) на том же расстоянии от края бумаги, на котором находилась стартовая зона при первом электрофорезе. Бумагу смачивают тем же самым буферным раствором (pH 6,5) и проводят электрофоретическое разделение в направлении, перпендикулярном первоначальному. Закончив электрофорез, электрофореграмму целиком окрашивают нингидрином.
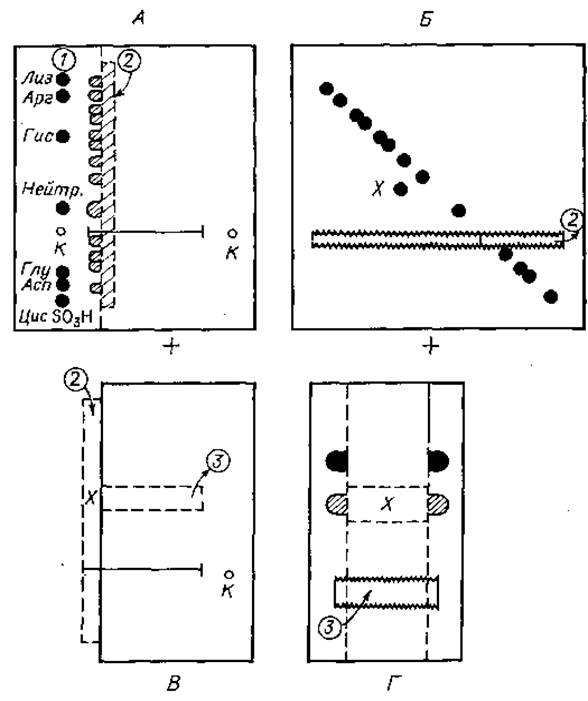
Фиг. 22. Диагональный электрофорез пептидов, содержащих цистин.
А. Препаративный электрофорез при pH 6,5. Б. Электрофорез в перпендикулярном направлении фракций, содержащихся в полоске 2 после окисления. В. Определение локализации компонента X, сместившегося при электрофорезе в сторону от диагонали. Г. Препаративный диагональный электрофорез.
Несколько упрощая, предположим, что при гидролизе остались нетронутыми пептидные связи, соединяющие два соседних остатка цистеина, и получился один пептид, имеющий внутренний дисульфидный мостик:
В результате окисления надмуравьиной кислотой (НМК) этот дисульфидный мостик разрушается и возникают две сильнокислотные группы:
![]()
Появление таких групп означает увеличение отрицательного заряда на 2 единицы. При втором электрофоретическом разделении пептид, изменивший свой отрицательный заряд на две единицы, займет положение компонента X (фиг. 22,Б), более близкое к аноду по сравнению с другими, не изменившими своих зарядов компонентами смеси, располагающимися по диагонали. Диагональное расположение всех остальных пептидов обусловлено тем, что, не изменив заряда, они сохранили также неизменной свою подвижность относительно друг друга.
Проведя аналитический диагональный электрофорез, определяют локализацию зоны компонента X на препаративной электро- фореграмме и вырезают участок, содержащий искомую фракцию 3 (фиг. 22,В). Этот отрезок бумаги точно так же, как и аналитическую электрофореграмму, обрабатывают надмуравьиной кислотой, затем пришивают к новому листу бумаги и подвергают электрофорезу при pH 6,5 (фиг. 22,Г). На окрашенной контрольной полоске обычно можно обнаружить две зоны. Одна из них содержит компоненты, локализующиеся диагонально; в данном случае они не представляют для нас интереса. Другая зона располагается ближе к аноду, чем первая. Именно в ней находятся пептиды, содержащие цистеиновую кислоту, причем чаще всего в достаточно гомогенном виде.
При ферметативном гидролизе дисульфидная связь между двумя остатками цистеина, образующими дисульфидный мостик, может разорваться еще до воздействия надмуравьиной кислотой. Дисульфидный мостик может также связывать две разные цепи друг с другом. В этих случаях после разрушения дисульфидных связей при диагональном электрофорезе можно обнаружить два смещенных компонента.