Аминокислоты, пептиды и белки - Дэвени Т., Гергей Я. 1976
Методы иммунохимического анализа
Анализ белков методами диффузии в геле
Метод двумерной двойной диффузии в геле по Ухтерлони
Принцип метода. Растворы антигена и иммунной сыворотки диффундируют навстречу друг другу в плоском слое агарового геля. В месте встречи антигена и антитела образуется преципитат.
Область применения. Метод позволяет непосредственно сравнивать различные белки (антигены) или специфические иммунные сыворотки. Он используется для выявления определенных белков в белковых смесях, для определения антигенной идентичности, общности или различий между белками.
ПРИНАДЛЕЖНОСТИ ДЛЯ ПОСТАНОВКИ РЕАКЦИИ
1. Чашки Петри.
2. Металлические кубики с гранью размером 10 мм.
3. Набор штампов для вырезания лунок в агаровом геле.
МЕТОДИКА
1. Очистка агара и приготовление геля (см. стр. 127).
2. Приготовление агаровой пластинки. Обычно реакцию ставят в плоском слое агарового геля, затвердевшего на дне чашки Петри. Сначала внутреннюю поверхность чашки Петри покрывают агаровой пленкой. Для этого ее наполняют 0,1 %-ным расплавленным агаром, затем сразу же агар выливают, а чашки переносят в эксикатор для полного высушивания. Другой вариант подобной процедуры состоит в том, что покрывают дно чашки Петри слоем 1%-ного расплавленного агара толщиной примерно 1 мм. В качестве консерванта в агар следует добавить мертиолат.
В подготовленные чашки Петри наливают расплавленный в физиологическом растворе 1%-ный агар, содержащий 0,1% мертиолата, таким образом, чтобы получился слой толщиной 3—4 мм. В приготовленном слое агарового геля делают лунки для внесения исследуемых образцов.
3. Приготовление лунок. Лунки в слое агарового геля для внесения исследуемых образцов можно сделать двумя способами:
а) В чашку Петри, покрытую изнутри пленкой агара, помещают три металлических кубика с гранью 10 мм, расставив их на расстоянии 1 см один от другого, как показано на фиг. 23. Затем в чашку наливают расплавленный агар, образующий слой толщиной 3 — 6 мм, и помещают ее в холодильник. После затвердения агара и удаления металлических кубиков в слое агарового геля остаются лунки, точно соответствующие форме и размерам кубиков.
б) Для приготовления лунок цилиндрической формы применяют специальные штампы или стеклянные трубки соответствующего диаметра. Осторожно надавливая, их вертикально погружают в агаровый гель в нужном месте, стараясь не повредить соседние участки геля. Вырезав контуры лунок, штампы или стеклянные трубки извлекают, а вырезанные столбики агара удаляют, отсасывая их при слабом вакууме иглой большого диаметра.
4. Внесение исследуемых образцов, учет реакции преципитации. Исследуемый материал (растворы антигенов, иммунные сыворотки) заливают в приготовленные лунки в агаровой пластинке.
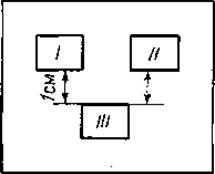
Фиг. 23. Схема размещения исследуемых образцов в агаровом геле при постановке реакции преципитации по Ухтерлони [17] (подробное описание см. в тексте).
Если необходимо провести сравнение двух белковых растворов или двух смесей белков, их вносят в две верхние лунки (I и II на фиг. 23), а специфическую иммунную сыворотку — в нижнюю (III).
После внесения образцов в агар следует обеспечить достаточную влажность в чашке, чтобы предотвратить его высыхание. Легче всего это сделать, поместив отрезок увлажненной фильтровальной бумаги на внутреннюю поверхность крышки, закрывающей чашку Петри.
Чашки с агаром можно оставить при комнатной температуре или перенести в холодильник. Их следует ежедневно просматривать, отмечая появление полос преципитации. В зависимости от условий опыта срок наблюдения может ограничиться сутками или же продлиться несколько дней, а то и недель.
ПРИМЕЧАНИЯ
1. Внесенные образцы диффундируют в геле равномерно по всем направлениям, и в тех участках геля между лунками, где возникает оптимальное соотношение концентраций антигена и антител, образуется полоса преципитации.
2. Оценка результатов:
а) Легкое искривление преципитационной полосы между лунками наблюдается в том случае, если иммунная сыворотка, заполняющая какую-либо лунку, содержит антитела (анти-А) к антигену (А), заполняющему одну из двух других лунок (фиг. 24,1).
б) Полосы преципитации переходят одна в другую, если в двух верхних лунках содержатся одинаковые белковые антигены (А), а диффундирующая из нижней лунки антисыворотка содержит специфические (анти-А) антитела. Эта картина демонстрирует идентичность антигенов (фиг. 24,2).
в) Частичное слияние полос преципитации (образование шпоры) происходит в том случае, если образцы, заполняющие две верхние лунки, состоят из двух антигенных компонентов, один из которых является общим (Аху и Ау), а иммунная сыворотка содержит антитела, специфичные к обоим антигенным компонентам (анти-Ах и анти-Ау). Это картина антигенной общности (фиг. 24,3). Форма и длина шпоры, образующейся в месте частичного слияния полос преципитации, зависят от степени антигенной общности исследуемых образцов. При тесной близости антигенов, т. е. если они имеют много идентичных детерминант, образуется короткая и прилегающая к сливающимся полосам шпора. Если сравниваемые антигены имеют мало идентичных детерминантных групп, то образуется длинная шпора, круто отходящая от сливающихся полос преципитации.
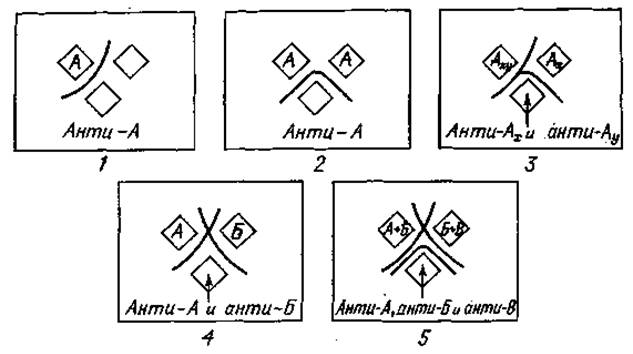
Фиг. 24. Оценка результатов реакции двумерной двойной диффузии в геле (подробное описание см. в тексте).
г) Полосы преципитации пересекаются, если обе верхние лунки заполнены растворами разных антигенов (антигенами А и Б), а в третьей лунке находится иммунная сыворотка, содержащая антитела к обоим антигенам (анти-А и анти-Б). Это картина различия антигенов (фиг. 24, 4).
д) Если верхние лунки содержат две разные смеси антигенов (А + Б и Б + В), а иммунная сыворотка, заполняющая третью лунку, содержит антитела к каждому антигенному компоненту этих смесей (анти-А, анти-Б и анти-В), образуется несколько полос преципитации; при этом можно наблюдать картину как идентичности, так и различия антигенов (фиг. 24,5).
е) Закономерности, о которых сообщается в пунктах примечаний а—д, справедливы лишь для равновесных систем с примерно равными концентрациями антигенов в разных лунках. При значительных различиях этих концентраций, т. е. в неуравновешенных системах, происходит асимметричное слияние полос преципитации; преципитат образуется дальше от лунки, содержащей более концентрированный раствор антигена, и ближе к лунке, наполненной менее концентрированным раствором антигена. При слишком больших различиях в концентрациях антигенов могут вообще образоваться двойные полосы преципитации или ложные шпоры. В отличие от истинных шпор, указывающих на частичное антигенное сходство, ложные шпоры не становятся более заметными в ходе инкубации, а, наоборот, постепенно теряют четкость и в конце концов исчезают.
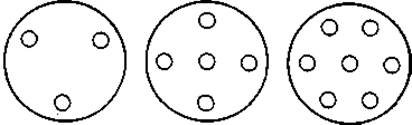
Фиг. 25. Схемы расположения лунок в агаровом геле.
3. Число полос преципитации, появляющихся в агаре при использовании этого метода, соответствует минимальному числу отдельных систем антиген — антитело, принимающих участие в реакции.
4. Расположение и кривизна полос преципитации зависят также от молекулярных весов реагирующих белков. Если молекулярный вес антигена меньше молекулярного веса антител, то полоса преципитации изгибается в сторону лунки, заполненной иммунной сывороткой. Если же молекулярный вес антигена больше молекулярного веса антител, то полоса преципитации сдвигается и изгибается в сторону лунки, заполненной антигеном.
5. При работе с низкоконцентрированными растворами антигена случается, что однократного заполнения лунки недостаточно для появления полосы преципитации, но повторно внести раствор антигена можно только после того, как лунка полностью опустошится. Следует помнить, что повторное заполнение может стать причиной образования двойной полосы преципитации.
6. В зависимости от количества анализируемых образцов число и схема расположения лунок в агаровой пластинке могут варьировать. На фиг. 25 представлено несколько часто используемых схем расположения лунок. Лунки в агаровом геле можно сделать так, как описано выше (стр. 131), или с помощью специального приспособления.
7. Предварительный анализ исследуемых образцов можно легко и быстро провести в слое агара на стеклянной пластинке, разместив лунки на расстоянии 3—5 мм одна от другой в два параллельных ряда. Благодаря небольшому расстоянию между лунками, заполненными антигеном и иммунной сывороткой, полосы преципитации должны появляться весьма быстро. Подобным образом можно также проводить предварительное титрование растворов антигена или иммунной сыворотки, заполнив ряды лунок реагентами в соответствующих разведениях.
Другой способ состоит в том, что в слое агара на пластинке вырезают полоску шириной 1 мм на расстоянии 3—5 мм от ряда лунок; в образовавшийся желобок вносят иммунную сыворотку, а в лунки — раствор антигена.
8. Результаты реакции можно регистрировать фотографированием либо нативного препарата, либо окрашенных полос преципитации.
А. Непосредственная фотопечать с агаровой пластинки. После образования полос преципитации поверхность агарового геля промывают дистиллированной водой и помещают препарат, подобно негативной фотопластинке, в фотоувеличитель. Далее поступают точно так же, как при обычной фотопечати. При помощи объектива фотоувеличителя полосы преципитации фокусируют на светочувствительной бумаге. Рекомендуется печатать на контрастной фотобумаге и использовать контрастный проявитель.
Б. Окрашивание полос преципитации. Окрашивание агаровых пластинок не только делает полосы преципитации более заметными, но и повышает точность анализа за счет дополнения его специфическими цветными реакциями. Специальные методы окрашивания позволяют, кроме того, более подробно изучать белки и липопротеиды.
а) Подготовка агаровой пластинки для окрашивания. После образования полос преципитации производят элюирование из агарового геля тех белков, которые не участвовали в реакции преципитации. Для этого агаровую пластинку заливают0,9%-ным раствором NaCl и проводят элюирование в течение 48 ч, 2—3 раза в день меняя элюирующую жидкость.
После элюирования агаровый гель сверху покрывают листом фильтровальной бумаги соответствующего размера, смоченным дистиллированной водой, и высушивают в термостате при 37°С. После полного высушивания агаровой пластинки покрывающую ее фильтровальную бумагу отклеивают, смочив несколькими каплями дистиллированной воды, и затем окрашивают сухую пленку агара в той же чашке Петри, в которой была поставлена реакция.
б) Окрашивание белка амидовым черным. Окрашивающий раствор: 0,1 г амидового черного 10В растворяют в 100 мл смеси уксусная кислота — метанол (1 : 9).
Отмывающий раствор, смесь уксусная кислота—метанол (1 : 9).
Перед окрашиванием на высушенную агаровую пластинку наливают 10%-ную уксусную кислоту и оставляют ее на 10 мин. Затем уксусную кислоту сливают и на 60 мин заливают препарат раствором амидового черного. После этого краситель сливают, а избыток его удаляют отмывающим раствором, меняя этот раствор каждые 15 мин, пока он не будет оставаться бесцветным.
в) Окрашивание белков кислым фуксином. Окрашивающий раствор: 2,0 г кислого фуксина растворяют в 500 мл метанола, добавляют 400 мл дистиллированной воды и 100 мл уксусной кислоты.
Дифференцирующий раствор: 500 мл метанола смешивают с 400 мл дистиллированной воды и 100 мл уксусной кислоты.
Отмывающий раствор: 10%-ная уксусная кислота.
Перед окрашиванием агаровые пластинки обрабатывают 10 мин 10%-ной уксусной кислотой.
После 30 мин окрашивания окрашивающий раствор сливают и агаровую пластинку заливают дифференцирующим раствором. Затем препарат обрабатывают отмывающим раствором, меняя его каждые 15 мин, пока не прекратится элюирование красителя.
г) Окрашивание белков азокармином. Окрашивающий раствор: 0,5%-ный раствор азокармина в смеси метанол—уксусная кислота (9 : 1).
Отмывающий раствор: смесь метанол—уксусная кислота (9 : 1).
Время окрашивания: 60 мин. При отмывании следует менять отмывающий раствор каждые 15 мин.
д) Окрашивание белков пунцовым S. Окрашивающий раствор: 0,15%-ный раствор пунцового S в 3%-ной трихлоруксусной кислоте.
Отмывающий раствор: 5%-ный раствор уксусной кислоты.
Время окрашивания: 60 мин. При отмывании следует менять отмывающий раствор каждые 15 мин.
е) Окрашивание липопротеидов Суданом черным. Основной раствор красителя: 500 мг Судана черного ВВ растворяют в 500 мл метанола. До использования основной раствор красителя следует не менее недели выдержать в темном месте.
Окрашивающий раствор: 100 мл основного раствора красителя смешивают со 180 мл метанола и 120 мл дистиллированной воды. Перед окрашиванием раствор фильтруют через бумажный фильтр. После 60 мин окрашивания пробы отмывают водопроводной водой.
ж) Окрашивание липопротеидов жировым красным. Окрашивающий раствор: 0,5%-ный раствор жирового красного в 50%-ном. этаноле.
Отмывающий раствор: 50%-ный этанол.
Время окрашивания: 2 ч. Отмывающий раствор следует менять каждые 15 мин.