Биохимия и молекулярная биология - Белясова Н.А. 2002
Молекулярные основы и механизмы наследственности
Экспрессия генов
Трансляция генетического кода
Трансляция — это процесс декодирования мРНК, в результате которого информация с языка последовательности нуклеотидов в мРНК переводится (транслируется) на язык последовательности аминокислот в полипептидной молекуле. Декодирование мРНК осуществляется в направлении 5' → 3'. В процессе трансляции различают стадии:
1) активация аминокислот;
2) аминоацилирование тРНК;
3) собственно трансляция.
Активация аминокислот. Это процесс присоединения аминокислоты с помощью своей карбоксильной группы к a-фосфату АТР с помощью специфической аминоацил-тРНК-синтетазы (рис. 3.10). Реакция сопровождается высвобождением неорганического пирофосфата и образованием аминоацил-аденилата (АК-АМР). Аминоацил-аденилат обладает очень высокой реакционной способностью и стабилизируется благодаря прочному связыванию с ферментом. Данный процесс характеризуется высокой специфичностью: для каждой аминокислоты существует собственный фермент (ферменты).
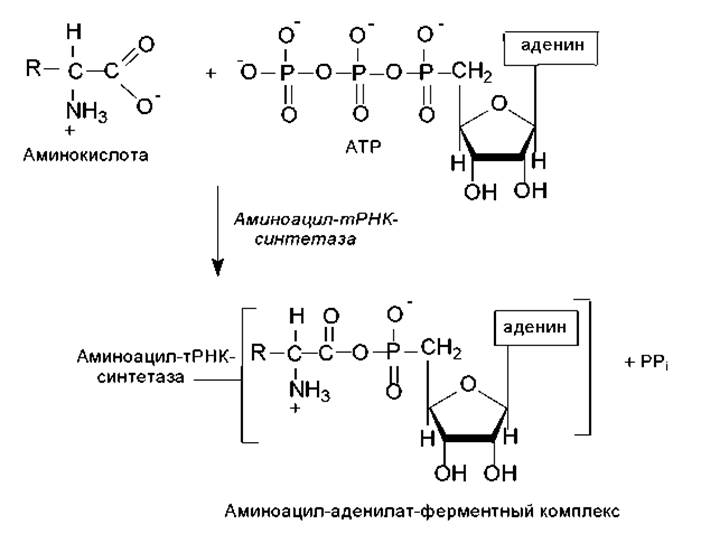
Рис. 3.10. Активация аминокислот в ходе трансляции
Аминоацилирование тРНК. Представляет собой перенос аминоацильной группы от связанного с ферментом аминоацил-аденилата на 2'- или 3'-ОН-группу концевой рибозы тРНК в акцепторной ветви (рис. 3.11).
Ключевой особенностью реакции, приводящей к аминоацилированию тРНК, является специфичность участвующих в ней ферментов. Присоединение к тРНК каждой из 20 аминокислот, встречающихся в белках, катализируется определенной аминоацил-тРНК-синтетазой. Фермент должен отличить одну аминокислоту от 19 других и перенести ее к одной или нескольким изоакцепторным тРНК из имеющихся примерно 75 других тРНК. При этом следует подчеркнуть высокое сходство в структуре многих аминокислот (лейцин, валин и изолейцин; валин и треонин; аспарагиновая и глутаминовая кислоты; и др.), а также удивительное сходство вторичной и третичной структур тРНК. Поэтому даже очень высокой специфичности, присущей данным ферментам, оказывается недостаточно, чтобы не допустить ошибок, и синтетазы могут исправлять ошибки, происходящие при присоединении. Это имеет место при гидролизе связи между аминокислотой и АМР в комплексе фермент—аминоацил—аденилат. В таком случае формирование ошибочно аминоацилированной тРНК предотвращается. Напротив, механизм, с помощью которого удалялось бы уже присоединенная к тРНК неправильная аминокислота, отсутствует. В таких случаях аминокислота занимает неправильную позицию в белке. Частота таких ошибок очень низка (например, в гемоглобине кролика 10-5).
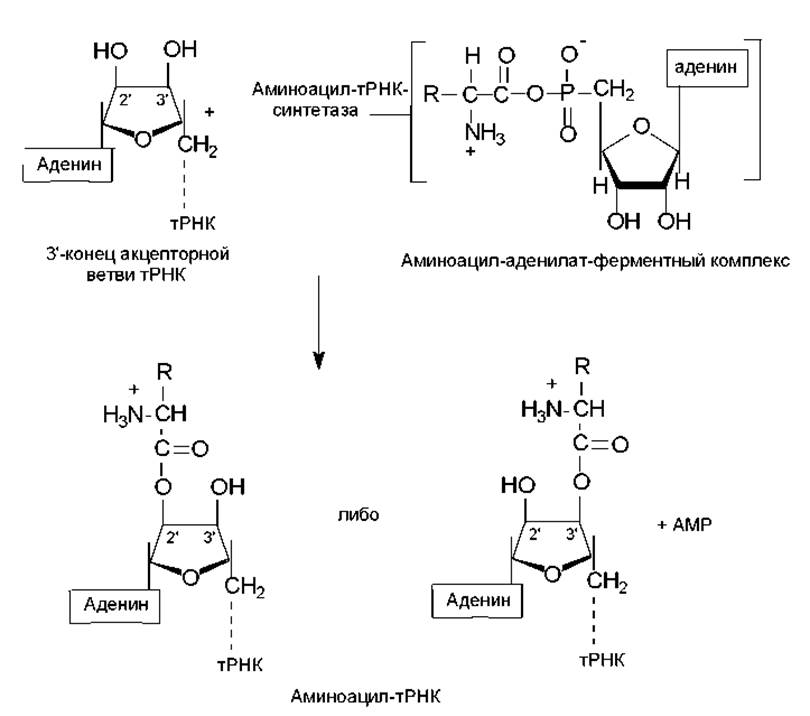
Рис. 3.11. Образование аминоацил-тРНК
Собственно трансляция. Процесс трансляции осуществляется на рибосомах — клеточных органеллах, представляющих собой сложный комплекс из белков и молекул РНК. В течение всего процесса синтеза белка растущая полипептидная цепь, мРНК и очередная аминоацил-тРНК остаются прикрепленными к рибосоме. У прокариот и эукариот рибосомы различаются по величине и составу (рис. 3.12). Коэффициент седиментации рибосом прокариот составляет 70S (S — Сведберг, единица измерения скорости, с которой частица оседает при центрифугировании; 1S = 10-13 с), а у эукариот для рибосом, обнаруживаемых в цитоплазме, он равен 80S.
Рибосомы при определенных условиях могут диссоциировать на большую и малую субчастицы, а каждая субчастица, в свою очередь, на составляющие молекулы белка и РНК (рис. 3.12). Все эти компоненты могут снова ассоциировать с образованием функционально активной рибосомы, если созданы соответствующие условия.
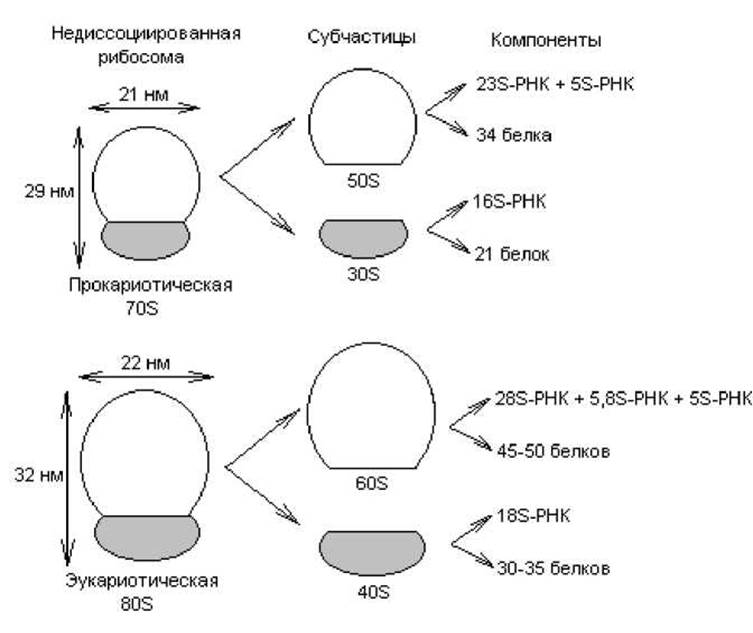
Рис. 3.12. Структура и состав рибосом прокариотических и эукариотических клеток
Электронно-микроскопические исследования 70S-рибосом показали, что малая и большая субчастицы соприкасаются в нескольких точках, причем между ними образуется бороздка, необходимая для размещения мРНК во время трансляции. Для понимания процесса трансляции важны два основных в функциональном отношении участка на 70S-рибосоме. Участок (сайт) А служит для присоединения аминоацил-тРНК, а с сайтом Р связывается растущая пептидная цепь.
В процессе трансляции, кроме аминоацил-тРНК и рибосом, принимает участие большое количество вспомогательных белков — факторов инициации, элонгации и терминации транскрипции.
Суть процесса трансляции состоит в последовательном декодировании мРНК в направлении 5'→3' с помощью аминоацилированных тРНК, в ходе которого происходит последовательная конденсация аминокислотных остатков, начиная с амино-(Н)-конца полипептидной цепи, в направлении к карбоксильному (С)-концу. Матричный принцип процесса соблюдается при узнавании комплементарных нуклеотидов в составе очередного кодона мРНК и антикодона тРНК. Наиболее полно трансляция изучена у прокариот, и механизм этого процесса будет рассмотрен на примере трансляции у E. coli.
Инициация трансляции. Считывание мРНК начинается с кодона AUG, который обозначает 5'-конец кодирующей последовательности и детерминирует N-концевую (первую) аминокислоту синтезируемого полипептида. Для инициации трансляции необходимо наличие 30S-субчастицы рибосомы, которая связывается в комплекс с белками — факторами инициации (IF1, IF2, IF3), GTP и Fmet-тРНК. Такой полный комплекс связывается с 5'-концом кодирующей последовательности мРНК вблизи кодона AUG. Очевидно, IF2 способен отличить Fmet-тРНК (формил-метионин-тРНК) от met-тРНК, которая связывается с кодонами AUG во внутренней части мРНК, но не может начать трансляцию со стартового кодона AUG. Эта специфичность обеспечивается N-формильной группой, отсутствующей у met-тРНК.
Распознавание стартового кодона осуществляется следующим образом. Связывание 30S-субчастицы с мРНК находится под строгим контролем нуклеотидной последовательности, расположенной примерно за 10 нуклеотидов до 5'-конца стартового кодона. Взаимодействию способствует комплементарное спаривание этой богатой пуринами последовательности с полипиримидиновым участком, находящимся в составе 16S-рРНК. Процесс инициации зависит от многих условностей в структуре взаимодействующих участков, в том числе от вторичной структуры того участка молекулы мРНК, в котором находится стартовый кодон AUG. Это имеет значение для процессов регуляции эффективности синтеза белка.
Итак, при инициации указанный комплекс связывается с Р-сайтом 30S-субчастицы рибосомы, и первой аминокислотой в составе пептида будет формил-метионин. Далее следует присоединение 50S-субчастицы рибосомы и формируется 70S-инициирующий комплекс (рис. 3.13). Источником энергии для инициации синтеза белка служит расщепление GTP до GDP и Pi.
Элонгация трансляции. Для образования первой пептидной связи необходимо, чтобы аминоацил-тРНК, соответствующая следующему кодону, заняла А-участок рибосомы. Для этого аминоацил-тРНК должна сначала связать белок EF-Tu (один из факторов элонгации) и GTP. Образовавшийся тройной комплекс (аминоацил-тРНК- [EF-Tu-GTP]) и доставляет аминоацил- тРНК к А-участку. GTP в это время гидролизуется, и комплекс (EF-Tu-GDP) отделяется от рибосомы. Когда оба участка, А и Р, заняты, пептидилтрансферазная активность 50S-субчастицы катализирует перенос группы Fmet с ее тРНК на аминогруппу аминоацил-тРНК, находящуюся в А-участке (рис.3.14). В результате в А-участке оказывается дипептидил-тРНК, а в Р — свободная тРНК (рис. 3.13).
Пептидилтрансферазная активность рибосом связана, по-видимому, не с белковой частью 50S-субъединицы, а с одним из РНК-компонентов — рибозимов.
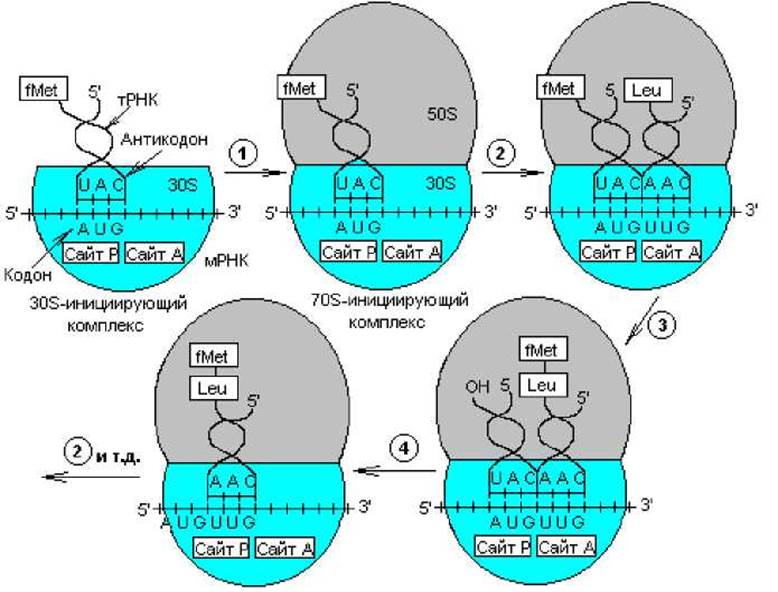
Рис. 3.13. Трансляция генетического кода: 1 — образование 70S-инициирующего комплекса; 2 — связывание аминоацил-тРНК с участком А рибосомы; 3 — формирование пептидной связи; 4 — транслокация рибосомы. В процессе элонгации повторяются стадии 2—4
Для прочтения следующего кодона и удлинения полипептидной цепи еще на одну аминокислоту вся серия реакций должна повториться. Однако прежде чем это произойдет, свободная тРНК освобождает Р-участок, образовавшаяся дипептидил-тРНК перемещается на него с А-участка (при этом не происходит взаимодействия кодона с антикодоном), а рибосома продвигается скачкообразно (на 3 нуклеотида) в сторону 3'-конца мРНК. Все эти процессы осуществляются с помощью фактора элонгации EF-G при GTР-зависимой транслокации рибосомы. В результате этих трех актов освобождается участок А и экспонируется следующий кодон, что позволяет начаться следующему циклу элонгации (рис. 3.13). Следует отметить, что при образовании каждой пептидной связи расходуется энергия, равная четырем энергетическим эквивалентам (если за один эквивалент принять энергию образования фосфатной связи): два эквивалента АТР потребляются при аминоацилировании тРНК и два эквивалента GTР — в каждом цикле элонгации.
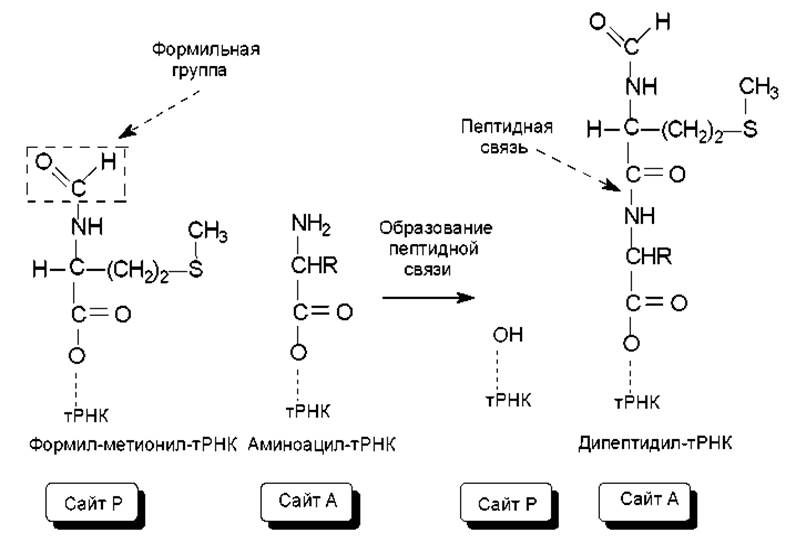
Рис. 3.14. Образование пептидной связи между первыми двумя аминокислотами на рибосомах
Терминация трансляции. Процесс последовательной трансляции кодонов, в конце концов, доходит до того момента, когда в А-участке оказывается один из трех терминирующих кодонов — UAG, UAA или UGA. В природе не существует таких тРНК, антикодоны которых соответствовали бы этим кодонам. Здесь вступают в действие факторы терминации — RF-1 и RF-2, которые катализируют отсоединение полипептидной цепи от тРНК, тРНК — от рибосомы, а 70S-рибосому — от мРНК.
После инициации трансляции 70S-рибосома удаляется от сайта инициации по мере считывания каждого последующего кодона. Когда расстояние от рибосомы до сайта инициации достигнет величины 100—200 нуклеотидов, в этом сайте может произойти новая инициация. Более того, как только вторая рибосома пройдет такое же расстояние, может произойти третья инициация, и т. д. Итак, одну и ту же белок-кодирующую последовательность мРНК могут одновременно транслировать несколько рибосом. Подобные мультирибосомные трансляционные комплексы называются полирибосомами или полисомами.
Матричные РНК, состоящие из нескольких белок-кодирующих участков, часто транслируются последовательно: когда рибосома доходит до терминирующего кодона в первой последовательности, она отделяется от мРНК и со следующим инициирующим участком связывается новый комплекс. Иногда этого не происходит, и транслирующая первую кодирующую последовательность рибосома, не отделяясь, перемещается вдоль мРНК, инициируя трансляцию в других сайтах.
В некоторых случаях трансляция первой кодирующей последовательности может начаться и даже завершиться еще до окончания транскрипции остальных последовательностей, как, например, в случае lac- или trр-оперонов E.coli.
Особенности трансляции у эукариот. Процесс трансляции эукариотической мРНК в основном аналогичен таковому для прокариот. Однако имеется ряд отличий. Во-первых, аппараты транскрипции и трансляции у эукариот разобщены во времени и в пространстве, поскольку транскрипция осуществляется в ядре, а трансляция — в цитоплазме. Во-вторых, инициирующей аминоацил-тРНК у эукариот служит не Fmet-тРНК, а специальная инициирующая met-тРНК. В-третьих, на 5'- и 3'-концах эукариотичеких мРНК имеются особые структуры — «кэпы» и «шлейфы», принимающие участие в трансляции. Известно, что отдельные факторы инициации трансляции узнают кэпированные области для связывания с мРНК и начала процесса трансляции.