Биохимия и молекулярная биология - Белясова Н.А. 2002
Структура и функции клеточных компонентов
Белки. Особенности организации и функции ферментов
Белки представляют собой один из основных классов клеточных макромолекул, составляя, например, в микробной клетке до 50% сухого вещества. Этим удивительным по разнообразию полимерам присущи одни из наиболее важных и разносторонних клеточных функций.
Мономерными единицами белков служат аминокислоты. Природные аминокислоты являются 2-аминокарбоновыми кислотами, или a-аминокислотами. В их молекулах при атоме С-2 (Са) имеются 4 различных заместителя (рис. 6.1). Таким образом, все a-аминокислоты, кроме глицина, имеют асимметрический (хиральный) a-углеродный атом (рис. 6.1) и существуют в виде двух энантиомеров — L- и D-аминокислот. В большинстве природных пептидов содержатся L-аминокислоты.
Аминокислоты различаются структурой боковых цепей и степенью их полярности. На рис. 6.2 изображено строение боковых групп 20-ти протеиногенных (положение которых в полипептидах кодируется генетическим кодом) аминокислот. Из них выраженными неполярными (гидрофобными) свойствами характеризуются боковые группы аланина, валина, лейцина, изолейцина, метионина, цистеина, фенилаланина. Заряженные боковые цепи содержатся в составе кислых аминокислот (аспарагиновой, глутминовой) и основных аминокислот (лизина, аргинина, гистидина).
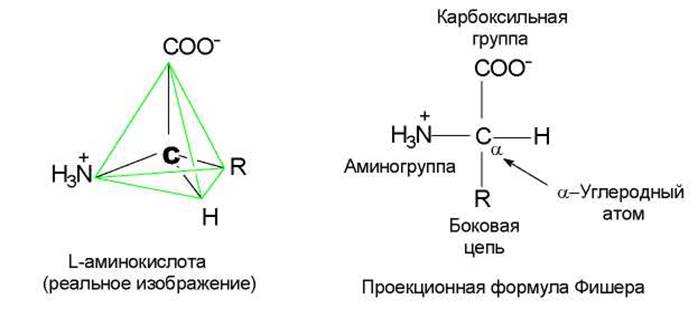
Рис. 6.1. Особенности строения L-аминокислот
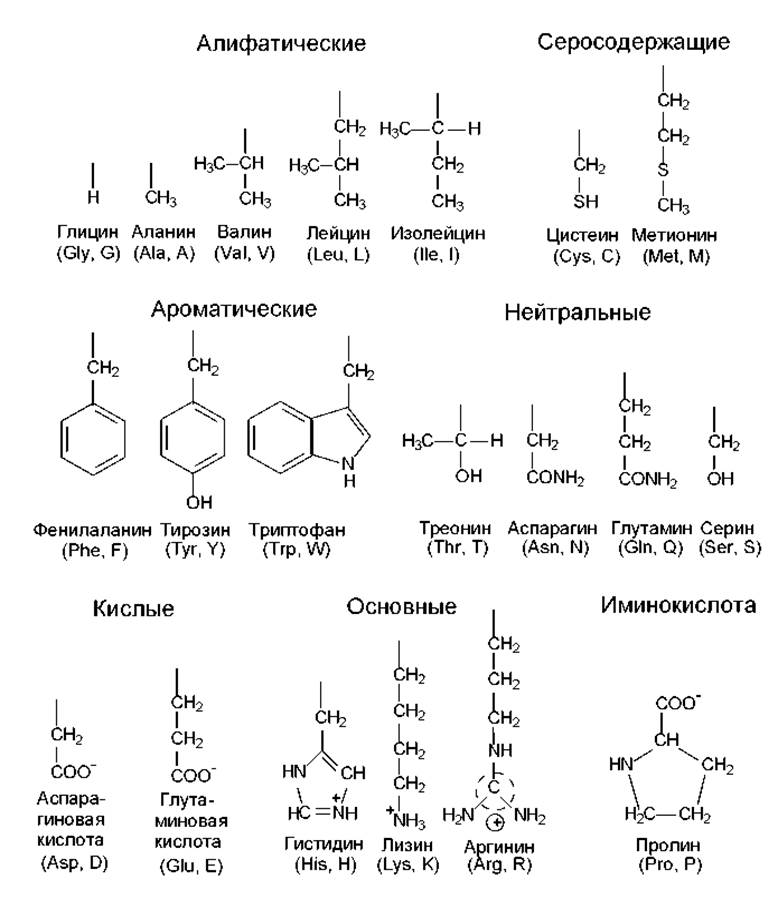
Рис. 6.2. Строение боковых цепей протеиногенных аминокислот
a-Аминокислоты в водных растворах при нейтральных рН существуют преимущественно в виде диполярных ионов (цвиттер-ионов), у которых аминогруппы протонированы, а карбоксильные группы диссоциированы (рис. 6.1).
Остатки аминокислот в пептидах соединяются друг с другом пептидной (карбоксамидной) связью, в формировании которой принимают участие a-карбоксильная группа одной и a-аминогруппа другой аминокислоты. В ходе этой реакции выделяется вода (рис.6.3).
Первичная структура белков характеризует их аминокислотную последовательность, которая определяет другие уровни организации этих полимеров — вторичную, третичную и четвертичную структуру. Под вторичной структурой обычно подразумевают структуру участков полипептидной цепи с упорядоченной конформацией, стабилизированной водородными связями между СО- и NH-группами. Подобные участки называют элементами вторичной структуры и различают несколько их типов: правую a-спираль (наиболее распространенный элемент), левую a-спираль, антипараллельный и параллельный ß-складчатый лист, ß-петлю. В фибриллярных белках, которые обычно выполняют структурную функцию, регулярные вторичные структуры распространяются на достаточно протяженные фрагменты молекулы и представлены чаще каким-либо одним типом. К тому же для этих белков характерно формирование ансамблей взаимодействующих между собой вторичных структур, что обусловливает особую прочность формируемых волокон. Например, коллаген — белок соединительной и костной тканей, сухожилий, хрящей — представляет собой правую тройную спираль, скрученную из трех первичных левых спиралей.
В глобулярных белках (растворимые, с формой, близкой к сферической), которые выполняют в клетках специфические функции, в том числе обладают каталитической активностью, обычно присутствуют одновременно и a- спирали, и ß-складчатые листы. Кроме этого имеются участки с неупорядоченной структурой. В молекуле инсулина (см. разд. 21.3), например, на долю участков, представленных a-спиралью, приходится 57%, ß-складчатой структурой — 6%, ß-петлей — 10%. Остальная часть молекулы (27%) не имеет упорядоченной структуры.
Под третичной структурой понимают расположение в пространстве атомов и формируемых ими элементов вторичной структуры полипептида, иными словами, трехмерную функционально активную конформацию белка. Каждый белок характеризуется своей уникальной пространственной структурой. Стабилизация конформации белковых молекул обеспечивается водородными связями, дисульфидными мостиками, электростатическим взаимодействием, комплексообразованием с ионами металлов, гидрофобными эффектами.
Многие белковые молекулы образуют симметрично построенные комплексы, стабилизированные за счет нековалентных взаимодействий. Взаимное расположение составных единиц комплексов (субъединиц) определяет четвертичную структуру белка.
Обычно в белковых молекулах насчитывается несколько десятков аминокислотных остатков, однако встречаются полипептиды, содержащие сотни и даже тысячи мономерных звеньев. При этом число типов мономерных единиц (различающихся своей боковой цепью аминокислот) в большинстве природных белков составляет 20. Поистине огромная вариабельность структуры разных белков определяется последовательностью аминокислот, число различных вариантов которой описывается величиной 20n, где n — количество аминокислотных остатков в белке. Последовательность аминокислот в полипептиде определена генетически. Белковая молекула может состоять из одной или нескольких полипептидных цепей.
Кроме простых белков, в состав которых входят только аминокислоты, существуют сложные белки, которые могут содержать ионы металлов (металлопротеины), молекулы пигментов (хромопротеины), образовывать комплексы с другими молекулами (липопротеины, нуклеопротеины, гликопротеины), ковалентно связывать неорганический фосфат (фосфопротеины).
Химические свойства белков обусловлены набором и соотношением аминокислот с гидрофильными и гидрофобными боковыми группами. К биологическим свойствам белков относятся, в первую очередь, каталитическая (ферментативная), транспортная (транспортировка веществ в организме и перенос их через биомембраны), структурная (в составе хромосом, цитоскелета, соединительных, мышечных, опорных тканей), регуляторная (способность регулировать скорость химических реакций в клетке и уровень метаболизма в целом организме) и рецепторная функции. Кроме этого, белкам присущи защитные, запасные, токсические, сократительные и некоторые другие функции. Большинство перечисленных биологических свойств белков уже охарактеризованы в предыдущих главах. Здесь внимание будет уделено биокаталитической активности белковых молекул.