Биохимия и молекулярная биология - Белясова Н.А. 2002
Основы генетической инженерии
Практическое использование методов генетической инженерии
Локализованный мутагенез и белковая инженерия
Методы генетической инженерии, в частности клонирование индивидуальных генов или их частей, а также секвенирование ДНК, позволили значительно усовершенствовать методологию мутагенеза, устранив основные недостатки классических способов индукции мутаций в геномах. Классический генетический анализ предполагает воздействие мутагенного фактора in vivo на целый геном, в результате чего в нем возникают случайные мутации, зачастую множественные, что сильно осложняет идентификацию мутантов. Выявление мутантных особей осуществляют по измененным фенотипическим признакам, а природу мутации можно определить после секвенирования ДНК. Современный локализованный мутагенез, по сути, предполагает обратные действия: вначале клонируют интересующий ген или его сегмент, определяют его структуру в ходе секвенирования, а потом in vitro вносят требуемые изменения в его состав. Последствия вызванной мутации определяют после введения мутантного гена в исходный организм.
Самый простой вариант локализованного мутагенеза состоит в обработке клонированного фрагмента ДНК одним из мутагенных факторов, однако результатом такого воздействия будут тоже случайные изменения в структуре фрагмента. Более надежные и чаще применяемые методы локализованного мутагенеза осуществляются без использования мутагенных факторов. Среди типов мутаций преобладают делеции, вставки и замены нуклеотидов.
Делеции. Эти типы мутаций при локализованном мутагенезе получают с помощью эндонуклеаз. Используют как рестриктирующие, так и неспецифические эндонуклеазы. Наиболее простой случай использования рестриктаз состоит в расщеплении какого-либо генома с помощью рестриктазы, вносящей несколько разрывов с образованием липких концов. Полученные фрагменты вновь замыкают в кольцо с помощью ДНК-лигазы, что может привести к образованию молекул, не содержащих один из сегментов ДНК. При таком подходе формируются протяженные делеции, и его используют, как правило, в предварительных экспериментах, чтобы определить функции относительно больших участков клонированной ДНК.
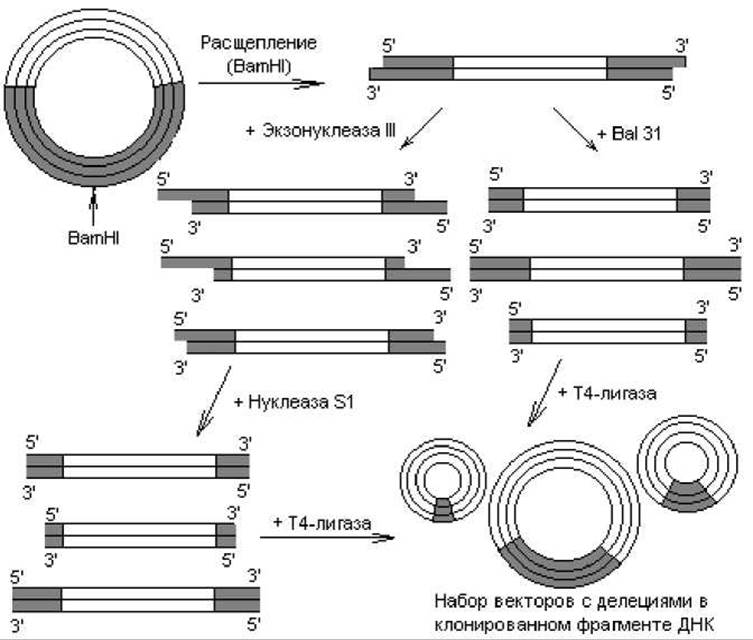
Рис. 21.1. Получение делеций в клонированных фрагментах ДНК с помощью рестрикционных ферментов. Темным цветом выделена чужеродная ДНК, светлым — ДНК вектора
Небольшие делеции получают следующим образом. Клонированный фрагмент расщепляют в составе вектора в подходящем сайте с помощью рестриктазы (рис. 21.1). Образовавшуюся линейную молекулу обрабатывают экзонуклеазой III, которая гидролизует в составе ДНК одну цепь, начиная с 3'-конца. В результате получается набор молекул с одноцепочечными 5'-хвостами разной протяженности. Эти хвосты гидролизуют нуклеазой S1, специфичной к одноцепочечной ДНК, и в ДНК формируются делеции. Можно также применять экзонуклеазу Bal 31, которая катализирует деградацию обеих цепей, начиная с концов линейных молекул ДНК. Ход нуклеотических реакций регулируют, варьируя время инкубации, температуру и концентрацию фермента, индуцируя образование делеций разной длины. Полученные делеционные варианты линейных ДНК часто перед циклизацией снабжают линкерами, чтобы в районе делеции присутствовали рестрикционные сайты. Существуют и другие модификации описанных методов.
Вставки (инсерции). Для получения инсерций клонированную ДНК расщепляют рестриктазой или неспецифической эндонуклеазой, а затем лигируют образующиеся фрагменты в присутствии сегмента, который хотят вставить в ДНК. Чаще всего в качестве таких сегментов используют синтезированные химическим путем полилинкеры (глава 20).
Инсерции, как и делеции, способны нарушить целостность гена или структуру его регуляторных областей, в результате чего будет синтезироваться дефектный белок (в случае протяженных делеций или сдвига рамки считывания, как правило, неактивный) либо будут наблюдаться изменения процесса транскрипции интересующего гена. Таким способом чаще получают регуляторные мутанты и конструируют экспрессируемые векторы (глава 20).
Точечные мутации. Эти мутации представляют собой замену нуклеотидов. Для их получения можно использовать несколько подходов: дезаминирование цитозина, включение аналогов нуклеотидов, неправильное включение нуклеотидов при репарации пробела и др.
Первый способ основан на том, что остатки цитозина в одноцепочечной ДНК можно дезаминировать с образованием урацила с помощью обработки ионами бисульфита. Одноцепочечные участки в ДНК получают обычно вблизи сайтов рестрикции, например, при действии экзонуклеазы III. После обработки бисульфитом одноцепочечные бреши застраивают с помощью ДНК-полимеразы и лигируют концы. В сайтах, где вместо цитидилата при дезаминировании образовался уридилат, комплементарное положение займет аденилат, а при репликации такой молекулы произойдет замена пары GС на пару AT.
Другой подход при индукции замен состоит в обработке клонированной ДНК какой-либо рестриктазой в присутствии бромистого этидия, который встраивается между плоскостями пар оснований и вносит нарушения в структуру дуплекса. В результате образуется только однонитевый разрыв ДНК. В месте однонитевого разрыва создают небольшой пробел, а затем застраивают его в присутствии ДНК-полимеразы, dATP, dGTP, dCTP и N-4-гидроксицитозинтрифосфата вместо dTTP. Гидроксицитозинтрифосфат включается в цепь вместо тимидилата, но при репликации ДНК спаривается одинаково хорошо и с аденилатом, и с гуанилатом. В результате включения гуанилата после дополнительного раунда репликации в данном сайте произойдет замена АТ→GC (рис. 21.2). Поскольку в данном методе замена нуклеотидов осуществляется внутри сайта рестрикции, появляется возможность легко различить векторы с исходной последовательностью и мутантные. Для этого достаточно обработать их используемой в эксперименте рестриктазой: мутантные молекулы не подвергнутся расщеплению.
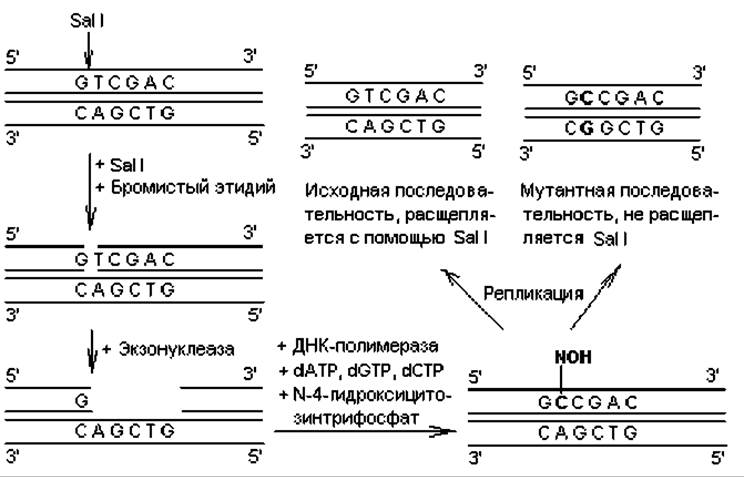
Рис. 21.2. Получение замен нуклеотидов в процессе локализованного мутагенеза
Похожий метод основан на использовании только трех из четырех возможных нуклеотидов при заполнении однонитевой бреши ДНК-полимеразой. В большинстве случаев фермент останавливается в том месте молекулы, где встречается комплементарный отсутствующему нуклеотид. Однако изредка ДНК-полимераза ошибается и включает один из трех присутствующих нуклеотидов. Это приводит к образованию кольцевых молекул, в составе которых присутствуют неспаренные некомплементарные азотистые основания. При введении таких векторов в клетки бактерий в части молекул произойдет репарация такого повреждения. В результате в половине молекул после репликации восстановится исходная последовательность, а в другой половине закрепится мутация. Отличить мутантные молекулы можно описанным выше способом.
Сайт-специфический мутагенез. Охарактеризованные методы локализованного мутагенеза отличаются тем, что сайты, где происходят мутации, выбираются случайно. В то же время техника сайт-специфического мутагенеза позволяет вводить мутации в точно определенный участок гена. Это осуществляется с использованием синтетических (полученных химическим синтезом) олигонуклеотидов с заданной последовательностью. Метод удобен тем, что не требует присутствия удобных сайтов рестрикции. В основу метода положено образование гетеродуплексов между синтетическим олигонуклеотидом, содержащим мутацию, и комплементарной однонитевой ДНК в составе вектора.
Поступают следующим образом. Синтезируют небольшой олигонуклеотид (8—20 мономеров), комплементарный той части гена, в которой хотят получить мутацию. В составе олигонуклеотида в центральной области допускают одну или несколько нуклеотидных замен. Клонируют исследуемый ген или его фрагмент в составе вектора на основе фага М13, чтобы получить кольцевые одноцепочечные рекомбинатные ДНК. Производят смешивание и отжиг рекомбинантных векторов с олигонуклеотидами. Происходит гибридизация олигонуклеотида с комплементарной областью, при этом некомплементарные нуклеотиды остаются неспаренными. Олигонуклеотид выполняет роль праймера в полимеразной реакции с участием ДНК-полимеразы in vitro. Кольцо замыкают лигазами. Полученная кольцевая молекула вводится в клетки E.coli, где происходит частичная репарация мутантных участков и репликация. Частота мутаций обычно варьирует от 1 до 50%. Отбор клеток, содержащих мутантные молекулы ДНК, можно производить несколькими способами, среди которых преимущества имеет метод с использованием радиоактивно меченного олигонуклеотида, который применяется для мутагенеза. В данном случае этот нуклеотид служит зондом. Принцип использования такого зонда основан на том, что он полностью комплементарен мутантной ДНК и частично комплементарен ДНК дикого типа. Можно подобрать такие условия гибридизации (в первую очередь, температуру), что гибридизация меченого зонда будет стабильной только с мутантной последовательностью ДНК, что можно выявить на радиоавтографе.
Метод сайт-специфического мутагенеза особенно ценен тем, что позволяет изолировать мутации без контроля их фенотипического проявления. Этот метод открывает новые возможности исследования функций регуляторных элементов генов, позволяет изменять «силу» промоторов, оптимизировать сайты связывания с рибосомами и т. д. Одним из основных применений данной методологии является белковая инженерия.
Белковая инженерия. Этим словосочетанием обозначают комплекс методических приемов, которые позволяют реконструировать молекулу белка путем направленного введения соответствующих мутаций в структурный ген (сайт-специфический мутагенез) и, следовательно, желаемых аминокислотных замен в первичную структуру белка.
Показательным примером конструирования более активных белков являются эксперименты Фершта и сотрудников с ферментом тирозил-тРНК-синтетазой из бактерий Bacillus stearothermophilus. Анализ последствий замен аминокислот в активном центре этого фермента позволил заключить, что удаление групп, образующих с субстратом слабые водородные связи, может улучшить его сродство к субстрату. При этом обнаружено, что треонин-51 (занимает 51 положение в составе пептида) образует длинную и слабую водородную связь с кислородом кольца рибозы при связывании тирозиладенилата. В то же время обнаружено, что у бактерий E. coli такое же положение занимает пролин. Сайт-специфический мутагенез гена, определяющего структуру тирозил-тРНК-синтетазы B.stearothermophilus, позволил обеспечить замену thr-51→pro-51 в пептиде. В результате резко улучшилось связывание АТР в активном центре фермента, а его каталитическая активность возросла в 25 раз.
Другим, не менее значимым примером реконструкции белка, имеющим практическое значение, является модификация субтилизина из Bacillus amyloliquefaciens, осуществленная Эстеллом и соавторами. Субтилизины представляют собой сериновые протеиназы, секретируемые бациллами во внешнюю среду. Эти ферменты выпускаются биотехнологической промышленностью в больших масштабах и широко используются в составе моющих средств. Недостатком субтилизинов является резкое уменьшение протеолитической активности под действием окислителей, в том числе содержащихся в стиральных порошках. Задача реконструкции молекулы субтилизина BPN заключалась в стабилизации его к химическому окислению.
В предварительных экспериментах было установлено, что в присутствии перекиси водорода субтилизин быстро снижает активность за счет окисления остатка метионина-222, превращающегося в соответствующий сульфоксид. Методами сайт-специфического мутагенеза была обеспечена замена этого остатка метионина на все остальные 19 белковых аминокислот. Плазмиды с мутантными генами вводили в штаммы с делециями в соответствующих генах и анализировали свойства продуцируемых субтилизинов. Достаточно стабильными к действию перекиси оказались мутанты с серином и аланином-222. Самым активным оказался мутант, содержащий остаток цистеина-222, его удельная активность на 38% превышала активность штамма дикого типа.
Аналогичным путем удалось повысить активность ß-интерферона. В числе других достижений белковой инженерии можно назвать исследования в выяснении трансформирующей активности онкобелков; изменение термостабильности ферментов, например получение термолабильного ренина и термостабильной a-амилазы; увеличение эффективности связывания инсулина соответствующим рецептором плазматической мембраны за счет замены гистидина на аспартат в положении 10 ß-цепи гормона, а также множество других примеров. Большое количество продуктов белковой инженерии уже нашло практическое применение в производственных процессах.