БИОХИМИЯ УЧЕБНИК ДЛЯ ВУЗОВ - Е. С. Северина - 2004
РАЗДЕЛ 2. ЭНЗИМОЛОГИЯ
IV. Механизм действия ферментов
Механизм действия ферментов может быть рассмотрен с двух позиций: с точки зрения изменения энергетики химических реакций и с точки зрения событий в активном центре.
А. Энергетические изменения при химических реакциях
Любые химические реакции протекают, подчиняясь двум основным законам термодинамики: закону сохранения энергии и закону энтропии. Согласно этим законам, общая энергия химической системы и её окружения остаётся постоянной, при этом химическая система стремится к снижению упорядоченности (увеличению энтропии). Для понимания энергетики химической реакции недостаточно знать энергетический баланс входящих и выходящих из реакции реагентов, необходимо учитывать изменения энергии в процессе данной химической реакции и роль ферментов в динамике этого процесса. Рассмотрим реакцию разложения угольной кислоты:
H2CO3 —> H2O + CO2.
Угольная кислота слабая; реакция её разложения пойдёт при обычных условиях, если молекулы угольной кислоты имеют энергию, превышающую определённый уровень, называемый энергией активации Еа (рис. 2-10).
Рис. 2-10. Изменение свободной энергии при разложении угольной кислоты.
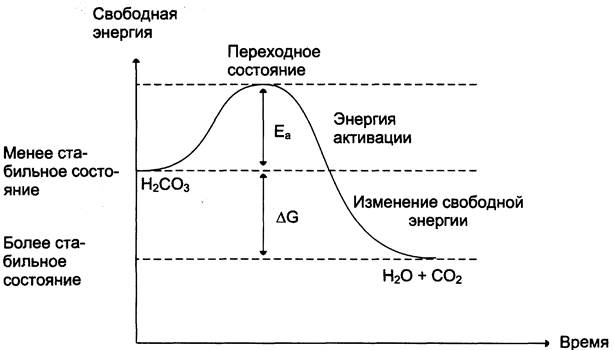
Энергией активации называют дополнительное количество кинетической энергии, необходимое молекулам вещества, чтобы они вступили в реакцию.
При достижении этого энергетического барьера в молекуле происходят изменения, вызывающие перераспределение химических связей и образование новых соединений. Говорят, что молекулы, обладающие Еа, находятся в переходном состоянии. Разницу энергий между исходным реагентом Н2СO3 и конечными соединениями Н2O и СO2называют изменением свободной энергии реакции DG. Молекулы Н2O и СO2 — более стабильные вещества, чем Н2СO3, т. е. обладают меньшей энергией и при обычных условиях практически не реагируют. Выделившаяся энергия в результате этой реакции рассеивается в виде тепла в окружающую среду.
Чем больше молекул обладает энергией, превышающей уровень Еа, тем выше скорость химической реакции. Повысить скорость химической реакции можно нагреванием. При этом увеличивается энергия реагирующих молекул. Однако для живых организмов высокие температуры губительны, поэтому в клетке для ускорения химических реакций используются ферменты. Ферменты обеспечивают высокую скорость реакций при оптимальных условиях, существующих в клетке, путём понижения уровня Еа. Таким образом, ферменты снижают высоту энергетического барьера, в результате возрастает количество реакционноспособных молекул, следовательно, увеличивается скорость реакции.
В механизме ферментативного катализа решающее значение имеет образование нестойких промежуточных соединений — фермент- субстратный комплекс ЕS, подвергающийся превращению в нестабильный переходный комплекс ЕР, который почти мгновенно распадается на свободный фермент и продукт реакции.
Таким образом, биологические катализаторы (ферменты) не изменяют свободную энергию субстратов и продуктов и поэтому не меняют равновесие реакции (рис. 2-11).
Рис. 2-11. Изменение свободной энергии в ходе химической реакции, некатализируемой и катализируемой ферментами. Фермент понижает энергию активации Еа, т. е. снижает высоту энергетического барьера, в результате возрастает доля реакционноспособных молекул, следовательно, увеличивается скорость реакции.
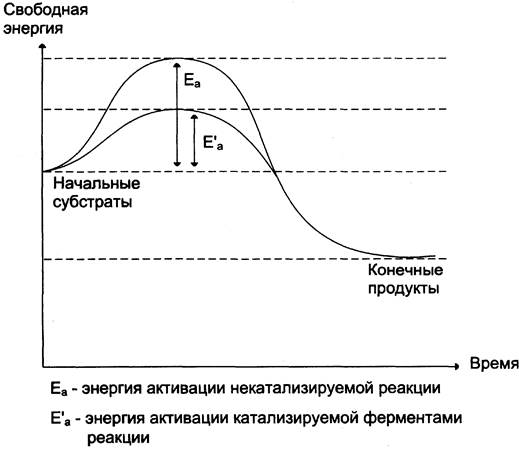
Фермент, выполняя функцию катализатора химической реакции, подчиняется общим законам катализа и обладает всеми свойствами, характерными для небиологических катализаторов, однако имеет и отличительные свойства, связанные с особенностями строения ферментов.
Сходство ферментов с небиологическими катализаторами заключается в том, что:
✵ ферменты катализируют энергетически возможные реакции;
✵ энергия химической системы остаётся постоянной;
✵ в ходе катализа направление реакции не изменяется;
✵ ферменты не расходуются в процессе реакции.
Отличия ферментов от небиологических катализаторов заключаются в том, что:
✵ скорость ферментативных реакций выше, чем реакций, катализируемых небелковыми катализаторами;
✵ ферменты обладают высокой специфичностью;
✵ ферментативная реакция проходит в клетке, т. е. при температуре 37 °С, постоянном атмосферном давлении и физиологическом значении pH;
✵ скорость ферментативной реакции может регулироваться.
Б. Этапы ферментативного катализа
1. Формирование фермент-субстратного комплекса
Тот факт, что ферменты обладают высокой специфичностью, позволил в 1890 г. выдвинуть гипотезу, согласно которой активный центр фермента комплементарен субстрату, т. е. соответствует ему как «ключ замку». После взаимодействия субстрата («ключ») с активным центром («замок») происходят химические превращения субстрата в продукт. Активный центр при этом рассматривался как стабильная, жёстко детерминированная структура.
В 1959 г. был предложен другой вариант гипотезы «ключ — замок», объясняющий события в активном центре фермента. По этой гипотезе активный центр является гибкой структурой по отношению к субстрату. Субстрат, взаимодействуя с активным центром фермента, вызывает изменение его конформации, приводя к формированию фермент-субстратного комплекса, благоприятного для химических модификаций субстрата. При этом молекула субстрата также изменяет свою конформацию, что обеспечивает более высокую эффективность ферментативной реакции. Эта «гипотеза индуцированного соответствия» впоследствии получила экспериментальное подтверждение.
2. Последовательность событий в ходе ферментативного катализа
Процесс ферментативного катализа условно можно разделить на следующие этапы (рис. 2-12).
Рис. 2-12. Этапы ферментативного катализа. I - этап сближения и ориентации субстрата относительно активного центра фермента; II - образование фермент субстратного комплекса (ES) в результате индуцированного соответствия; III - деформация субстрата и образование нестабильного комплекса фермент-продукт (ЕР); IV - распад комплекса (ЕР) с высвобождением продуктов реакции из активного центра фермента и освобождением фермента.
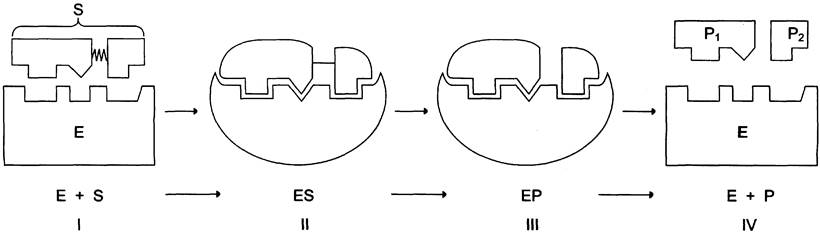
Первый, второй и четвёртый этапы катализа непродолжительны и зависят от концентрации субстрата (для первого этапа) и констант связывания лигандов в активном центре фермента (для первого и третьего этапов). Изменения энергетики химической реакции на этих стадиях незначительны.
Третий этап наиболее медленный; длительность его зависит от энергии активации химической реакции. На этой стадии происходят разрыв связей в молекуле субстрата, образование новых связей и формирование молекулы продукта.
3. Роль активного центра в ферментативном катализе
В результате исследований было показано, что молекула фермента, как правило, во много раз больше молекулы субстрата, подвергающегося химическому превращению этим ферментом. В контакт с субстратом вступает лишь небольшая часть молекулы фермента, обычно от 5 до 10 аминокислотных остатков, формирующих активный центр фермента. Роль остальных аминокислотных остатков состоит в обеспечении правильной конформации молекулы фермента для оптимального протекания химической реакции.
Активный центр на всех этапах ферментативного катализа нельзя рассматривать как пассивный участок для связывания субстрата. Это комплексная молекулярная «машина», использующая разнообразные химические механизмы, способствующие превращению субстрата в продукт.
В активном центре фермента субстраты располагаются таким образом, чтобы участвующие в реакции функциональные группы субстратов находились в непосредственной близости друг к другу. Это свойство активного центра называют эффектом сближения и ориентации реагентов. Такое упорядоченное расположение субстратов вызывает уменьшение энтропии и, как следствие, снижение энергии активации (Еа), что определяет каталитическую эффективность ферментов.
Активный центр фермента также способствует дестабилизации межатомных связей в молекуле субстрата, что облегчает протекание химической реакции и образование продуктов. Это свойство активного центра называют эффектом деформации субстрата (рис. 2-12).
В. Молекулярные механизмы ферментативного катализа
Механизмы ферментативного катализа определяются ролью функциональных групп активного центра фермента в химической реакции превращения субстрата в продукт. Выделяют 2 основных механизма ферментативного катализа: кислотно-основной катализ и ковалентный катализ.
1. Кислотно-основной катализ
Концепция кислотно-основного катализа объясняет ферментативную активность участием в химической реакции кислотных групп (доноры протонов) и/или основных групп (акцепторы протонов). Кислотно-основной катализ — часто встречающееся явление. Аминокислотные остатки, входящие в состав активного центра, имеют функциональные группы, проявляющие свойства как кислот, так и оснований.
К аминокислотам, участвующим в кислотноосновном катализе, в первую очередь относят Цис, Тир, Сер, Лиз, Глу, Асп и Гис. Радикалы этих аминокислот в протонированной форме — кислоты (доноры протона), в депротонированной — основания (акцепторы протона). Благодаря этому свойству функциональных групп активного центра ферменты становятся уникальными биологическими катализаторами, в отличие от небиологических катализаторов, способных проявлять либо кислотные, либо основные свойства.
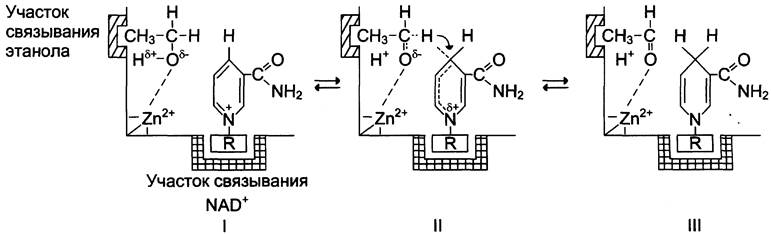
Примером кислотно-основного катализа, в котором кофакторами являются ионы Zn2+, а в качестве кофермента используется молекула NAD+, можно привести фермент алкогольдегидрогеназу печени, катализирующую реакцию окисления спирта (рис. 2-13):
С2Н5ОН + NAD+ —> СН3-СОН + NАDН + Н+.
Рис. 2-13. Механизм кислотно-основного катализа на примере алкогольдегидрогеназы печени. I - молекула этилового спирта имеет центр связывания, обеспечивающий гидрофобное взаимодействие активного центра и метильной группы спирта; II - положительно заряженный атом цинка способствует отщеплению протона от спиртовой группы этанола с образованием отрицательно заряженного атома кислорода. Отрицательный заряд перераспределяется между атомом кислорода и соседним атомом водорода, который затем в виде гидрит-иона переносится на четвёртый углеродный атом никотинамида кофермента NAD+; III - в результате формируется восстановленная форма NADH и уксусный альдегид.
2. Ковалентный катализ
Ковалентный катализ основан на атаке нуклеофильных (отрицательно заряженных) или электрофильных (положительно заряженных) групп активного центра фермента молекулами субстрата с формированием ковалентной связи между субстратом и коферментом или функциональной группой аминокислотного остатка (как правило, одной) активного центра фермента.
Действие сериновых протеаз, таких как трипсин, химотрипсин и тромбин, — пример механизма ковалентного катализа, когда ковалентная связь образуется между субстратом и аминокислотным остатком серина активного центра фермента. Термин «сериновые протеазы» связан с тем, что аминокислотный остаток серина входит в состав активного центра всех этих ферментов и участвует непосредственно в катализе. Рассмотрим механизм ковалентного катализа на примере химотрипсина, осуществляющего гидролиз пептидных связей при переваривании белков в двенадцатиперстной кишке (см. раздел 9). Субстратами химотрипсина служат пептиды, содержащие аминокислоты с ароматическими и циклическими гидрофобными радикалами (Фен, Тир, Три), что указывает на участие гидрофобных сил в формировании фермент-субстратного комплекса. Механизм ковалентного катализа химотрипсина рассмотрен на рис. 2-14.
Рис. 2-14. Механизм ковалентного катализа в активном центре химотрипсина.
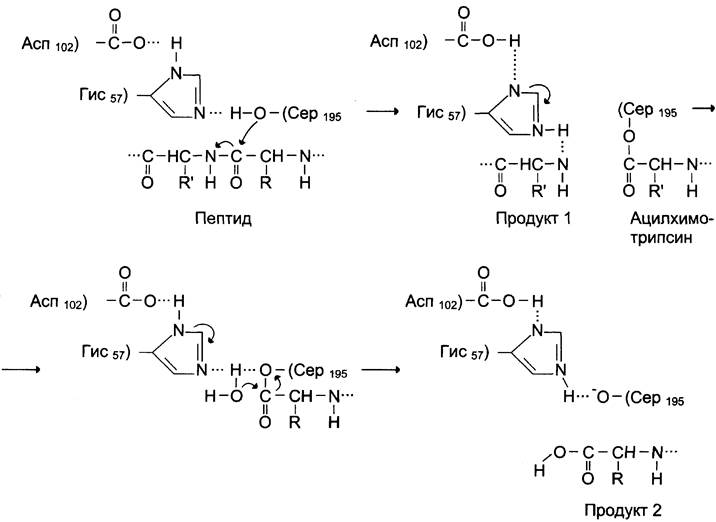
Радикалы Асп102, Гис57 и Сер195 участвуют непосредственно в акте катализа. Вследствие нуклеофильной атаки пептидной связи субстрата происходит разрыв этой связи с образованием ковалентно-модифицированного серина — ацил- химотрипсина. Другой пептидный фрагмент высвобождается в результате разрыва водородной связи между пептидным фрагментом и Гис57 активного центра химотрипсина. Заключительный этап гидролиза пептидной связи белков — деацилирование химотрипсина в присутствии молекулы воды с высвобождением второго фрагмента гидролизуемого белка и исходной формы фермента.