БИОХИМИЯ УЧЕБНИК ДЛЯ ВУЗОВ - Е. С. Северина - 2004
РАЗДЕЛ 2. ЭНЗИМОЛОГИЯ
VII. Регуляция метаболических процессов
Живая клетка — открытая система, постоянно обменивающаяся с внешней средой веществами и энергией, в неё поступают питательные вещества, которые подвергаются превращениям и используются в качестве строительного и энергетического материала, из клетки выводятся конечные продукты метаболизма. В многоклеточном организме клетка реагирует не только на изменение окружающей среды, но и на функциональную активность соседних клеток. При этом она стремится сохранить неизменным свой внутренний состав. Это состояние называют стационарным или клеточным гомеостазом.
В клетке постоянно происходит большое количество разнообразных химических реакций, которые формируют метаболические пути — последовательное превращение одних соединений в другие. Метаболизм — совокупность всех метаболических путей, протекающих в клетках организма.
Среди всех метаболических путей, протекающих в организме, выделяют противоположно направленные процессы: катаболизм и анаболизм. Катаболизм — распад сложных веществ до простых с высвобождением энергии. Анаболизм — синтез из простых более сложных веществ. Метаболические пути согласованы между собой по месту, времени и интенсивности протекания. Эта согласованность протекания всех процессов обеспечивается сложными и многообразными механизмами регуляции.
А. Организация химических реакций в метаболические пути
Оптимальная активность ферментов, катализирующих реакции одного метаболического пути, достигается благодаря определённой пространственной организации в клетке.
1. Пространственная локализация ферментов
Большинство ферментов имеет внутриклеточную локализацию и распределены в организме неравномерно. Все ферменты одного метаболического пути, как правило, находятся в одном отделе клетки. Особенно разделение метаболических путей важно для противоположно направленных катаболических и анаболических процессов. Например, синтез жирных кислот происходит в цитоплазме, а их распад в митохондриях. Если бы такого разделения не существовало, образовывались бы бесполезные с функциональной и энергетической точки зрения пути.
В метаболических путях продукт первой ферментативной реакции служит субстратом второй и так далее до формирования конечного продукта. Промежуточные продукты метаболического пути могут высвобождаться из последовательности реакций и использоваться в других метаболических путях, т. е. метаболические пути связаны между собой промежуточными продуктами.
В ряде случаев пространственная организация ферментов настолько сильно выражена, что продукт реакции ни при каких условиях не может быть вычленен из метаболического пути и обязательно служит субстратом следующей реакции. Такая организация метаболического пути носит название мультиферментного комплекса и возникает в результате структурно-функциональной организации ферментов. Обычно такие комплексы связаны с мембранами. В качестве примеров мультиферментных комплексов можно привести пируватдегидрогеназный комплекс, под действием которого происходит окислительное декарбоксилирование пировиноградной кислоты (пирувата) (см. раздел 6), синтазу жирных кислот, катализирующую синтез пальмитиновой кислоты (см. раздел 8).
2. Структура метаболических путей
Структура метаболических путей в клетке крайне разнообразна (см. табл. 2-3). В случае, когда субстрат в результате ряда ферментативных процессов превращается в один продукт, такой путь носит название линейного метаболического пути. Часто встречаются разветвлённые метаболические пути, приводящие к синтезу различных конечных продуктов в зависимости от потребности клетки. В процессе изучения курса биологической химии вы также познакомитесь с циклическими и спиральными метаболическими путями.
Таблица 2-3. Типы метаболичеких путей
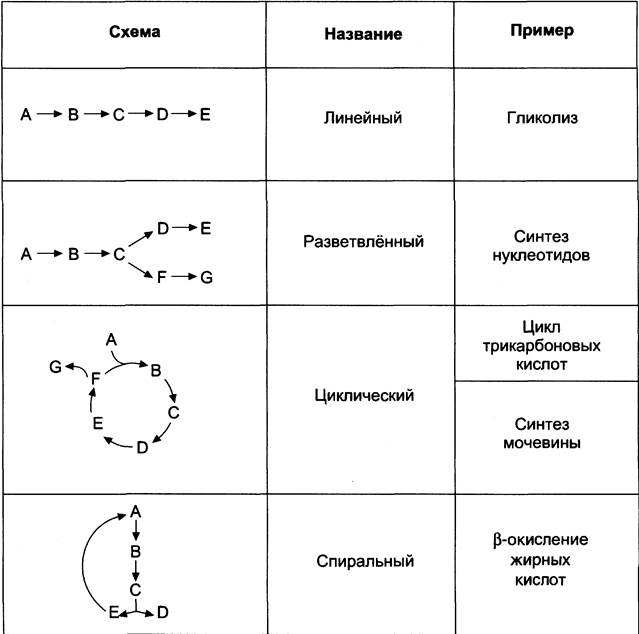
Органоспецифичность
Ферментный состав различных клеток неодинаков. Ферменты, выполняющие функцию жизнеобеспечения клетки, находятся во всех клетках организма. В процессе дифференцировки клеток происходит изменение ферментного состава клеток. Так, фермент аргиназа, участвующий в синтезе мочевины, находится только в клетках печени, а кислая фосфатаза, участвующая в гидролизе моноэфиров ортофосфорной кислоты, — в клетках простаты. Это так называемые органоспецифичные ферменты.
Если говорить об узко специализированных клетках, то ферментов, выполняющих функции в этих клетках, находится больше, чем в других клетках. Например, в клетках сердечной мышцы имеется повышенное количество ферментов креатинкиназы и аспартатаминотрансферазы, в клетках печени — аланинаминотрансферазы и аспартатаминотрансферазы, в остеобластах — щелочной фосфатазы и т. д.
Компартментализация
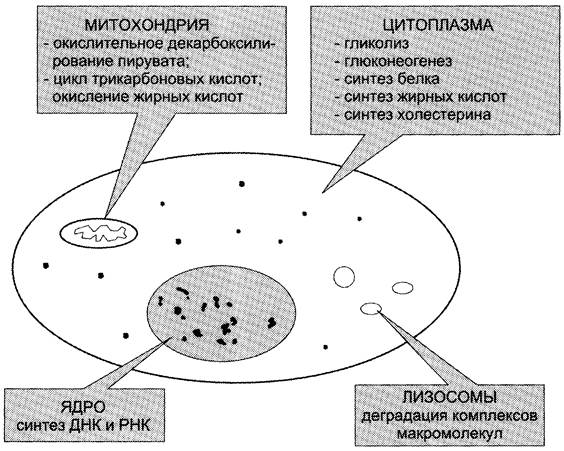
Клетка — сложнофункциональная система, регулирующая своё жизнеобеспечение. Многообразие функций клетки обеспечивается пространственной и временной (в первую очередь, в зависимости от ритма питания) регуляцией определённых метаболических путей. Пространственная регуляция связана со строгой локализацией определённых ферментов в различных органеллах. Так, в ядре находятся ферменты, связанные с синтезом молекул ДНК и РНК, в цитоплазме — ферменты гликолиза, в лизосомах — гидролитические ферменты, в матриксе митохондрий — ферменты ЦТК, во внутренней мембране митохондрий — ферменты цепи переноса электронов и т. д. (рис. 2-29). Такая субклеточная локализация ферментов способствует упорядоченности биохимических процессов и увеличивает скорость обмена веществ.
Рис. 2-29. Внутриклеточная локализация ферментов.
Б. Принципы регуляции метаболических путей
Все химические реакции в клетке протекают при участии ферментов. Поэтому, чтобы воздействовать на скорость протекания метаболического пути, достаточно регулировать количество или активность ферментов. Обычно в метаболических путях есть ключевые ферменты, благодаря которым происходит регуляция скорости всего пути. Эти ферменты (один или несколько в метаболическом пути) называются регуляторными ферментами; они катализируют, как правило, начальные реакции метаболического пути, необратимые реакции, скорость-лимитирующие реакции (самые медленные) или реакции в месте переключения метаболического пути (точки ветвления).
Регуляция скорости ферментативных реакций осуществляется на 3 независимых уровнях:
✵ изменением количества молекул фермента;
✵ доступностью молекул субстрата и кофермента;
✵ изменением каталитической активности молекулы фермента.
1. Регуляция количества молекул фермента в клетке
Известно, что белки в клетке постоянно обновляются. Количество молекул фермента в клетке определяется соотношением 2 процессов — синтеза и распада белковой молекулы фермента:
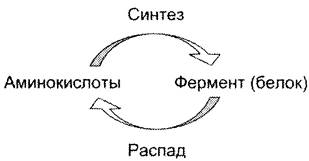
Синтез и фолдинг белка — многостадийный процесс. Регуляция синтеза белка может происходить на любой стадии формирования белковой молекулы. Наиболее изучен механизм регуляции синтеза белковой молекулы на уровне транскрипции, который осуществляется определёнными метаболитами, гормонами и рядом биологически активных молекул (см. раздел 4).
Что касается распада ферментов, то регуляция этого процесса менее изучена. Можно только предполагать, что это не просто процесс протеолиза (разрушения белковой молекулы), а сложный механизм, возможно, определяемый на генетическом уровне.
2. Регуляция скорости ферментативной реакции доступностью молекул субстрата и коферментов
Важный параметр, контролирующий протекание метаболического пути, — наличие субстратов, и главным образом — наличие первого субстрата. Чем больше концентрация исходного субстрата, тем выше скорость метаболического пути.
Другой параметр, лимитирующий протекание метаболического пути, — наличие регенерированных коферментов. Например, в реакциях дегидрирования коферментом дегидрогеназ служат окисленные формы NAD+, FAD, FMN, которые восстанавливаются в ходе реакции. Чтобы коферменты вновь участвовали в реакции, необходима их регенерация, т. е. превращение в окисленную форму.
3. Регуляция каталитической активности ферментов
Важнейшее значение в изменении скорости метаболических путей играет регуляция каталитической активности одного или нескольких ключевых ферментов данного метаболического пути. Это высокоэффективный и быстрый способ регуляции метаболизма.
Основные способы регуляции активности ферментов:
✵ аллостерическая регуляция;
✵ регуляция с помощью белок-белковых взаимодействий;
✵ регуляция путём фосфорилирования/дефос- форилирования молекулы фермента;
✵ регуляция частичным (ограниченным) протеолизом.
Аллостерическая регуляция
Аллостерическими ферментами называют ферменты, активность которых регулируется не только количеством молекул субстрата, но и другими веществами, называемыми эффекторами. Участвующие в аллостерической регуляции эффекторы — клеточные метаболиты часто именно того пути, регуляцию которого они осуществляют.
Роль аллостерических ферментов в метаболизме клетки. Аллостерические ферменты играют важную роль в метаболизме, так как они чрезвычайно быстро реагируют на малейшие изменения внутреннего состояния клетки. Аллостерическая регуляция имеет большое значение в следующих ситуациях:
✵ при анаболических процессах. Ингибирование конечным продуктом метаболического пути и активация начальными метаболитами позволяют осуществлять регуляцию синтеза этих соединений;
✵ при катаболических процессах. В случае накопления АТФ в клетке происходит ингибирование метаболических путей, обеспечивающих синтез энергии. Субстраты при этом расходуются на реакции запасания резервных питательных веществ;
✵ для координации анаболических и катаболических путей. АТФ и АДФ — аллостерические эффекторы, действующие как антагонисты;
✵ для координации параллельно протекающих и взаимосвязанных метаболических путей (например, синтез пуриновых и пиримидиновых нуклеотидов, используемых для синтеза нуклеиновых кислот). Таким образом, конечные продукты одного метаболического пути могут быть аллостерическими эффекторами другого метаболического пути.
Аллостерические эффекторы. Эффектор, вызывающий снижение (ингибирование) активности фермента, называют отрицательным эффектором, или ингибитором. Эффектор, вызывающий повышение (активацию) активности ферментов, называют положительным эффектором, или активатором.
Аллостерическими эффекторами часто служат различные метаболиты. Конечные продукты метаболического пути — часто ингибиторы аллостерических ферментов, а исходные вещества — активаторы. Это так называемая гетеротропная регуляция. Такой вид аллостерической регуляции очень распространён в биологических системах.
Более редкий случай аллостерической регуляции, когда сам субстрат может выступать в качестве положительного эффектора. Такая регуляция называется гомотропной (эффектор и субстрат — одно и то же вещество). Эти ферменты имеют несколько центров связывания для субстрата, которые могут выполнять двойную функцию: каталитическую и регуляторную. Аллостерические ферменты такого типа используются в ситуации, когда субстрат накапливается в избытке и должен быстро преобразоваться в продукт.
Выявить ферменты с аллостерической регуляцией можно, изучая кинетику этих ферментов. Эти ферменты не подчиняются законам Михаэлиса — Ментен, они имеют характерную S-образную кривую зависимости скорости реакции от концентрации субстрата.
Особенности строения и функционирования аллостерических ферментов:
✵ обычно это олигомерные белки, состоящие из нескольких протомеров или имеющие доменное строение;
✵ они имеют аллостерический центр, пространственно удалённый от каталитического активного центра;
✵ эффекторы присоединяются к ферменту нековалентно в аллостерических (регуляторных) центрах;
✵ аллостерические центры, так же, как и каталитические, могут проявлять различную специфичность по отношению к лигандам: она может быть абсолютной и групповой. Некоторые ферменты имеют несколько аллостерических центров, одни из которых специфичны к активаторам, другие — к ингибиторам.
✵ протомер, на котором находится аллостерический центр, — регуляторный протомер, в отличие от каталитического протомера, содержащего активный центр, в котором проходит химическая реакция;
✵ аллостерические ферменты обладают свойством кооперативности: взаимодействие аллостерического эффектора с аллостерическим центром вызывает последовательное кооперативное изменение конформации всех субъединиц, приводящее к изменению конформации активного центра и изменению сродства фермента к субстрату, что снижает или увеличивает каталитическую активность фермента (рис. 2-30);
Рис. 2-30. Схема, поясняющая работу аллостерического фермента. А — действие отрицательного эффектора (ингибитора); Б — действие положительного эффектора (активатора).
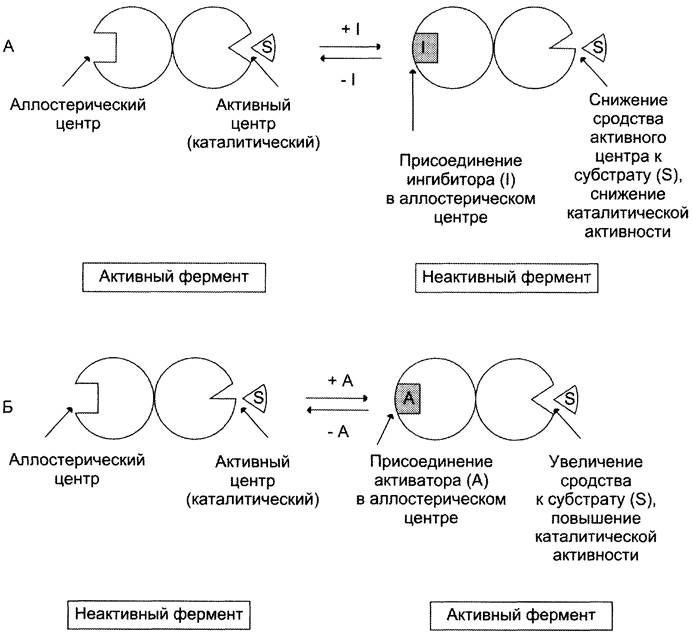
✵ регуляция аллостерических ферментов обратима: отсоединение эффектора от регуляторной субъединицы восстанавливает исходную каталитическую активность фермента;
✵ аллостерические ферменты катализируют ключевые реакции данного метаболического пути.
Локализация аллостерических ферментов в метаболическом пути. Скорость метаболических процессов зависит от концентрации веществ, использующихся и образующихся в данной цепи реакций. Такая регуляция представляется логичной, так как при накоплении конечного продукта он (конечный продукт) может действовать как аллостерический ингибитор фермента, катализирующего чаще всего начальный этап данного метаболического пути:
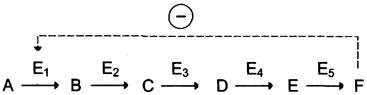
Фермент, катализирующий превращение субстрата А в продукт В, имеет аллостерический центр для отрицательного эффектора, которым служит конечный продукт метаболического пути F. Если концентрация F увеличивается (т. е. вещество F синтезируется быстрее, чем расходуется), ингибируется активность одного из начальных ферментов. Такую регуляцию называют отрицательной обратной связью, или ретроингибированием. Отрицательная обратная связь — часто встречающийся механизм регуляции метаболизма в клетке.
В центральных метаболических путях исходные вещества могут быть активаторами ключевых ферментов метаболического пути. Как правило, при этом аллостерической активации подвергаются ферменты, катализирующие ключевые реакции заключительных этапов метаболического пути:
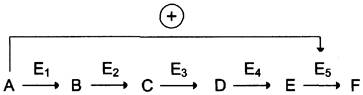
В качестве примера можно рассмотреть принципы регуляции гликолиза — специфического (начального) пути распада глюкозы (рис. 2-31). Один из конечных продуктов распада глюкозы — молекула АТФ. При избытке в клетке АТФ происходит ретроингибирование аллостерических ферментов фосфофруктокиназы и пируваткиназы. При образовании большого количества фруктозо-1,6-бисфосфата наблюдают аллостерическую активацию фермента пируваткиназы.
Рис. 2-31. Схема положительной и отрицательной регуляции катаболизма глюкозы. Молекула АТФ участвует в ретроингибировании аллостерических ферментов фосфофруктокиназы и пируваткиназы. Фруктозо-1,6-бисфосфат — активатор метаболического пути распада глюкозы. Плюсами отмечена активация, минусами — ингибирование ферментов.
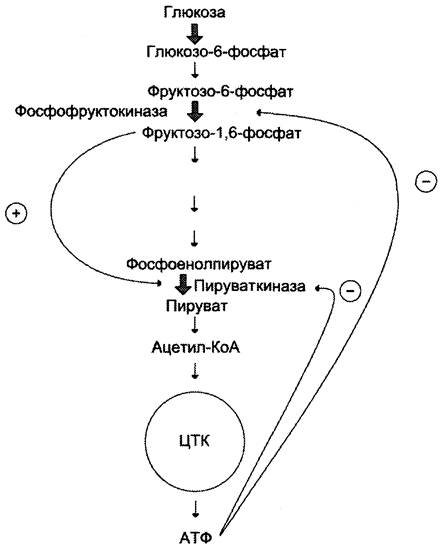
Благодаря такой регуляции осуществляется слаженность протекания метаболического пути распада глюкозы.
Регуляция каталитической активности ферментов белок-белковыми взаимодействиями. Некоторые ферменты изменяют свою каталитическую активность в результате белок-белковых взаимодействий. Рассмотрим 2 механизма активации ферментов с помощью белок-белковых взаимодействий:
✵ активация ферментов в результате присоединения регуляторных белков;
✵ изменение каталитической активности ферментов вследствие ассоциации или диссоциации протомеров фермента.
Активация ферментов в результате присоединения регуляторных белков. Этот тип регуляции можно рассмотреть на примере активации фермента аденилатциклазы, локализованной в плазматической мембране клетки.
Активный центр аденилатциклазы локализован на цитоплазматической стороне плазматической мембраны. Активированная аденилатциклаза катализирует реакцию образования из АТФ циклического 3',5'-АМФ (цАМФ) — вторичного, внутриклеточного посредника действия гормонов (см. схему ниже).
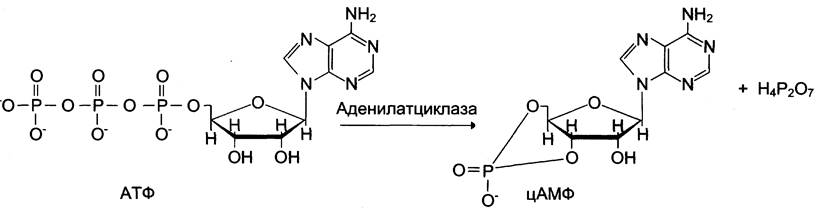
В мембране аденилатциклаза функционирует в комплексе с другими белками:
✵ рецептором гормона, выступающего во внеклеточную среду и взаимодействующего с гормонами;
✵ с G-белком, занимающим промежуточное положение между рецептором и ферментом аденилатциклазой. G-белок — олигомерный белок, состоящий из 3 субъединиц — α, β, y, α-Субъединица имеет центр связывания и расщепления ГТФ. Поэтому этот белок называется ГТФ-связывающим белком, или G-белком;
✵ в результате связывания гормона с рецептором происходит изменение конформации G-белка, уменьшение его сродства к молекуле ГДФ, с которой он связан в отсутствие гормонального сигнала, и увеличение сродства к ГТФ. Присоединение ГТФ вызывает конформационные изменения в G-белке и диссоциацию его на субъединицы: субъединицу α, связанную с ГТФ (α-ГТФ), димер βy;
✵ α-ГТФ имеет высокое сродство к аде- нилатциклазе, его присоединение приводит к активации последней, поэтому α-ГТФ — регуляторный белок, а данный
механизм активации аденилатциклазы называют активацией ферментов в результате присоединения регуляторных белков (рис. 2-32).
Рис. 2-32. Регуляция активности аденилатциклазы. Гормон (Г), взаимодействуя с рецептором (R) на поверхности клеток, приводит к уменьшению сродства ГТФ-связывающего белка (G-белка, состоящего из протомеров α, β, y) к ГТФ и увеличению сродства к ГТФ. Присоединение молекулы ГТФ к активному центру G-белка вызывает диссоциацию комплекса на субъединицы α-ГТФ и димер βy. Комплекс α-ГТФ активирует аденилатциклазу, что способствует синтезу из АТФ внутриклеточных регуляторных молекул цАМФ. АЦ — аденилатциклаза, ПКА — протеинкиназа А, Рi — Н3РO4.
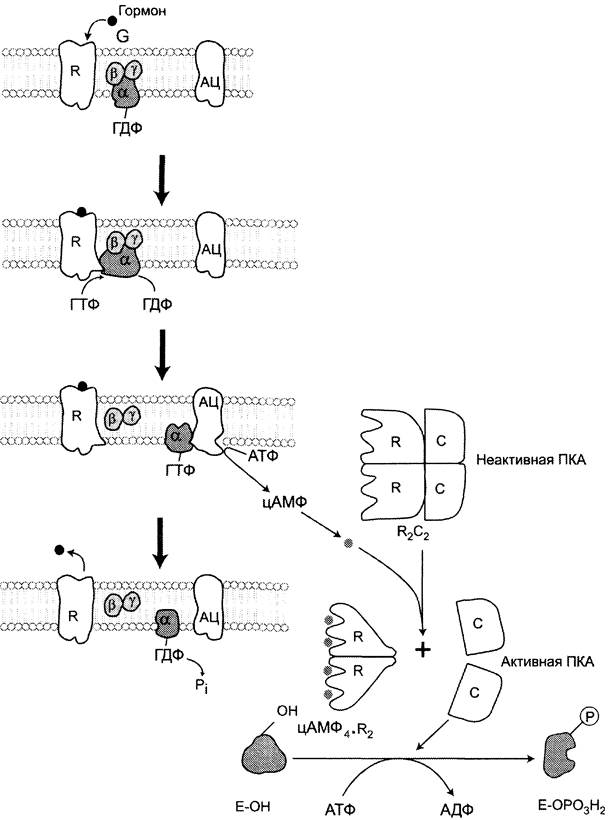
Регуляция каталитической активности ферментов ассоциацией/диссоциацией протомеров
Протеинкиназы — группа ферментов, катализирующих перенос остатка фосфорной кислоты с АТФ на специфические ОН-группы аминокислотных остатков белков (вызывают фосфорилирование белков). Механизмы активации различных протеинкиназ неодинаковы. В качестве примера регуляции каталитической активности ферментов ассоциацией или диссоциацией протомеров можно привести регуляцию активности фермента протеинкиназы А.
Протеинкиназа А (цАМФ-зависимая) состоит из 4 субъединиц 2 типов: 2 регуляторных (R) и 2 каталитических (С). Такой тетрамер не обладает каталитической активностью. Регуляторные субъединицы имеют участки связывания для циклического 3',5'-АМФ (цАМФ), по 2 на каждую субъединицу. Присоединение 4 молекул цАМФ к 2 регуляторным субъединицам приводит к изменению конформации регуляторных протомеров и к диссоциации тетрамерного комплекса, при этом высвобождаются 2 активные каталитические субъединицы (рис. 2-32). Такой механизм регуляции обратим. Отщепление молекул цАМФ от регуляторных субъединиц приведёт к ассоциации регуляторных и каталитических субъединиц протеинкиназы А с образованием неактивного комплекса.
Регуляция каталитической активности ферментов путём фосфорилирования/дефосфорилирования
В биологических системах часто встречается механизм регуляции активности ферментов с помощью ковалентной модификации аминокислотных остатков. Быстрый и широко распространённый способ химической модификации ферментов — фосфорилирова- ние/дефосфорилирование. Модификации подвергаются ОН-группы фермента. Фосфорилирование осуществляется ферментами протеинкиназами, а дефосфорилирование — фосфопротеинфосфатазами. Присоединение остатка фосфорной кислоты приводит к изменению конформации активного центра и его каталитической активности. При этом результат может быть двояким: одни ферменты при фосфорилировании активируются, другие, напротив, становятся менее активными (рис. 2-33).
Рис. 2-33. Регуляция активности ферментов фосфорилированием/дефосфорилированием.
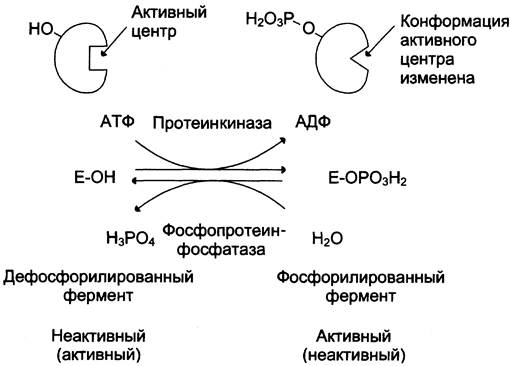
Изменение активности фермента, вызванное фосфорилированием, обратимо. Отщепление остатка фосфорной кислоты осуществляется ферментами фосфопротеинфосфатазами. Активность протеинкиназ и фосфопротеинфосфатаз регулируется гормонами, что позволяет быстро изменять активность ключевых ферментов метаболических путей в зависимости от условий внешней среды. Антагонистичные по функции гормоны противоположным образом влияют на фосфорилирование/дефосфорилирование ферментов, вызывая противоположные эффекты изменения метаболизма клетки.
Например, под действием глюкагона (в период между приёмами пищи) в клетках происходит уменьшение синтеза энергетического материала — жира, гликогена и усиление его распада (мобилизация), вызванного фосфорилированием ключевых ферментов этих процессов. А под действием инсулина (во время пищеварения), наоборот, активируется синтез гликогена и ингибируется его распад, так как взаимодействие инсулина с рецептором активирует сигнальный путь, приводящий к дефосфорилированию тех же ключевых ферментов.
Регуляция каталитической активности ферментов частичным (ограниченным) протеолизом
Некоторые ферменты, функционирующие вне клеток (в ЖКТ или в плазме крови), синтезируются в виде неактивных предшественников и активируются только в результате гидролиза одной или нескольких определённых пептидных связей, что приводит к отщеплению части белковой молекулы предшественника. В результате в оставшейся части белковой молекулы происходит конформационная перестройка и формируется активный центр фермента.
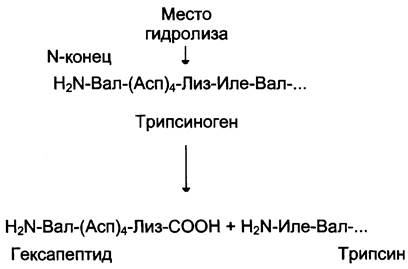
Рассмотрим механизм частичного протеолиза на примере активации протеолитического фермента трипсина (рис. 2-34). Трипсиноген, синтезируемый в поджелудочной железе, при пищеварении по протокам поджелудочной железы поступает в двенадцатиперстную кишку, где и активируется путём частичного протеолиза под действием фермента кишечника энтеропептидазы. В результате отщепления гексапептида с N- конца формируется активный центр в оставшейся части молекулы. Следует напомнить, что трипсин относят к семейству «сериновых» протеаз — активный центр фермента содержит функционально важный остаток Сер.
Рис. 2-34. Активация трипсина частичным протеолизом. Под действием фермента кишечника энтеропептидазы происходит гидролиз пептидной связи Лиз-Иле. В результате отщепления гексапептида с N-конца формируется активный центр в оставшейся части молекулы.
Частичный протеолиз — пример регуляции, когда активность фермента изменяется необратимо. Такие ферменты функционируют, как правило, в течение короткого времени, определяемого временем жизни белковой молекулы. Частичный протеолиз лежит в основе активации протеолитических ферментов, белков свёртывающей системы крови и фибринолиза, белков системы комплемента, а также пептидных гормонов.