БИОХИМИЯ УЧЕБНИК ДЛЯ ВУЗОВ - Е. С. Северина - 2004
РАЗДЕЛ 4. БИОСИНТЕЗ НУКЛЕИНОВЫХ КИСЛОТ И БЕЛКОВ (МАТРИЧНЫЕ БИОСИНТЕЗЫ). ОСНОВЫ МОЛЕКУЛЯРНОЙ ГЕНЕТИКИ
IX. Использование ДНК — технологий в медицине
В настоящее время стало очевидным, что достижения в области молекулярной биологии способны сильно изменить практическую медицину. Они не только углубили наши знания об экспрессии генов и причинах многих болезней, но способствовали разработке новых подходов к их диагностике и лечению.
Было установлено, что полиморфизм генов широко распространён в популяции людей, показана взаимосвязь между изменениями в структуре ДНК и многими болезнями. Идентификация генов, нарушение работы которых приводит к развитию наследственных заболеваний, создала предпосылки для подробного анализа генетических и биохимических основ патогенеза этих заболеваний и разработки наиболее эффективных методов лечения.
Методами молекулярной медицины были созданы вакцины для предотвращения гепатитов, инсулин человека — для лечения сахарного диабета, фактор VIII — для восстановления нормального свёртывания крови и лечения гемофилии и многие другие препараты.
С помощью генной терапии оказалось возможным вводить в организм больного полноценно работающие гены и таким образом восстанавливать метаболические нарушения, вызванные мутантными генами. Таким путём осуществляется лечение детей с иммунодефицитом, вызванным дефектом аденозиндезаминазы, в стадии клинических испытаний находятся методы генокоррекции таких наследственных болезней, как семейная гиперхолестеринемия, гемофилия В, муковисцидоз и некоторые другие.
Для выявления дефектов в структуре ДНК она должна быть выделена из соответствующего источника (биологической жидкости, биоптата, культуры клеток и т. д.) и «наработана» в количествах, достаточных для исследования. Для генно-терапевтических работ необходимы выделение нормальных генов и введение их в дефектные клетки таким образом, чтобы они экспрессировались, позволяя восстановить здоровье пациента.
В настоящем разделе будут даны основные представления о методах, используемых в решении проблем ДНК-диагностики наследственных болезней и генной терапии.
А. Методы выделения ДНК
ДНК может быть выделена из любого типа тканей и клеток, содержащих ядра. Этапы выделения ДНК включают быстрый лизис клеток, удаление фрагментов клеточных органелл и мембран с помощью центрифугирования, ферментативное разрушение белков протеиназами и экстрагирование ДНК из раствора с помощью фенола и хлороформа. Затем ДНК осаждают, как правило, этанолом и после удаления надосадочной жидкости растворяют в буферном растворе.
✵ Оценку качества экстрагированной ДНК проводят на основании измерения оптической плотности раствора ДНК в области белкового и нуклеинового спектров поглощения, т.е. при 280 и 260 нм, соответственно. Для чистых образцов ДНК соотношение оптических плотностей, полученных при 260/280 нм, должно быть больше 1,8.
✵ Молекула ДНК одной хромосомы среднего размера содержит 150 x 106 пар нуклеотидов и имеет длину около 4 см. Молекулы такого размера чувствительны к механическим воздействиям, возникающим в растворе в процессе выделения, и часто фрагментируются. В ходе выделения получают молекулы ДНК значительно меньше исходных, но всё равно очень большие — тысячи или десятки тысяч пар нуклеотидов. Такие молекулы неудобны для исследований, и их приходится дополнительно фрагментировать.
Расщепление ДНК с помощью рестриктаз
Для фрагментирования используют рестриктазы (ферменты, расщепляющие ДНК) или рестрикционные эндонуклеазы (от англ. restriction endonucleases), выделенные из бактериальных клеток. Эти ферменты in vivo участвуют в узнавании и разрушении чужеродных для бактерий ДНК, расщепляя внутренние участки молекулы на сравнительно небольшие фрагменты. Рестриктазы узнают специфические последовательности из 4 — 6, реже 8 — 12 нуклеотидов в двухцепочечной молекуле ДНК (сайты рестрикции) и «разрезают» её в местах локализации этих последовательностей. Количество образующихся рестрикционных фрагментов ДНК при использовании одной рестриктазы зависит от количества сайтов рестрикции, а размер фрагментов определяется положением этих сайтов по всей длине исходной молекулы ДНК.
Известно более 500 различных типов рестриктаз бактериального происхождения, причём каждый из этих ферментов узнаёт свою специфическую последовательность (рис. 4-62). С помощью набора рестриктаз можно разрезать молекулу ДНК на фрагменты желаемой длины. Например, для изучения первичной структуры (метод секвенирования) удобны фрагменты размером около 300 пар нуклеотидов. Следовательно, ДНК одной хромосомы в 150 x 106 пар нуклеотидов нужно разрезать на 500 000 фрагментов и каждый из фрагментов изучать отдельно.
Рис. 4-62. Последовательность нуклеотидов в ДНК, узнаваемая тремя наиболее часто используемыми рестриктазами. Рестрикцирующие нуклеазы получают из различных бактерий: HPA I — Haemophilus parainfluenzae; Eco RI — из Escherichia coir, Hind III — из Haemophilus influenzae. Рестриктазы типа 1 расщепляют ДНК с образованием «слепых» концов, а другие (типа 2) с образованием по месту разрыва одноцепочечных «липких» концов.
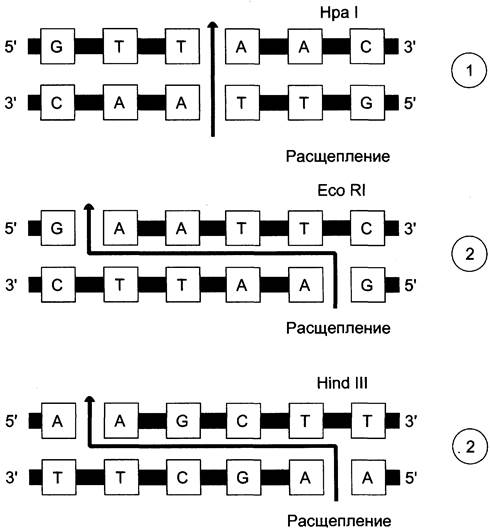
Образующиеся в результате рестрикции фрагменты ДНК могут быть исследованы методом электрофореза в агарозном или полиакриламидном геле. Выявление ДНК в геле возможно в присутствии бромида этидия, связывающегося с фрагментами молекулы и дающего специфическое розовое окрашивание в ультрафиолетовой области спектра.
Б. Идентификация специфических последовательностей
При обработке геномной эукариотической ДНК, в частности, ДНК человека, рестриктазами образуется так много фрагментов различной длины, что их не удаётся удовлетворительно разделить с помощью электрофореза в полиакриламидном или агарозном геле. После электрофореза рестрикцированной геномной ДНК и проявления с помощью бромида этидия получается равномерное окрашивание по всей длине геля. Идентификация нужных фрагментов ДНК в таком геле возможна только путём гибридизации с мечеными ДНК-зондами. Синтез ДНК-зондов осуществляется в автоматизированных машинах, позволяющих синтезировать фрагменты однонитевой ДНК длиной свыше 100 нуклеотидных звеньев со строго определённой первичной структурой. Такие молекулы можно
использовать для специфического связывания с исследуемыми участками гена.
Блот-гибридизация по Саузерну
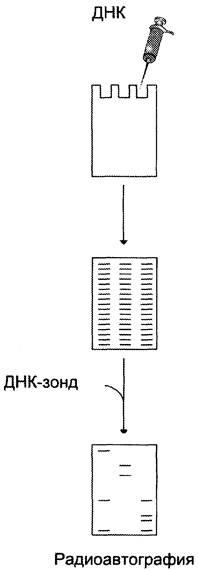
Классическим методом идентификации интересующих участков ДНК стал метод блот-гибридизации по Саузерну, предложенный в 1975 г. Суть метода заключается в том, что сплошная «лестница» фрагментов ДНК, получившаяся в результате их деления по молекулярной массе в гелях, подвергается денатурации и переносится с геля на плотный носитель (нитроцеллюлозный фильтр или нейлоновую мембрану). Перенос, или блоттинг, осуществляется за счёт капиллярных сил, электрического поля или вакуума (рис. 4-63). Фиксированную на фильтре ДНК гибридизуют с ДНК- или РНК-зондом, содержащим метку. Методом радиоавтографии определяют положение искомого фрагмента геномной ДНК на электрофореграмме. Блот-гибридизация — высокочувствительный метод идентификации специфических последовательностей.
Рис. 4-63. Блот-гибридизация по Саузерну. Фрагменты ДНК разделяют с помощью электрофореза, денатурируют, переносят на нитроцеллюлозный фильтр и гибридизуют с ДНК- зондом.
К настоящему времени разработано много модификаций этого метода. Так, ДНК-зонд не всегда метят радиоактивными изотопами, нередко используют соединения, ковалентно связывающиеся с ДНК; их можно обнаружить по образованию окрашенного продукта или флюоресценции. Длина олигонуклеотидов в ДНК-зондах также может сильно варьировать, будучи иногда очень короткой — в 15 — 20 пар нуклеотидов. Описаны методы дот- (пятно) или слот- (полоска) гибридизации, когда на твёрдый носитель наносят препараты ДНК или РНК без предварительной рестрикции или электрофореза и гибридизуют их с мечеными ДНК-зондами.
В. Установление первичной структуры ДНК- ферментов (секвенирование ДНК)
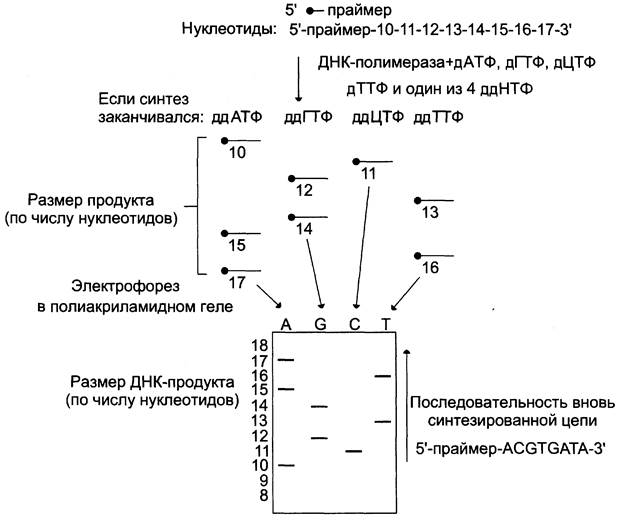
Наиболее часто для установления первичной структуры ДНК используют дидезоксисеквенирование. В реакционных пробах, содержащих денатурированную однонитевую ДНК, ДНК- полимеразу, дезоксинуклеозидтрифосфаты (дНТФ) — дАТФ, дЦТФ, дГТФ и дТТФ, один из которых является радиоактивным, и праймер инициируют синтез ДНК в присутствии специфических дидезоксинуклеозидтрифосфатов (ддНТФ), или терминаторов, — ддАТФ, ддЦТФ, ддГТФ или ддТТФ. Синтез одновременно ведут в четырёх параллельных пробах, в каждую из которых наряду с компонентами реакционной смеси прибавляют один из 4 ддНТФ. дцНТФ будут конкурировать с нормальными дНТФ за включение в растущую полинуклеотидную цепь. При встраивании ддНТФ вместо соответствующего нуклеотида синтез ДНК прекращается. В результате в каждой из пробирок получается набор различающихся по длине меченых фрагментов ДНК с одним из специфических ди- дезоксинуклеотидов на конце. После одновременного разделения этих фрагментов в электрическом поле на 4 соседних дорожках и радиоавтографии размер синтезированных молекул может быть установлен, а это значит, что может быть определена локализация терминирующих дидезоксинуклеотидов. На основании
этих данных устанавливают последовательность нуклеотидов во вновь синтезированных фрагментах, комплементарных ДНК-матрице (рис. 4-64).
Рис. 4-64. Дидезоксисеквенирование последовательности ДНК. Используют 4 пробы, каждая из которых содержит ДНК- матрицу, праймер, ДНК-полимеразу, 4 дНТФ (дАТФ, дГТФ, дЦТФ, дТТФ). Праймер либо один из нуклеотидов содержит радиоактивную метку, благодаря чему полосы могут быть обнаружены в геле с помощью радиоавтографии. Один из 4 дидезоксирибонуклеотидов (ддНТФ) добавляют в каждую пробирку. Остановка синтеза происходит в том случае, когда ддНТФ включается в растущую олигонуклеотидную цепь.
В настоящее время создают приборы для автоматического одновременного секвенирования большого числа проб с использованием меченных разными флюорохромами дидезоксинуклеотидов.
В то же время разрабатывают новые, более эффективные и экономичные методы секвенирования. Сущность одного из них заключается в следующем: из 4 нуклеозидтрифосфатов (дАТФ, дГТФ, дТТФ, дЦТФ) создаётся набор олигонуклеотидов (например, октануклеотидов), включающий все возможные варианты последовательностей. Эти октануклеотиды иммобилизуют (пришивают) в ячейках, в результате чего создаётся так называемая олигонуклеотидная матрица. Секвенируемый фрагмент ДНК метят по фосфатному остатку и добавляют в ячейки матрицы. Фрагмент ДНК гибридизуется только с теми октануклеотидами, последовательности которых комплементарны его участкам. Таким образом, определяется набор всех возможных октануклеотидов, присутствующих в исследуемом фрагменте ДНК. Далее при помощи специальной компьютерной обработки упорядочивается расположение октамеров в исследуемом фрагменте ДНК.
Г. Получение рекомбинантных ДНК и их амплификация
Для работы с нуклеотидными последовательностями в генах и других участках ДНК необходимо иметь достаточное количество материала для исследования. Это непростая задача, особенно если источником ДНК служат ткани человека. Поэтому исследуемые фрагменты ДНК обычно предварительно амплифицируют (увеличивают количественно в миллионы раз), для того чтобы получать их в любое время и в неограниченном количестве. Исключительно ценным инструментом в решении этой проблемы оказалось использование рекомбинантных ДНК (т. е. ДНК, построенных из участков разного происхождения).
1. Получение рекомбинантных ДНК
Для получения таких молекул первоначально выделяют ДНК из 2 разных источников (рис. 4-65).
Рис. 4-65. Получение рекомбинантных ДНК. Два образца ДНК: ДНКХ и ДНКY расщепляют одной и той же рестриктазой и получают фрагменты с «липкими» концами. При денатурации и последующем «отжиге» образуются рекомбинантные молекулы ДНКА и ДНКБ, первоначально соединённые друг с другом за счёт «липких» концов, затем сшиваемых ДНК-лигазой.
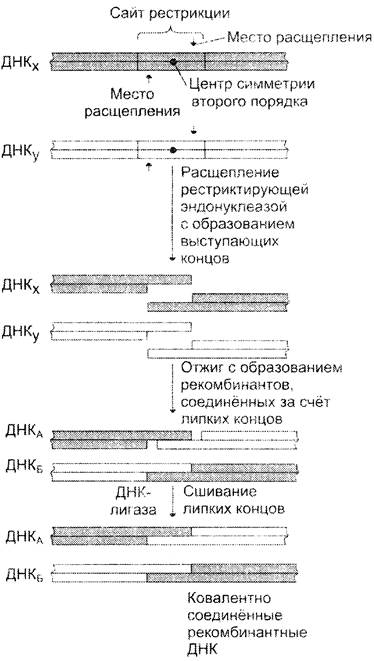
Каждую из них в отдельности фрагментируют, используя одну и ту же рестриктазу, расщепляющую ДНК с образованием «липких» концов. После процедуры нагревания и медленного охлаждения (отжига) наряду с исходными молекулами ДНКХ и ДНКY могут образовываться рекомбинантные молекулы, состоящие из фрагментов ДНКХ и ДНКYсвязанных между собой «липкими» копнами. Ковалентное сшивание фрагментов осуществляют с помощью ДНК-лигазы в присутствии АТФ как источника энергии.
В технологии рекомбинантных ДНК, кроме фрагментов ДНК, выделенных из клеток, содержащих ядра, используют ДНК, полученную с помощью обратной транскриптазы. При добавлении в реакционную среду 4 разных дезоксирибонуклеозидтрифосфатов фермент на матрице мРНК по принципу комплементарности синтезирует ДНК-копию, или кДНК. Так как источником информации при образовании кДНК служит зрелая цитоплазматическая мРНК, то такая ДНК, в отличие от ДНК фрагментов, полученных при расщеплении геномной ДНК эукариотов, не содержит интронов.
2. Клонирование ДНК
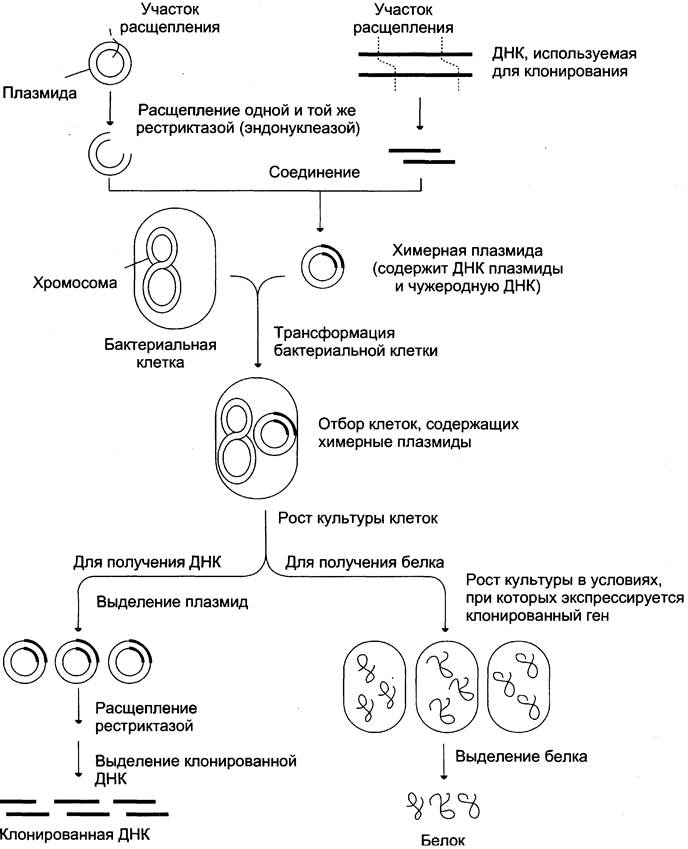
Для получения значительных количеств интересующего нас материала проводят клонирование ДНК, предполагающее встраивание нужного нам фрагмента ДНК в векторную молекулу ДНК (или вектор). Вектор обеспечивает проникновение этой рекомбинантной, или химерной, ДНК в бактериальные клетки. В качестве векторов используют плазмиды, фаги, ретро- и аденовирусы. Особенно часто в качестве вектора служит плазмидная ДНК.
Плазмиды — небольшие кольцевые двух цепочечные молекулы ДНК, присутствующие в бактериальных клетках в различном количестве копий. Они имеют автономную систему контроля репликации, которая поддерживает их количество в клетках на определённом уровне — от нескольких единиц до нескольких сотен копий геномов на клетку.
Используемую для клонирования плазмидную ДНК и интересующую нас ДНК расщепляют по определённому участку рестриктазой, получают рекомбинантную ДНК, возвращают гибридную плазмиду в кольцевую форму и вводят в бактериальные клетки, т. е. осуществляют трансформацию бактерий. При размножении трансформированных бактерий происходит увеличение числа копий введённого в плазмиду фрагмента ДНК, т. е. таким способом чужеродный для бактерий генетический материал может быть получен в значительных количествах (рис. 4-66).
Рис. 4-66. Схема клонирования ДНК в бактериальных клетках.
В качестве клонирующих векторов часто используют фаги. Если экзогенную ДНК вводят в эукариотические клетки, то эту процедуру называют трансдукцией.
3. Полимеразная цепная реакция
Метод полимеразной цепной реакции (ПЦР), предложенный в 1983 г. Карри Муллисом (Нобелевская премия. 1993 г.), явился эпохальным открытием XX века в области молекулярной биологии. Он позволяет подвергать специфичной амплификации в условиях in vitro (в пробирке) участки ДНК длиной от нескольких десятков до нескольких сотен пар нуклеотидов, используя в качестве матрицы любые образцы ДНК. Необходимое условие для проведения ПЦР — знание нуклеотидной последовательности амплифицируемой области. Участок исследуемой ДНК гибридизуют с двумя искусственно синтезированными праймерами — олигодезоксирибонуклеотидными последовательностями длиной от 15 до 30 пар нуклеотидов, которые комплементарны 3'-концам амплифицируемого участка на ко-
дарующей и некодирующей нитях ДНК. Расстояние между праймерами определяет длину синтезируемых молекул. В качестве матрицы для синтеза продуктов ПЦР используют любой тип ДНК: геномную ДНК человека, различных видов про- и эукариотов, ДНК, выделенную из культур клеток, «библиотек» генов и других источников. Метод не требует больших количеств исследуемой ДНК, в принципе, достаточно даже одной молекулы, содержащейся в одном волосе на голове, одной капле крови или спермы.
Успех в разработке метода в значительной степени обусловлен использованием в качестве фермента термофильной ДНК-полимеразы, выделенной из бактерий, живущих в горячих источниках, и потому устойчивой к действию высоких температур.
Реакционная смесь для получения интересующей нас ДНК содержит исследуемую ДНК, субстраты реакции — 4 дНТФ, 2 праймера, термостабильную, или Таq-полимеразу и буфер, содержащий ионы Mg2+.
Один цикл полимеризации включает 3 этапа (рис. 4-67): плавление: на этой стадии реакционную смесь нагревают до температуры 90 — 97 °С. Исследуемая двуцепочечная ДНК денатурирует и переходит в однонитевую форму; гибридизация или отжиг ДНК с праймерами. В результате снижения температуры до 50-60 °С происходит комплементарное связывание праймеров с цепями матричной ДНК и образование двухцепочечного участка на каждой из нитей ДНК; элонгация, удлинение нитей ДНК, комплементарных матричной ДНК, катализирует Таq- полимераза в направлении от 5'- к 3'-концу.
Рис. 4-67. Полимеразная цепная реакция.

Затем снова наступает этап плавления, когда за счёт повышения температуры синтез ДНК прекращается, и двунитевой участок между матричными и вновь синтезированными молекулами ДНК денатурирует. Во втором и последующих циклах праймеры гибридизируются с исходной матричной ДНК и с вновь синтезированными молекулами ДНК, количество которых нарастает в геометрической прогрессии. В последнем случае синтез ДНК заканчивается не из-за изменения температурного режима, а по достижении ДНК- полимеразой границы амплифицированного участка, что определяет строго определённый размер продукта с точностью до одного нуклеотида.
Каждый из этапов цикла имеет продолжительность от десятков секунд до 1 — 3 мин, в результате полный цикл длится от одной до нескольких минут.
Описанную процедуру амплификации ДНК проводят в автоматическом режиме в приборе — циклизаторе, или термоциклере, амплификаторе ДНК. Такой прибор позволяет задавать нужное количество циклов и выбирать оптимальные временные и температурные параметры. За 25 — 30 циклов число синтезированных копий ДНК достигает нескольких миллионов.
С помощью ПЦР можно получить достаточное количество копий участков ДНК, в которых предполагаются присутствие мутаций, полиморфизм сайтов, можно проводить ДНК-диагностику инфицированности пациентов вирусными, бактериальными и грибковыми возбудителями болезней.
Д. ДНК — диагностика заболеваний
Используя технику рекомбинантных ДНК, удаётся исследовать варианты генов, ответственных за развитие многих заболеваний. Этим способом идентифицированы точечные мутации, вызванные заменой одного азотистого основания, делециями или вставками, приводящими к появлению аллелей, кодирующих функционально неактивные белки. Дефектные «полиморфы» возникают как за счёт изменений в кодирующих участках гена, так и в результате мутаций в некодирующих областях, тесно примыкающих к генам и вызывающих нарушение их работы.
Разработанные технологии позволяют вести целенаправленное картирование генов человека в рамках международного проекта «Геном человека». Официально эта научная программа с участием ведущих молекулярно-генетических лабораторий США, стран Западной Европы, а также России и Японии оформилась в 1990 г. В ходе работы над проектом картированы 923 гена, вызывающих развитие моногенных заболеваний, более 100 из них полностью секвенированы. К концу 2001 г. работами лабораторий США, Великобритании, Японии и ряда европейских стран с точностью до 90% завершена расшифровка генома. Ожидается, что в течение ближайших 2 — 3 лет будут изучены все гены, ответственные за развитие патологических процессов у человека. Это позволит вывести диагностику и лечение многих болезней на новый уровень.
Остановимся на некоторых методах, широко используемых для идентификации моногенных болезней.
1. Полиморфизм длины рестрикционных фрагментов (ПДРФ)
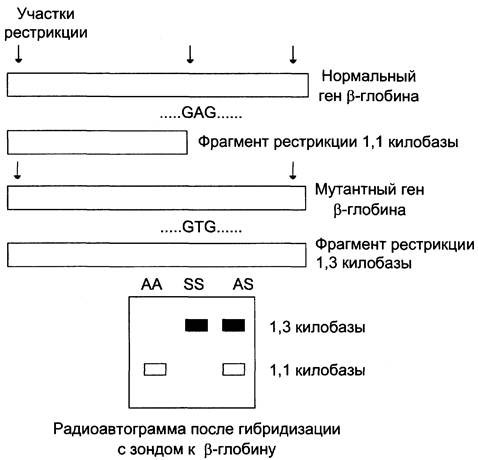
Мутации, возникающие в участках узнавания определённых рестриктаз, делают эти участки ДНК нечувствительными к действию ферментов. Это может быть легко обнаружено по изменению длины рестрикционных фрагментов ДНК. ПДРФ-анализ включает следующие этапы: выделение геномной ДНК, её рестрикцию специфической эндонуклеазой, электрофоретическое разделение образующихся фрагментов ДНК и идентификацию этих фрагментов путём блот-гибридизации по Саузерну. На электрофореграммах при отсутствии рестрикции в исследуемой ДНК выявляют один крупный фрагмент, соответствующий по длине последовательности ДНК между двумя соседними участками рестрикции для той же эндонуклеазы. При наличии рестрикции в полиморфном участке на электрофореграмме будет присутствовать меньший по размерам фрагмент, равный расстоянию между полиморфным участком рестрикции и одним из ближайших постоянных участков рестрикции (рис. 4-68).
Рис. 4-68. Рестрикционный анализ ДНК гемоглобина человека, больного серповидно-клеточной анемией (HbS). Миссенс-мутация, ответственная за возникновение серповидно-клеточной анемии, связана с заменой в гене β-цепи глобина триплета GAG на GTG. При этом утрачивается участок рестрикции фермента Mstll, узнающего последовательность CCTNAGG, где N может быть любым основанием. При наличии мутации генный зонд гибридизуется с более крупным фрагментом ДНК размером 1,3 килобазы, имеющим при электрофорезе меньшую подвижность, чем продукт рестрикции нормального гена, длина которого равна 1,1 килобазы.
ПДРФ-анализ может быть значительно упрощён в том случае, если возможна специфическая амплификация участка ДНК, содержащего полиморфный сайт рестрикции. Тестирование состояния этого локуса возможно путём проведения ПЦР и рестрикции амплифицированного фрагмента. При отсутствии сайта узнавания в исследуемой области ДНК размеры амплифицированного фрагмента не изменятся после его обработки рестриктазой. Если участок узнавания не изменён, обработка ферментом приведёт к образованию 2 маленьких фрагментов с той же суммарной длиной, что и исходный фрагмент.
При обследовании пациентов и членов их семей на носительство патологических генов широко используют этот метод, с помощью которого:
✵ идентифицируют делеции в гене дистрофи- на, на долю которых приходится около 60% всех мутаций, вызывающих миодистрофию Дюшенна;
✵ диагностируют гемофилию А, некоторые талассемии, ретинобластому и гранулематоз;
✵ контролируют здоровье детей в семьях, в которых родители являются гетерозиготами по гену серповидно-клеточной анемии и другим дефектным генам.
2. Определение мутаций с помощью аллель-специфических проб
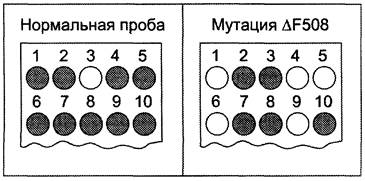
Многие мутации, вызывающие возникновение генных болезней, не попадают в участки, ответственные за узнавание ферментов рестрикции. В этом случае, если последовательность оснований в области мутации известна, то её обнаруживают с помощью аллель-специфических олигонуклеотидов. Для этого синтезируют короткие олигонуклеотидные зонды, содержащие обычно около 19 нуклеотидов, комплементарные участку нормального и мутантного аллеля в ДНК. Область генома, содержащую исследуемый ген, амплифицируют с помощью ПЦР, и образцы полученной ДНК переносят на нитроцеллюлозные фильтры (дот- или слот- блоттинг). Пробы выдерживают с 32Р-зондами для выявления нормальной или мутантной последовательности. У гомозигот по исследуемой мутации ДНК будет гибридизоваться только с зондом, комплементарным мутантной последовательности. ДНК нормального гомозиготного индивидуума свяжется с зондом, соответствующим неизменённой нуклеотидной последовательности, тогда как с ДНК гетерозигот будут гибридизоваться оба зонда. На рисунке 4-69 представлены результаты генного зондирования 7 пациентов на носительство наиболее часто встречающейся делеции 3 нуклеотидов (∆Е508) в гене, ответственном за развитие муковисцидоза.
Рис. 4-69. Генное зондирование на носительство муковисцидоза. С помощью ПЦР амплифицируют геномную ДНК, и продукт переносят на 2 нейлоновых фильтра, один из которых гибридизуют с 32Р-зондом на нормальный аллель, а второй с 32Р-зондом на мутантный аллель ∆F508. Образование гибридов обнаруживают радиоавтографически. Пробы 1-3 служили контролями: первая содержала продукты ПЦР ДНК от гомозигот по нормальному гену; вторая — от гетерозиготного носителя мутации ∆F508; третья — от больного муковисцидозом, гомозиготного по мутации ∆F508. Пробы 4-10 получены при обследовании 7 пациентов на носительство ∆F508: 4, 5, 6 и 9 оказались гомозиготами по нормальному гену, а 7, 8 и 10 — гетерозиготными носителями мутантного гена.
Олигонуклеотиды, аллель-специфичные по определённым мутациям, можно использовать в качестве праймеров в ПЦР при клиническом тестировании населения на наличие патологического гена. Если ДНК, полученная от пациента, амплифицирует с мутантным олигонуклеотидом, то, следовательно, пациент является носителем мутации. Если нуклеотидная последовательность в исследуемом гене не изменена, то олигонуклеотид, содержащий мутацию, не свяжется с ДНК-матрицей, и ПЦР не пойдёт.
Е. Использование ДНК- технологий для получения лекарственных препаратов и лечения различных болезней
Вакцины — очищенные белки, антигенные детерминанты ряда возбудителей вирусных и бактериальных инфекций. В последнее время их получают, пользуясь техникой рекомбинантных ДНК. Первой вакциной, синтезированной этим способом, была вакцина против вируса гепатита В.
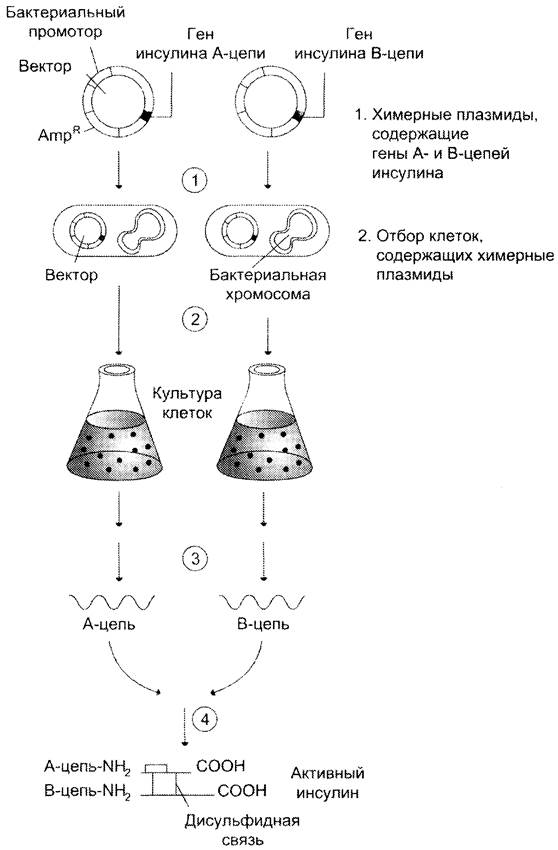
Белки, имеющие терапевтическое значение, получают с использованием этой технологии во многих странах мира. Так, одним из первых синтезирован инсулин человека (рис. 4-70). В клетках Е. coli, трансформированных плазмидами, содержащими ДНК, которая кодировала А- и В-цепи инсулина, нарабатывают белковые продукты А- и В-цепей. После очистки их подвергают фолдингу и окислению, которое обеспечивает образование соответствующих дисульфидных мостиков.
Рис. 4-70. Получение инсулина человека в клетках Е. соli. 1 — трансформация клеток Е. coli плазмидами, которые содержат гены, кодирующие структуру А- и В-цепей инсулина; 2 — синтез А- и В-цепей инсулина в процессе выращивания культуры трансформированных клеток Е. coli; 3 — выделение и очистка А- и В-цепей инсулина; 4 — пространственная укладка А- и В- цепей инсулина и окисление остатков цистеина.
Аналогичным способом получен гормон роста, используемый для лечения детей с недостаточностью этого гормона. Более сложные белки получены в культуре клеток млекопитающих. Так, дефекты в гене фактора VIII, кодирующего один из белков — участников свёртывающей системы крови, ответственны за возникновение гемофилии. До того, как фактор VIII был получен методами генной инженерии, большое количество больных погибало от СПИДа или гепатита, которыми они заражались в результате введения выделенного из крови фактора VIII или переливания крови от доноров, являвшихся носителями этих болезней.
Тканевый активатор плазминогена (ТАП) — протеаза, участвующая в процессе фибринолиза и предотвращающая образование тромбов в кровеносном русле; получена с помощью рекомбинантных ДНК. ТАП назначают больным с ишемической болезнью сердца для ускорения растворения тромбов, которые могут вызвать закупорку коронарных артерий и нарушить поступление кислорода в миокард.
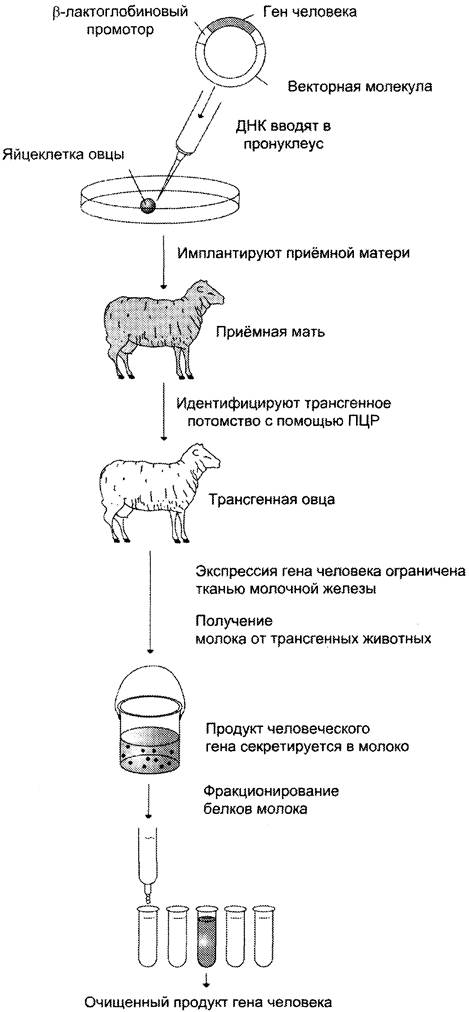
Осуществлено получение рекомбинантных факторов роста, обеспечивающих восстановление гемостаза: эритропоэтина, интерлейкинов, колоний-стимулирующих факторов. Эти препараты используют в лечении больных анемией, после трансплантации костного мозга или химиотерапии, чтобы стимулировать образование клеток крови и снизить риск иммунодефицита. Разработаны методы получения белков человека с использованием трансгенных животных; эти белки получают в результате искусственного введения чужеродного гена в оплодотворённую яйцеклетку или в ранние зародыши млекопитающих (рис. 4-71). Генноинженерные мероприятия можно провести таким образом, чтобы интересующий нас белок человека секретировался с белками молока.
Рис. 4-71. Использование трансгенных животных для получения белков человека. Ген человека встраивают в вектор таким образом, чтобы он был под контролем β-лактоглобинового промотора, который активен только в клетках молочной железы. Присутствие у трансгенного потомства гена человека контролировали с помощью метода ПЦР, в которой использовали праймеры к гену человека. При фракционировании белков молока получают белковый продукт экспрессии гена человека.
Генная терапия — лечение наследственных, многофакторных и инфекционных заболеваний путём введения в соматические клетки пациентов генов, которые обеспечивают исправление генных дефектов или придают клеткам новые функции.
Первый клинический опыт применения генной терапии был осуществлён в 1990 г. в Бетесде (США) на четырёхлетней девочке, страдавшей наследственным иммунодефицитом, вызванным мутацией в гене аденозиндезаминазы (ADA). Ребёнку были введены её собственные лимфоциты, предварительно трансформированные вне организма генной конструкцией, включающей ген ADA + ген neo + ретровирусный вектор. Лечебный эффект наблюдался в течение нескольких месяцев, после чего процедуру введения гена повторяли многократно без видимых неблагоприятных эффектов.
Для успешной генотерапии необходимо:
✵ обеспечить эффективную доставку чужеродного гена в клетки-мишени;
✵ создать условия для длительной экспрессии гена в этих клетках.
К настоящему времени разработаны химические, физические и биологические методы доставки чужеродного гена в клетки-мишени. Однако пока только вирусные векторы или генетические конструкции, включающие вирусные последовательности, способны к эффективной доставке необходимого гена и его последующей длительной экспрессии. В результате из более чем 175 уже одобренных протоколов клинических испытаний по генотерапии более 120 основаны на применении ретровирусных векторов.
В геном пациента чужеродная ДНК может вводиться либо в культуре клеток (ex vivo), либо непосредственно в организм больного (in vivo). При осуществлении первого способа выделяют и культивируют специфический тип клеток пациента, вводят в него чужеродный ген, отбирают трансформированные клетки и реинфузируют их тому же больному (рис. 4-72).
Рис. 4-72. Введение чужеродного гена ex vivo (А) и in vivo (Б). А. Введение чужеродного «лечебного» гена в организм больного в составе клеток, содержащих этот ген. Б. Введение «лечебного» гена в составе конструкции, содержащей: ДНК, включающую этот ген; белок (например, асиалогликопротеин), взаимодействующий с соответствующим рецептором на мембране клеток; вирусный вектор (аденовирус), обеспечивающий длительную экспрессию «лечебного» гена.
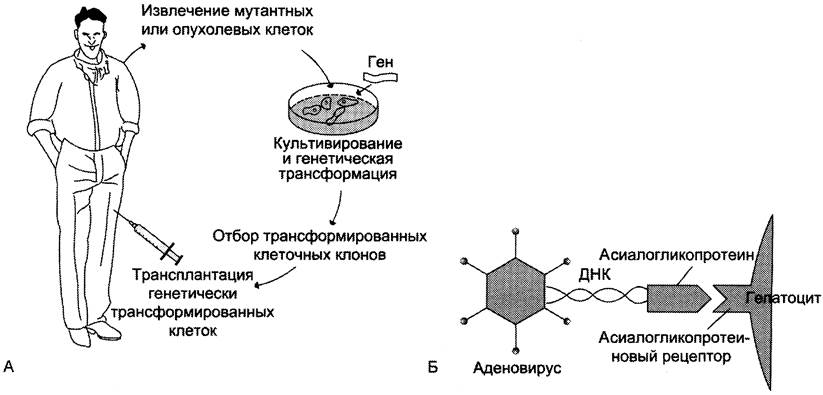
Генная терапия in vivo основана на прямом введении в специализированные ткани больного клонированных и определённым образом упакованных последовательностей ДНК, поступающих с помощью рецепторов в определённые типы клеток. В этом способе гены вводят, как правило, в виде аэрозольных и инъецируемых форм. Наиболее часто аэрозольную генотерапию используют при лечении болезней лёгких (например, раке лёгких) и муковисцидоза.
Наряду с развитием исследований, касающихся лечения наследственных дефектов, генотерапию всё чаще используют для лечения ненаследственных, главным образом, инфекционных и онкологических болезней (см. раздел 16).
Единственное и непременное ограничение таких работ состоит в том, чтобы все генотерапевтические мероприятия были направлены на конкретного больного и затрагивали только его соматические клетки.
Современный уровень знаний не позволяет проводить коррекцию генных дефектов на уровне половых клеток и клеток ранних доимплантационных зародышей человека в связи с реальной опасностью засорения генофонда нежелательными генными конструкциями и внесения мутаций с непредсказуемыми результатами.
В целях предотвращения распространения дефектных генов в популяции людей и рождения детей с наследственными патологиями во многих странах мира работают генетические консультанты, а также проводят пренатальную диагностику, позволяющую оценить здоровье плода с использованием анализа ДНК на самых ранних стадиях развития.