БИОХИМИЯ УЧЕБНИК ДЛЯ ВУЗОВ - Е. С. Северина - 2004
РАЗДЕЛ 1. СТРОЕНИЕ, СВОЙСТВА И ФУНКЦИИ БЕЛКОВ
III. Формирование трехмерной структуры белка в клетке
Формирование трёхмерной структуры белков — важнейший биологический процесс, так как от пространственной структуры белков зависит их биологическая функция.
Процесс сворачивания полипептидной цепи в правильную пространственную структуру получил название «фолдинг белков». Индивидуальные белки, продукты одного гена, имеют идентичную аминокислотную последовательность и приобретают в одинаковых условиях клетки одинаковую конформацию и функцию. Это положение подтверждается способностью некоторых белков после денатурации (при которой происходит разрыв слабых связей, но не повреждается первичная структура белков) спонтанно восстанавливать свою уникальную конформацию и функцию.
Однако в клетке концентрация белков настолько высока, что существует большая вероятность взаимодействия белков с несформированной конформацией. На их поверхности располагаются гидрофобные радикалы, склонные к объединению. Поэтому для многих белков, имеющих высокую молекулярную массу и сложную пространственную структуру, фолдинг протекает при участии специальной группы белков, которые называют «шапероны» (от франц. shaperon — няня).
А. Ренативация белков
Долгое время считалось, что процесс денатурации белков необратим. Однако оказалось, что некоторые очищенные и денатурированные белки способны в опытных условиях восстанавливать конформацию при удалении денатурирующих агентов.
Ренативация рибонуклеазы
В начале 60-х г. XX века обнаружили, что процесс денатурации белков может быть обратимым. Это открытие было сделано при изучении денатурации рибонуклеазы — фермента, расщепляющего связи между нуклеотидами в РНК. Рибонуклеаза — глобулярный белок, содержащий одну полипептидную цепь, состоящую из 124 аминокислотных остатков. Его конформацию стабилизируют 4 дисульфидные и множество слабых связей.
Обработка рибонуклеазы β-меркаптоэтанолом (формула β-меркаптоэтанола — НО-СН2-СН2- SН) приводит к разрыву дисульфидных связей и восстановлению SН-групп цистеиновых, остатков, что нарушает компактную структуру белка. Добавление 8 М раствора мочевины или 6 М раствора гуанидинхлорида, вызывающих разрыв слабых связей в белке и образование новых водородных связей с денатурирующими агентами, приводит к образованию случайным образом свёрнутых полипептидных цепей рибонуклеазы, лишённых ферментативной активности, т. е. к денатурации фермента. Денатурирующие агенты не разрушают первичную структуру белка.
Однако если путём диализа очистить рибонуклеазу от денатурирующих агентов и β-меркап-тоэтанола, ферментативная активность белка постепенно восстанавливается. Этот процесс называется ренатурацией, или ренативацией белка. Сульфгидрильные группы денатурированного фермента под действием кислорода воздуха окисляются, в результате вновь возникают 4 дисульфидные связи, характерные для нативной структуры белка. Из 105 возможных способов связывания восьми SН-групп остатков цистеина реализуется только один вариант, характерный для нативной конформации белка (рис. 1-22).
Рис. 1-22. Денатурация и ренативация рибонуклеазы. А - нативная молекула рибонуклеазы, в третичной структуре которой имеются 4 дисульфидные связи; Б - денатурированная молекула рибонуклеазы; В - нативная молекула рибонуклеазы, в структуре которой вновь образованы 4 дисульфидные связи между теми же остатками цистеина.
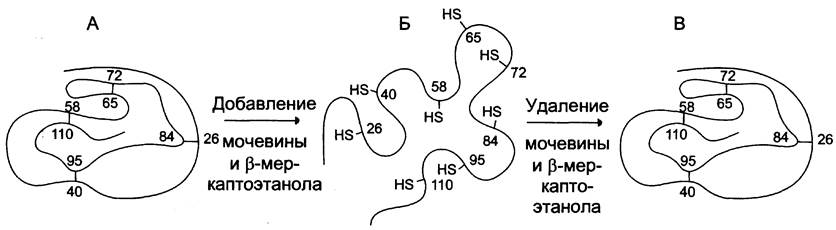
Возможность ренативации впоследствии была доказана и для других белков, в частности миоглобина. Сохранность первичной структуры белка — необходимое условие для восстановления его конформации. На основании этих опытов был выведен фундаментальный принцип молекулярной биологии: аминокислотная последовательность белков определяет их конформацию и специфическую функцию.
Формирование пространственной структуры белка — самопроизвольный процесс, при котором белок стремится принять в данных условиях конформацию с наименьшей свободной энергией. Изменение условий окружающей среды или изменение первичной структуры данного белка могут привести к изменению его конформации и функции.
Б. Структура и функциональная роль шаперонов в фолдинге белков
В процессе синтеза полипептидных цепей, транспорта их через мембраны, при сборке олигомерных белков возникают промежуточные нестабильные конформации, склонные к агрегации. На вновь синтезированном полипептиде имеется множество гидрофобных радикалов, которые в трёхмерной структуре спрятаны внутри молекулы. Поэтому на время формирования нативной конформации реакционноспособные аминокислотные остатки одних белков должны быть отделены от таких же групп других белков.
Во всех известных организмах от прокариотов до высших эукариотов обнаружены белки, способные связываться с белками, находящимися в неустойчивом, склонном к агрегации состоянии. Они способны стабилизировать их конформацию, обеспечивая фолдинг белков. Эти белки получили название «шапероны».
1. Классификации шаперонов (Ш)
В соответствии с молекулярной массой все шапероны можно разделить на 6 основных групп:
✵ высокомолекулярные, с молекулярной массой от 100 до 110 кД;
✵ Ш-90 — с молекулярной массой от 83 до 90 кД;
✵ Ш-70 — с молекулярной массой от 66 до 78 кД;
✵ Ш-60;
✵ Ш-40;
✵ низкомолекулярные шапероны с молекулярной массой от 15 до 30 кД.
Среди шаперонов различают: конститутивные белки (высокий базальный синтез которых не зависит от стрессовых воздействий на клетки организма), и индуцибельные, синтез которых в нормальных условиях идёт слабо, но при стрессовых воздействиях на клетку резко увеличивается. Индуцибельные шапероны относят к «белкам теплового шока», быстрый синтез которых отмечают практически во всех клетках, которые подвергаются любым стрессовым воздействиям. Название «белки теплового шока» возникло в результате того, что впервые эти белки были обнаружены в клетках, которые подвергались воздействию высокой температуры.
2. Роль шаперонов в фолдинге белков
При синтезе белков N-концевая область полипептида синтезируется раньше, чем С-концевая область. Для формирования конформации белка нужна его полная аминокислотная последовательность. Поэтому в период синтеза белка на рибосоме защиту реакционноспособных радикалов (особенно гидрофобных) осуществляют Ш-70.
Ш-70 — высококонсервативный класс белков, который присутствует во всех отделах клетки: цитоплазме, ядре, ЭР, митохондриях. В области карбоксильного конца единственной полипептидной цепи шаперонов есть участок, образованный радикалами аминокислот в форме бороздки. Он способен взаимодействовать с участками белковых молекул и развёрнутых полипептидных цепей длиной в 7 — 9 аминокислот, обогащённых гидрофобными радикалами. В синтезирующейся полипептидной цепи такие участки встречают примерно через каждые 16 аминокислот.
Фолдинг многих высокомолекулярных белков, имеющих сложную конформацию (например, доменное строение), осуществляется в специальном пространстве, сформированном Ш-60. Ш-60 функционируют в виде олигомерного комплекса, состоящего из 14 субъединиц (рис. 1-23).
Рис. 1-23. Структура шаперонового комплекса, состоящего из 14 белковых молекул Ш-60.
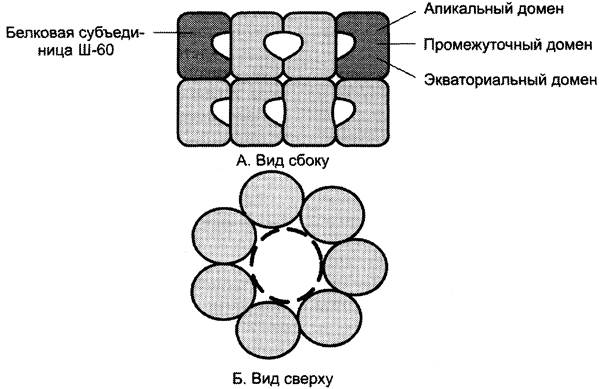
Ш-60 образуют 2 кольца, каждое из которых состоит из 7 субъединиц, соединённых друг с другом. Субъединица Ш-60 состоит из 3 доменов: апикального (верхушечного), промежуточного и экваториального. Верхушечный домен имеет ряд гидрофобных остатков, обращённых в полость кольца, сформированного субъединицами. Экваториальный домен имеет участок связывания с АТФ и обладает АТФ-азной активностью, т. е. способен гидролизовать АТФ до АДФ и Н3РO4.
Шапероновый комплекс имеет высокое сродство к белкам, на поверхности которых есть элементы, характерные для несвёрнутых молекул (прежде всего участки, обогащённые гидрофобными радикалами). Попадая в полость шаперонового комплекса, белок связывается с гидрофобными радикалами апикальных участков Ш-60. В специфической среде этой полости, в изоляции от других молекул клетки происходит перебор возможных конформаций белка, пока не будет найдена единственная, энергетически наиболее выгодная конформация.
Высвобождение белка со сформированной нативной конформацией сопровождается гидролизом АТФ в экваториальном домене. Если белок не приобрёл нативной конформации, то он вступает в повторную связь с шапероновым комплексом. Такой шаперонзависимый фолдинг белков требует затрат большого количества энергии.
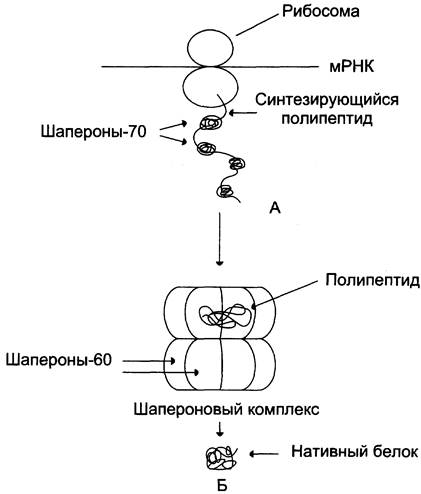
Таким образом, синтез и фолдинг белков протекают при участии разных групп шаперонов, препятствующих нежелательным взаимодействиям белков с другими молекулами клетки и сопровождающих их до окончательного формирования нативной структуры (рис. 1-24).
Рис. 1-24. Участие шаперонов в фолдинге белков. А - участие шаперонов-70 в предотвращении гидрофобных взаимодействий между участками синтезирующегося полипептида; Б - формирование нативной конформации белка в шапероновом комплексе.
3. Роль шаперонов в защите белков клеток от денатурирующих стрессовых воздействий
Шапероны, участвующие в защите клеточных белков от денатурирующих воздействий, как уже говорилось выше, относят к белкам теплового шока (БТШ) и в литературе часто обозначают как HSP (от англ. heat shock protein).
При действии различных стрессовых факторов (высокая температура, гипоксия, инфекция, УФО, изменение pH среды, изменение молярности среды, действие токсичных химических веществ, тяжёлых металлов и т. д.) в клетках усиливается синтез БТШ. Имея высокое сродство к гидрофобным участкам частично денатурированных белков, они могут препятствовать их полной денатурации и восстанавливать нативную конформацию белков.
Установлено, что кратковременные стрессовые воздействия увеличивают выработку БТШ и повышают устойчивость организма к длительным стрессовым воздействиям. Так, кратковременная ишемия сердечной мышцы в период бега при умеренных тренировках значительно повышает устойчивость миокарда к длительной ишемии, вызванной стенокардией или закупоркой сосудов сердца тромбом. В настоящее время перспективными исследованиями в медицине считают поиски фармакологических и молекулярно-биологических способов активации синтеза БТШ в клетках.
4. Болезни, связанные с нарушением фолдинга белков
Расчёты показали, что лишь небольшая часть теоретически возможных вариантов полипептидных цепей может принимать одну стабильную пространственную структуру. Большинство же таких белков может принимать множество конформаций с примерно одинаковой энергией Гиббса, но с различными свойствами. Первичная структура большинства известных белков, отобранных эволюцией, обеспечивает исключительную стабильность одной конформации.
Однако некоторые растворимые в воде белки при изменении условий могут приобретать конформацию плохо растворимых, способных к агрегации молекул, образующих в клетках фибриллярные отложения, именуемые амилоидом (от лат. amylum — крахмал). Так же, как и крахмал, амилоидные отложения выявляют при окраске ткани йодом. Это может происходить:
✵ при гиперпродукции некоторых белков, в результате чего увеличивается их концентрация в клетке;
✵ при попадании в клетки или образовании в них белков, способных влиять на конформацию других молекул белка;
✵ при активации протеолиза нормальных белков организма, с образованием нерастворимых, склонных к агрегации фрагментов;
✵ в результате точечных мутаций в структуре белка.
В результате отложения амилоида в органах и тканях нарушаются структура и функция клеток, наблюдают их дегенеративные изменения и разрастание соединительнотканных или глиальных клеток. Развиваются болезни, называемые амилоидозами. Для каждого вида амилоидоза характерен определённый тип амилоида. В настоящее время описано более 15 таких болезней.
Болезнь Альцхаймера
Болезнь Альцхаймера — наиболее часто отмечаемый β-амилоидоз нервной системы, как правило, поражающий лиц преклонного возраста и характеризующийся прогрессирующим расстройством памяти и полной деградацией личности. В ткани мозга откладывается β-амилоид — белок, образующий нерастворимые фибриллы, нарушающие структуру и функции нервных клеток. β-амилоид — продукт изменения конформации нормального белка организма человека. Он образуется из более крупного предшественника частичным протеолизом и синтезируется во многих тканях. β-Амилоид, в отличие от своего нормального предшественника, содержащего много α-спиральных участков, имеет вторичную β-складчатую структуру, агрегирует с образованием нерастворимых фибрилл, устойчив к действию протеолитических ферментов.
Причины нарушения фолдинга нативных белков в ткани мозга ещё предстоит выяснить. Возможно, с возрастом уменьшается синтез шаперонов, способных участвовать в формировании и поддержании нативной конформации белков, или увеличивается активность протеаз, что приводит к увеличению концентрации белков, склонных изменять конформацию.
Прионовые болезни
Прионы — особый класс белков, обладающих инфекционными свойствами. Попадая в организм человека или спонтанно возникая в нём, они способны вызывать тяжёлые неизлечимые заболевания ЦНС, называемые прионовыми болезнями. Название «прионы» происходит от аббревиатуры английской фразы proteinaceous infectious particle — белковая инфекционная частица.
Прионовый белок кодируется тем же геном, что и его нормальный аналог, т. е. они имеют идентичную первичную структуру. Однако два белка обладают различной конформацией: прионовый белок характеризуется высоким содержанием β-слоёв, в то время как нормальный белок имеет много α-спиральных участков. Кроме того, прионовый белок обладает устойчивостью к действию протеаз и, попадая в ткань мозга или образуясь там спонтанно, способствует превращению нормального белка в прионовый в результате межбелковых взаимодействий. Образуется так называемое «ядро полимеризации», состоящее из агрегированных прионовых белков, к которому способны присоединяться новые молекулы нормального белка. В результате в их пространственной структуре происходят конформационные перестройки, характерные для прионовых белков.
Известны случаи наследственных форм прионовых болезней, вызванных мутациями в структуре данного белка. Однако возможно и заражение человека прионовыми белками, в результате чего возникает заболевание, приводящее к гибели больного. Так, куру — прионовая болезнь аборигенов Новой Гвинеи, эпидемический характер которой связан с традиционным каннибализмом в этих племенах и передачей инфекционного белка от одной особи к другой. В связи с изменением образа их жизни данное заболевание практически исчезло.
В настоящее время интерес к прионовым болезням возрос в связи с заражением людей прионами при употреблении мясопродуктов, полученных от животных, являющихся носителями прионов, вызывающих «бешенство коров» (болезнь Кройтцфельдта — Якоба). Несмотря на то, что прионовые белки человека и животных различаются лишь незначительно, долгое время полагали, что существуют межвидовые барьеры на пути передачи болезни. Однако последние данные показали, что эти барьеры не абсолютны, и что существует принципиальная возможность передачи болезни от одного вида другому. Так, в Великобритании к середине 1999 г. было зарегистрировано около 40 случаев данного заболевания. Прогноз не исключает развития эпидемии прионовой болезни в ближайшие 10 — 15 лет.