БИОХИМИЯ УЧЕБНИК ДЛЯ ВУЗОВ - Е. С. Северина - 2004
РАЗДЕЛ 7. ОБМЕН УГЛЕВОДОВ
VII. Регуляция метаболизма гликогена
Процессы накопления глюкозы в виде гликогена и его распада должны быть согласованы с потребностями организма в глюкозе как источнике энергии. Одновременное протекание этих метаболических путей невозможно, так как в этом случае образуется «холостой» цикл, существование которого приводит только к бесполезной трате АТФ.
Изменение направления процессов в метаболизме гликогена обеспечивают регуляторные механизмы, в которых участвуют гормоны. Переключение процессов синтеза и мобилизации гликогена происходит при смене абсорбтивного периода на постабсорбтивный или состояния покоя организма на режим физической работы. В переключении этих метаболических путей в печени участвуют гормоны инсулин, глюкагон и адреналин, а в мышцах — инсулин и адреналин.
А. Характеристика гормонов, регулирующих обмен гликогена
Первичным сигналом для синтеза и секреции инсулина и глюкагона является изменение уровня глюкозы в крови. В норме концентрация глюкозы в крови соответствует 3,3 — 5,5 ммоль/л (60 — 100 мг/дл).
Инсулин — белковый гормон, синтезируется и секретируется в кровь β-клетками островков Лангерханса поджелудочной железы. β-клетки чувствительны к изменениям содержания глюкозы в крови и секретируют инсулин в ответ на повышение её содержания после приёма пищи. Транспортный белок (ГЛЮТ-2), обеспечивающий поступление глюкозы в β-клетки, отличается низким сродством к ней. Следовательно, этот белок транспортирует глюкозу в клетку поджелудочной железы лишь после того, как её содержание в крови будет выше нормального уровня (более 5,5 ммоль/л).
В β-клетках глюкоза фосфорилируется глюкокиназой, имеющей также высокую Кm для глюкозы — 12 ммоль/л. Скорость фосфорилирования глюкозы глюкокиназой в β-клетках прямо пропорциональна её концентрации в крови.
Синтез инсулина регулируется глюкозой. Глюкоза (или её метаболиты), по-видимому, непосредственно участвуют в регуляции экспрессии гена инсулина. Секреция инсулина и глюкагона также регулируется глюкозой, которая стимулирует секрецию инсулина из β-клеток и подавляет секрецию глюкагона из α-клеток. Кроме того, сам инсулин снижает секрецию глюкагона (см. раздел 11).
Глюкагон — «гормон голода», вырабатываемый α-клетками поджелудочной железы в ответ на снижение уровня глюкозы в крови. По химической природе глюкагон — пептид.
Адреналин выделяется из клеток мозгового вещества надпочечников в ответ на сигналы нервной системы, идущие из мозга при возникновении экстремальных ситуаций (например, бегство или борьба), требующих внезапной мышечной деятельности. Адреналин является сигналом «тревоги». Он должен мгновенно обеспечить мышцы и мозг источником энергии.
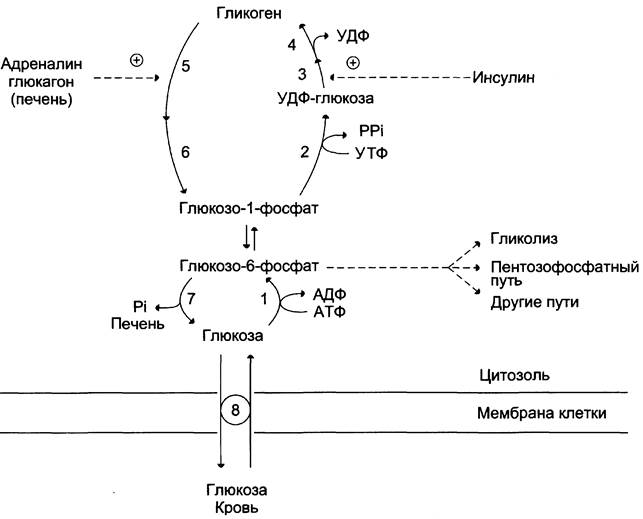
Рис. 7-26. Синтез и распад гликогена. 1 — гексокиназа или глюкокиназа (печень); 2 — УДФ-глюкопирофосфорилаза; 3 — гликогенсинтаза; 4 — амило-1,4 —> 1,6-глюкозилтрансфераза (фермент ветвления); 5 — гликогенфосфорилаза; 6 — «деветвящий» фермент; 7 — глюкозо-6-фосфатаза (печень); 8 — транспортные системы ГЛЮТ.
Б. Регуляция активности гликогенфосфорилазы и гликогенсинтазы
Поскольку синтез и распад гликогена протекают по различным метаболическим путям, эти процессы могут контролироваться реципрокно. Влияние гормонов на синтез и распад гликогена осуществляется путём изменения в противоположных направлениях активности двух ключевых ферментов: гликогенсинтазы и гликогенфосфорилазы с помощью их фосфорилирования и дефосфорилирования (рис. 7-27).
Гликогенфосфорилаза существует в 2 формах: 1) фосфорилированная — активная (форма а); 2) дефосфорилированная — неактивная (форма в). Фосфорилирование осуществляется путём переноса фосфатного остатка с АТФ на гидроксильную группу одного из сериновых остатков фермента. Следствие этого — конформационные изменения молекулы фермента и его активация.
Взаимопревращения 2 форм гликогенфосфорилазы обеспечиваются действием ферментов киназы фосфорилазы и фосфопротеинфосфатазы (фермент, структурно связанный с молекулами гликогена). В свою очередь, активность киназы фосфорилазы и фосфопротеинфосфатазы также регулируется путём фосфорилирования и дефосфорилирования.
Активация киназы фосфорилазы происходит под действием протеинкиназы А — ПКА (цАМФ- зависимой). цАМФ сначала активирует протеинкиназу А, которая фосфорилирует киназу фосфорилазы, переводя её в активное состояние, а та, в свою очередь, фосфорилирует гликогенфосфорилазу. Синтез цАМФ стимулируется адреналином и глюкагоном (см. раздел 5).
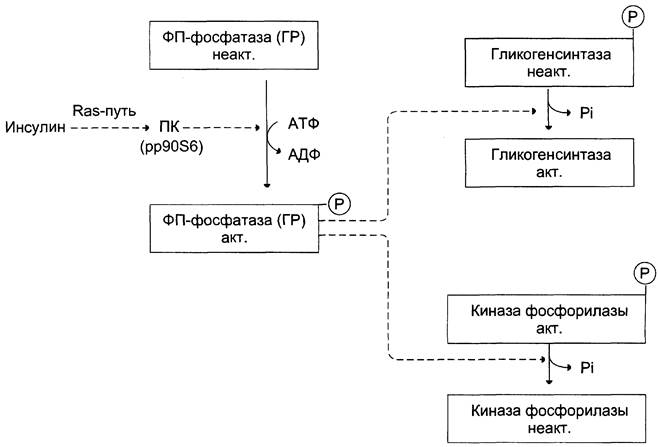
Активация фосфопротеинфосфатазы происходит в результате реакции фосфорилирования, катализируемой специфической протеинкиназой, которая, в свою очередь, активируется инсулином посредством каскада реакций с участием Ras-белка, а также других белков и ферментов (сигнальный Ras-путь, см. раздел 11). Активируемая инсулином протеинкиназа фосфорилирует и тем самым активирует фосфопротеинфосфатазу. Активная фосфопротеинфосфатаза дефосфорилирует и, следовательно, инактивирует киназу фосфорилазы и гликогенфосфорилазу (рис. 7-28).
Рис. 7-27. Изменение активности гликогенфосфорилазы и гликогенсинтазы. Кружками обозначены молекулы фермента: активные — чёрные, неактивные — белые. ФП-фосфатаза (ГР) — фосфопротеинфосфатаза гранул гликогена.
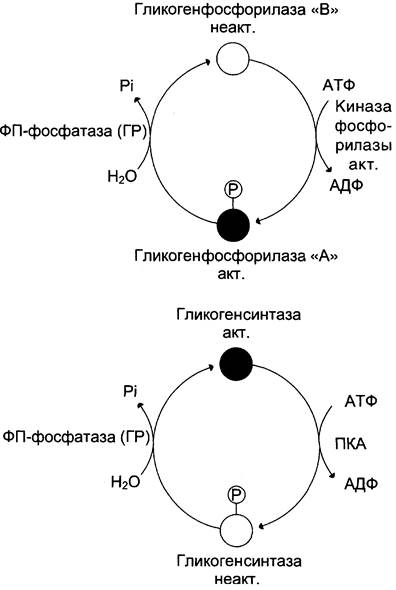
Активность гликогенсинтазы также изменяется в результате фосфорилирования и дефосфорилирования (см. выше рис. 7-27). Однако есть существенные различия в регуляции гликогенфосфорилазы и гликогенсинтазы:
✵ фосфорилирование гликогенсинтазы катализирует ПК А и вызывает её инактивацию;
✵ дефосфорилирование гликогенсинтазы под действием фосфопротеинфосфатазы, наоборот, её активирует.
Рис. 7-28. Влияние инсулина на активность гликогенсинтазы и киназы фосфорилазы. ФП-фосфатаза (ГР) — фосфопротеинфосфатаза гранул гликогена. ПК (рр90S6) — протеинкиназа, активируемая инсулином.
В. Регуляция метаболизма гликогена в печени
Как уже отмечалось, первичный сигнал для синтеза инсулина и глюкагона — изменение концентрации глюкозы в крови. Инсулин и глюкагон постоянно присутствуют в крови, но при смене абсорбтивного периода на постабсорбтивный изменяется их относительная концентрация, что является главным фактором, переключающим метаболизм гликогена в печени. Отношение концентрации инсулина в крови к концентрации глюкагона называют «инсулин- глюкагоновый индекс». В постабсорбтивном периоде инсулин-глюкагоновый индекс снижается, и решающее значение в регуляции концентрации глюкозы в крови приобретает концентрация глюкагона.
Глюкагон ддя гепатоцитов служит внешним сигналом о необходимости выделения в кровь глюкозы за счёт распада гликогена (гликогенолиза) или синтеза глюкозы из других веществ — глюконеогенеза (этот процесс будет изложен позднее). Гормон связывается с рецептором на плазматической мембране и активирует при посредничестве G-белка аденилатциклазу, которая катализирует образование цАМФ из АТФ (см. раздел 5). Далее следует каскад реакций, приводящий в печени к активации гликогенфосфорилазы и ингибированию гликогенсинтазы (рис. 7-29). Этот механизм приводит к высвобождению из гликогена глюкозо-1-фосфата, который превращается в глюкозо-6-фосфат. Затем под влиянием глюкозо-6-фосфатазы образуется свободная глюкоза, способная выйти из клетки в кровь. Таким образом, глюкагон в печени, стимулируя распад гликогена, способствует поддержанию глюкозы в крови на постоянном уровне.
Адреналин стимулирует выведение глюкозы из печени в кровь, для того чтобы снабдить ткани (в основном мозг и мышцы) «топливом» в экстремальной ситуации. Эффект адреналина в печени обусловлен фосфорилированием (и активацией) гликогенфосфорилазы. Адреналин имеет сходный с глюкагоном механизм действия (рис. 7-29). Но возможно включение и другой эффекторной системы передачи сигнала в клетку печени (рис. 7-30).
Рис. 7-29. Регуляция синтеза и распада гликогена в печени глюкагоном и адреналином. 1 — глюкагон и адреналин взаимодействуют со специфическими мембранными рецепторами. Комплекс гормон-рецептор влияет на конформацию G-белка, вызывая диссоциацию его на протомеры и замену в α-субъединице ГДФ на ГТФ; 2 — α-субъединица, связанная с ГТФ, активирует аденилатциклазу, катализирующую синтез цАМФ из АТФ; 3 — в присутствии цАМФ протеинкиназа А (цАМФ-зависимая) обратимо диссоциирует, освобождая обладающие каталитической активностью субъединицы С; 4 — протеинкиназа А фосфорилирует и активирует киназу фосфорилазы; 5 — киназа фосфорилазы фосфорилирует гликогенфосфорилазу, переводя её в активную форму; 6 — протеинкиназа А фосфорилирует также гликогенсинтазу, переводя её в неактивное состояние; 7 — в результате ингибирования гликогенсинтазы и активации гликогенфосфорилазы гликоген включается в процесс распада; 8 — фосфодиэстераза катализирует распад цАМФ и тем самым прерывает действие гормонального сигнала. Комплекс α-субъединица-ГТФ затем распадается, α-, β- и y-субъединицы G-белка реассоциируются.
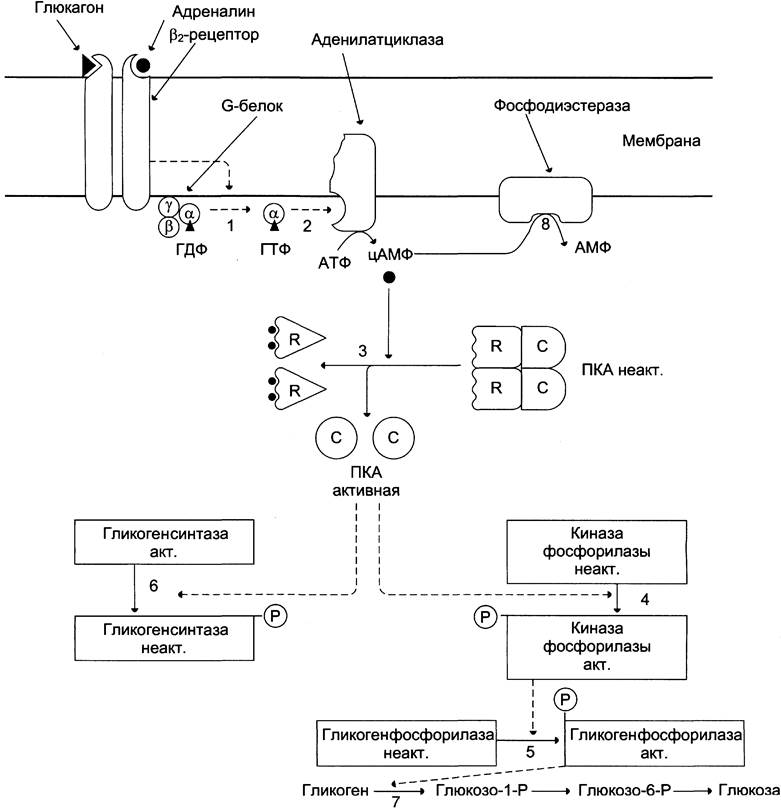
Рис. 7-30. Регуляция синтеза и распада гликогена в печени адреналином и Са2+. ФИФ2 — фосфатидилинозитолбисфосфат; ИФ3— инозитол-1,4,5-трифосфат; ДАГ — диацилглицерол; ЭР — эндоплазматический ретикулум; ФС — фосфодитилсерин. 1 — взаимодействие адреналина с α1-рецептором трансформирует сигнал через активацию G-белка на фосфолипазу С, переводя её в активное состояние; 2 — фосфолипаза С гидролизует ФИФ2 на ИФ3 и ДАГ; 3 — ИФ3 активирует мобилизацию Са2+ из ЭР; 4 — Са2+, ДАГ и фосфодитилсерин активируют протеинкиназу С. Протеинкиназа С фосфорилирует гликогенсинтазу, переводя её в неактивное состояние; 5 — комплекс 4Са2+-кальмодулин активирует киназу фосфорилазы и кальмодулин- зависимые протеинкиназы; 6 — киназа фосфорилазы фосфорилирует гликогенфосфорилазу и тем самым её активирует; 7 — активные формы трёх ферментов (кальмодулинзависимая протеинкиназа, киназа фосфорилазы и протеинкиназа С) фосфорилируют гликогенсинтазу в различных центрах, переводя её в неактивное состояние.
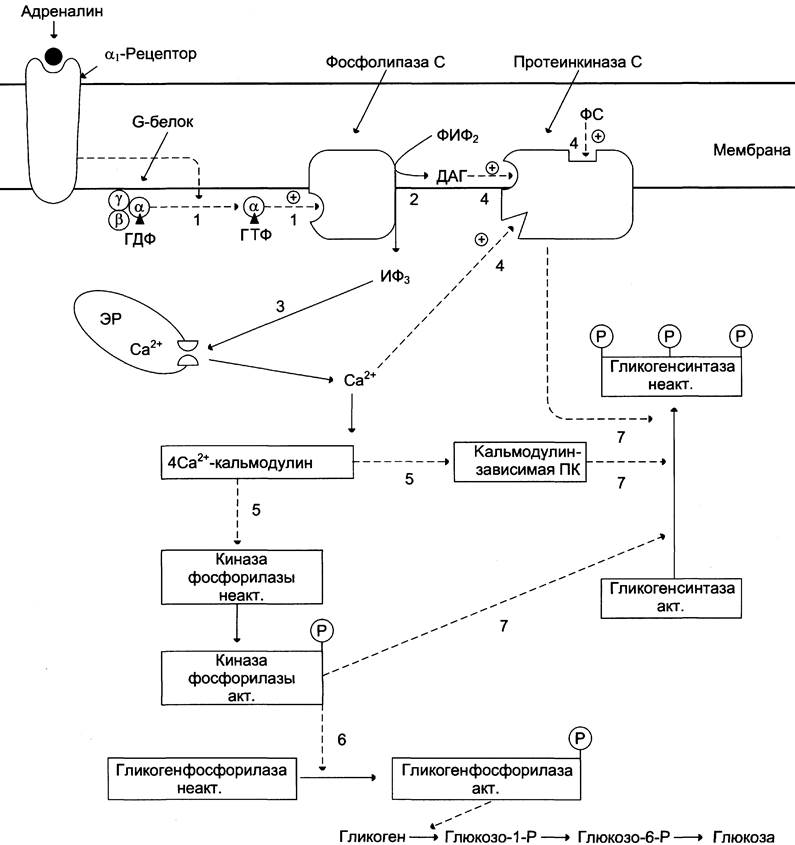
Какая система передачи сигнала в клетку будет использована, зависит от типа рецепторов, с которыми взаимодействует адреналин. Так, взаимодействие адреналина с β2-рецепторами клеток печени приводит в действие аденилатциклазную систему. Взаимодействие же адреналина с α1-рецепторами «включает» инозитолфосфат- ный механизм трансмембранной передачи гормонального сигнала. Результат действия обеих систем — фосфорилирование ключевых ферментов и переключение процессов с синтеза гликогена на его распад. Следует отметить, что тип рецепторов, который в наибольшей степени вовлекается в ответ клетки на адреналин, зависит от концентрации его в крови.
В период пищеварения преобладает влияние инсулина, так как инсулин-глюкагоновый индекс в этом случае повышается. В целом инсулин влияет на обмен гликогена противоположно глюкагону. Инсулин снижает концентрацию глюкозы в крови в период пищеварения, действуя на метаболизм печени следующим образом:
✵ снижает уровень цАМФ в клетках, фосфорилируя (опосредованно через Ras-путь) и тем самым активируя протеинкиназу В (цАМФ-независимую). Протеинкиназа В, в свою очередь, фосфорилирует и активирует фосфодиэстеразу цАМФ — фермент, гидролизующий цАМФ с образованием АМФ. Механизм влияния инсулина на уровень цАМФ в клетке подробнее будет изложен в разделе 11;
✵ активирует (через Ras-путь) фосфопротеинфосфатазу гранул гликогена, которая дефосфорилирует гликогенсинтазу и таким образом её активирует. Кроме того, фосфопротеинфосфатаза дефосфорилирует и, следовательно, инактивирует киназу фосфорилазы и гликогенфосфорилазу;
✵ индуцирует синтез глюкокиназы, тем самым ускоряя фосфорилирование глюкозы в клетке. Следует напомнить, что регуляторным фактором в метаболизме гликогена является также величина Кm глюкокиназы, которая много выше, чем Кm гексокиназы. Смысл этих различий понятен: печень не должна потреблять глюкозу для синтеза гликогена, если её количество в крови в пределах нормы.
Всё это вместе приводит к тому, что инсулин одновременно активирует гликогенсинтазу и ингибирует гликогенфосфорилазу, переключая процесс мобилизации гликогена на его синтез.
В печени существует и аллостерическая регуляция гликогенфосфорилазы, обеспечивающая внутриклеточные потребности в глюкозе, но гормональные сигналы имеют приоритет над внутриклеточными и преследуют другие физиологические цели. Ранее (см. раздел 6) рассматривалось значение изменения в клетке уровней АТФ, АДФ и АМФ как показателя, отражающего потребности клетки в энергии. Замедление утилизации АТФ сопровождается снижением активности гликогенфосфорилазы и уменьшением скорости распада гликогена. Напротив, увеличение расходования АТФ ведёт к повышению уровня АМФ, активации гликогенфосфорилазы и ускорению распада гликогена. АТФ и АМФ являются аллостерическими эффекторами по отношению к гликогенфосфорилазе. Существует также и метаболический контроль активности гликогенфосфорилазы. Так, при повышении концентрации глю- козо-6-фосфата активность этого фермента в клетках печени снижается.
Г. Регуляция метаболизма гликогена в мышцах
Регуляция обмена гликогена в мышцах обеспечивает энергетическим материалом как интенсивную работу мышц (бег или борьба), так и энергозатраты в состоянии покоя.
В экстремальных ситуациях в мышечных клетках мобилизация гликогена ускоряется адреналином. Связывание адреналина с β-рецепторами, ассоциированными с аденилатциклазной системой, приводит к образованию цАМФ в клетке, а затем фосфорилированию и активации киназы фосфорилазы и гликогенфосфорилазы (рис. 7-31).
Образование цАМФ, стимулированное адреналином, служит сигналом к увеличению производства энергии в результате ускорения расщепления гликогена. Именно в ходе распада, образованного из гликогена глюкозо-6-фосфата, синтезируется АТФ.
Инактивация гликогенсинтазы под влиянием адреналина в мышечных клетках проходит так же, как и в печени.
В состоянии покоя при низких концентрациях адреналина в крови гликогенфосфорилаза мышц находится в дефосфорилированном — неактивном состоянии (форма В), но распад гликогена всё-таки происходит. Это объясняется тем, что гликогенфосфорилаза активируется способом, не связанным с её фосфорилированием, так как уровень цАМФ в клетке низкий. В данной ситуации происходит аллостерическая активация гликогенфосфорилазы В. Активаторами фермента служат АМФ и Н3РO4, образующиеся в клетке при распаде АТФ (рис. 7-31, путь 1).
Рис. 7-31. Активация гликогенфосфорилазы мышц. 1 —аллостерическая активация гликогенфосфорилазы В. В процессе мышечного сокращения происходит разрушение АТФ с образованием АМФ, который является аллостерическим активатором гликогенфосфорилазы В; 2 — нервный импульс инициирует освобождение Са2+ из саркоплазматического ретикулума. Са2+ образует комплекс с кальмодулином, способный активировать киназу фосфорилазы; 3 — активация гликогенфосфорилазы адреналином через аденилатциклазную систему.
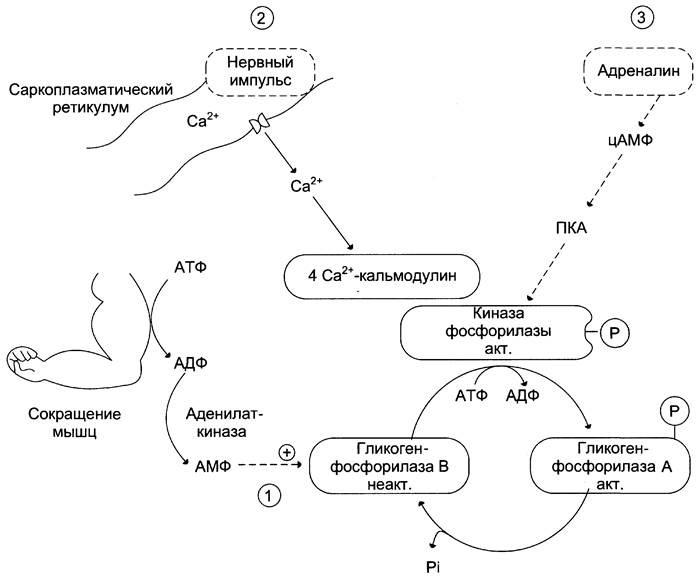
При умеренных мышечных сокращениях, т. е. в ситуации, не требующей участия в регуляции цАМФ, аллостерическим способом активируется киназа фосфорилазы (рис. 7-31, путь 2). В данном случае аллостерическими эффекторами служат ионы Са2+, концентрация которых резко возрастает при сокращении мышц в ответ на сигнал от двигательного нерва. Активность фермента снижается сразу же, как только концентрация Са2+ в клетке уменьшается после поступления сигнала к расслаблению мышц. Таким образом, роль ионов Са2+ заключается не только в инициации мышечного сокращения, но также в обеспечении его энергозатрат.
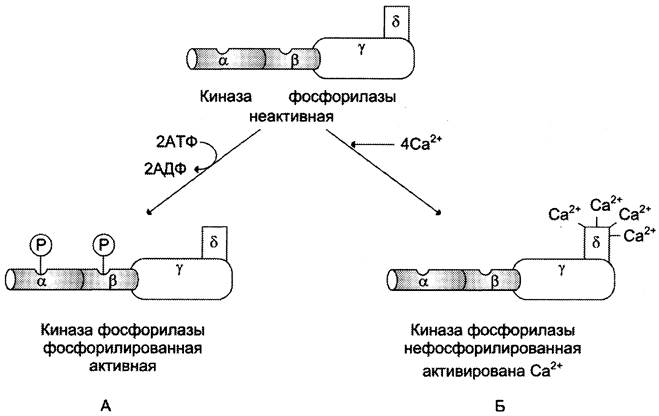
Активация киназы фосфорилазы с помощью ионов Са2+ опосредована кальмодулином. Кальмодулин в данном случае — прочно связанная субъединица фермента (рис. 7-32). Мышечная киназа фосфорилазы состоит из субъединиц 4 типов: α, β, y и δ, объединённых в комплекс. Фермент включает 4 таких комплекса. Каталитической активностью обладает y-субъединица. Субъединицы α и β выполняют регуляторную функцию. Они содержат остатки серина, фосфорилируемые ПК А. δ -Субъединица связывает 4 иона кальция; она идентична белку кальмодулину. Связывание ионов кальция вызывает конформационные изменения, что приводит к активации каталитического центра y-субъединицы, хотя молекула остаётся в дефосфорилированном состоянии.
Рис. 7-32. Регуляция активности киназы фосфорилазы. Фермент состоит из 4 идентичных белковых комплексов. Каждый комплекс содержит 4 разных субъединицы α, β, y, δ. На рисунке показан один из тетрамеров. Каталитической активностью обладает y-субъединица, α- и β- протомеры выполняют регуляторную функцию, они фосфорилируются при участии ПК А. Кальмодулин — δ-субъединица, прочно связанная с ферментом. А — активация киназы фосфорилазы в результате фосфорилирования; Б — активация киназы фосфорилазы после присоединения Са2+ к кальмодулину.
В мышцах в период пищеварения, если он совпадает с состоянием покоя, происходит стимуляция синтеза гликогена. Мышечная работа во время пищеварения замедляет процесс синтеза гликогена, так как при этом мышцы используют для окисления глюкозу крови, поступающую из кишечника.
В переключении мобилизации гликогена на запасание глюкозы участвует инсулин. Как уже говорилось, глюкоза поступает в мышечные и жировые клетки с помощью глюкозотранспортёров ГЛЮТ-4. Транспортёры в отсутствие инсулина находятся в цитоплазме клеток, и глюкоза клетками не используется, так как в мембране нет белков-переносчиков. Инсулин стимулирует перемещение ГЛЮТ-4 и встраивание их в мембрану клеток. Механизм подобного влияния инсулина изучен недостаточно, но определены его основные этапы. Цепь событий при стимуляции инсулином потребления глюкозы мышцами и жировыми клетками выглядит следующим образом:
✵ рецептор инсулина (IR) — инсулинстимулируемая тирозиновая протеинкиназа — обязательный посредник всех действий инсулина (см. раздел 5);
✵ активированный инсулином IR фосфорилирует специфические цитоплазматические белки — субстраты инсулина (IRS);
✵ фосфорилированный субстрат (в основном IRS-1) соединяется с фосфатидилинозитол-3-киназой (ФИ-3-киназа) и активирует этот фермент;
Сактивная ФИ-3-киназа катализирует фосфорилирование по позиции 3 ряд компонентов инозитолфосфатной сигнальной системы, приводящей к стимуляции транслокации ГЛЮТ из цитозоля в плазматическую мембрану;
✵ глюкоза с помощью ГЛЮТ-4 поступает в мышечные клетки и включается в синтез гликогена.
Влияние инсулина на скорость синтеза гликогена в мышцах осуществляется посредством изменения активности гликогенсинтазы и гликогенфосфорилазы — ключевых ферментов, о чём уже говорилось при обсуждении влияния инсулина на метаболизм гликогена в печени.
Д. Нарушения обмена гликогена
Гликогеновые болезни — группа наследственных нарушений, в основе которых лежит снижение или отсутствие активности ферментов, катализирующих реакции синтеза или распада гликогена, либо нарушение регуляции этих ферментов.
1. Гликогенозы — заболевания, обусловленные дефектом ферментов, участвующих в распаде гликогена. Они проявляются или необычной структурой гликогена, или его избыточным накоплением в печени, сердечной или скелетных мышцах, почках, лёгких и других органах. В таблице 7-3 описаны некоторые типы глико- генозов, различающихся характером и локализацией ферментного дефекта.
Таблица 7-3. Характеристика некоторых гликогеновых болезней
Гликогенозы |
|||
Форма гликогеноза |
дефектный фермент |
проявления болезни |
тип, название болезни |
Печёночная |
Глюкозо-6-фосфатаза |
Гипогликемия, гиперацилглицеролемия, гиперурикемия, ацидоз (вследствие накопления лактата), характерное выражение лица («лицо китайской куклы»). |
I Болезнь Гирке |
Амило-1,6-глюкозидаза («деветвящий» фермент) |
Накопление гликогена с короткими внешними ветвями (лимитодекстрин). Остальные проявления менее выражены, чем при типе I. |
III Болезнь Форбса-Кори, лимитодекстриноз |
|
Амило-1,4 —> 1,6 глюкозилтрансфераза («ветвящий» фермент) |
Накопление структурно изменённого гликогена с очень длинными наружными ветвями и редкими точками ветвления. |
IV Болезнь Андерсена |
|
Фосфорилаза |
Накопление гликогена нормальной структуры. Умеренная гипогликемия, гепатомегалия, клинические проявления похожи, но менее выражены, чем при гликогенозах I и III типов. |
VI Болезнь Херса |
|
Киназа фосфорилазы |
Аналогичны VI типу |
IX |
|
Протеинкиназа А |
Аналогичны VI типу |
X |
|
Мышечные |
Гликогенфосфорилаза |
Боли в мышцах, судороги при физической нагрузке (даже умеренной). Накопление в мышцах гликогена нормальной структуры. |
V Болезнь МакАрдла |
Фосфофруктокиназа |
Аналогичны V типу |
VII |
|
Фосфоглицеромутаза |
Аналогичны V типу |
||
Лактатдегидрогеназа (М-протомер) |
Аналогичны V типу |
||
Смешанные |
Лизосомная α-1,4- гликозидаза |
Генерализованное накопление гликогена в лизосомах, а затем в цитозоле |
II Болезнь Помпе |
Следует отметить, что термин «гликогеноз» был впервые предложен К. Ф. Кори и Г. Т. Кори. Они же предложили систему нумерации этих болезней. Однако в настоящее время преобладает деление гликогенозов на 2 группы: печёночные и мышечные.
Печёночные формы гликогенозов ведут к нарушению использования гликогена для поддержания уровня глюкозы в крови. Поэтому общий симптом для этих форм — гипогликемия в постабсорбтивный период.
Болезнь Гирке (тип I) отмечают наиболее часто. Описание основных симптомов этого типа гликогеноза и их причин может служить основанием для понимания симптомов всех остальных типов. Причина этого заболевания — наследственный дефект глюкозо-6-фосфатазы — фермента, обеспечивающего выход глюкозы в кровоток после её высвобождения из гликогена клеток печени. Болезнь Гирке проявляется гипогликемией, гипертриацилглицеролемией (повышением содержания триацилглицеролов), гиперурикемией (повышением содержания мочевой кислоты).
Гипогликемия — следствие нарушения реакции образования свободной глюкозы из глюкозо-6-фосфата. Кроме того, вследствие дефекта глюкозо-6-фосфатазы происходит накопление в клетках печени субстрата — глюкозо-6-фосфата, который вовлекается в процесс катаболизма, где он превращается в пируват и лактат. В крови повышается количество лактата, поэтому возможен ацидоз. В тяжёлых случаях результатом гипогликемии могут быть судороги. Гипогликемия сопровождается уменьшением содержания инсулина и снижением отношения инсулин/глюкагон, что, в свою очередь, ведёт к ускорению липолиза жировой ткани в результате действия глюкагона и выходу в кровь жирных кислот (см. раздел 8).
Гипертриацилглицеролемия возникает в результате снижения активности ЛП-липазы жировой ткани — фермента, активируемого инсулином и обеспечивающего усвоение ТАГ клетками жировой ткани (см. раздел 8).
Гиперурикемия возникает в результате следующих событий:
✵ увеличиваются содержание в клетках глюкозо-6-фосфата и его использование в пентозофосфатном пути с образованием рибозо-5-фосфата — субстрата для синтеза пуриновых нуклеотидов;
✵ увеличивается образование мочевой кислоты вследствие избыточного синтеза, а, следовательно, и катаболизма пуриновых нуклеотидов, конечным продуктом которого является мочевая кислота.
✵ снижается выведение мочевой кислоты вследствие увеличения продукции лактата и изменения pH мочи в кислую сторону, что затрудняет выведение уратов — труднорастворимых солей мочевой кислоты.
При диагностике данной патологии определяют активность глюкозо-6-фосфатазы в биоптатах печени. Кроме того, используют тест со стимуляцией глюкагоном или адреналином, который в случае болезни даёт отрицательный результат, т. е. после инъекции гормона уровень глюкозы в крови изменяется незначительно.
Лечение состоит в ограничении употребления продуктов, содержащих глюкозу. Рекомендуется исключить из диеты продукты, содержащие сахарозу и лактозу, так как образующиеся из них галактоза и фруктоза после превращения в глюкозо-6-фосфат ведут к дальнейшему накоплению гликогена. Для предотвращения гипогликемии используют метод частого кормления. Этим можно предупредить симптомы гипогликемии.
Гликогеноз I типа наследуется по аутосомнерецессивному типу. Уже в раннем периоде наиболее заметный признак — гепатомегалия. У больных детей короткое туловище, большой живот, увеличены почки. Больные дети отстают в физическом развитии.
Описанное заболевание иногда обозначают как гликогеноз типа Iа, так как существует его разновидность — тип lb. Гликогеноз lb представляет собой редко встречающуюся патологию, которая характеризуется тем, что дефектен фермент транслоказа глюкозо-6- фосфата, обеспечивающий транспорт фосфорилированной глюкозы в ЭР. Поэтому, несмотря на достаточную активность глюкозо-6-фосфатазы, отщепление неорганического фосфата и выход глюкозы в кровь нарушен. Клиническая картина гликогеноза типа lbтакая же, как при гликогенозе Iа.
Болезнь Кори (тип III) весьма распространена. Она составляет 1/4 всех случаев печёночных гликогенозов. Накапливаемый гликоген аномален по структуре, так как дефектен фермент амило-1,6-глюкозидаза, гидролизующий гликозидные связи в местах разветвлений («деветвящий фермент», от англ. debranching enzyme). Недостаток глюкозы в крови проявляется быстро, поскольку гликогенолиз возможен, но в незначительном объёме. В отличие от гликогеноза I типа, лактоацидоз и гиперурикемия не отмечаются. Болезнь отличается более лёгким течением.
Болезнь Андерсен (тип IV) — крайне редкое аутосомно-рецессивное заболевание, возникающее вследствие дефекта ветвящего фермента — амило-1,4-1,6-глюкозилтрансферазы. Содержание гликогена в печени не сильно увеличено, но структура его изменена, и это препятствует его распаду. Молекула гликогена имеет мало точек ветвления, а также очень длинные и редкие боковые ветви. В то же время гипогликемия выражена умеренно. Болезнь развивается быстро, отягощается ранним циррозом печени и практически не поддаётся лечению. Дефект фермента ветвления обнаруживается не только в печени, но также в лейкоцитах, мышцах, фибробластах, но ранние и преобладающие проявления болезни обусловлены нарушением функции печени.
Болезнь Херса (тип VI) также проявляется симптомами, обусловленными поражением печени. Данный гликогеноз — следствие дефекта гликогенфосфорилазы. В гепатоцитах накапливается гликоген нормальной структуры. Течение болезни сходно с гликогенозом I типа, но симптомы выражены в меньшей степени. Сниженная активность гликогенфосфорилазы обнаруживается также в лейкоцитах. Болезнь Херса — редкий тип гликогеноза; наследуется по аутосомно-рецессивному типу.
Дефект киназы фосфорилазы (тип IX) встречается только у мальчиков, так как этот признак сцеплен с Х-хромосомой.
Дефект протеинкиназы А (тип X), так же, как и дефект киназы фосфорилазы, проявляется симптомами, сходными с болезнью Херса.
Мышечные формы гликогенозов характеризуются нарушением в энергоснабжении скелетных мышц. Эти болезни проявляются при физических нагрузках и сопровождаются болями и судорогами в мышцах, слабостью и быстрой утомляемостью.
Болезнь МакАрдла (тип V) — аутосомно-рецессивная патология, при которой полностью отсутствует в скелетных мышцах активность гликогенфосфорилазы. Поскольку активность этого фермента в гепатоцитах нормальная, то гипогликемия не наблюдается (строение фермента в печени и мышцах кодируются разными генами). Тяжёлые физические нагрузки плохо переносятся и могут сопровождаться судорогами, однако при физических нагрузках гиперпродукция лактата не наблюдается, что подчёркивает значение внемышечных источников энергии для сокращения мышц, например, таких как жирные кислоты, замещающие при данной патологии глюкозу (см. раздел 8). Хотя болезнь не сцеплена с полом, большая частота заболевания характерна для мужчин.
Дефект фосфофруктокиназы характерен для гликогеноза VII типа. Больные могут выполнять умеренные физические нагрузки. Течение болезни сходно с гликогенозом V типа, но основные проявления менее выражены.
Дефект фосфоглицеромутазы и дефект М-субъединицы ЛДГ (ненумерованные по классификации Кори, см. табл. 7-3) характерны для мышечных форм гликогенозов. Проявления этих патологий аналогичны болезни МакАрдла. Дефект фосфоглицеромутазы в мышцах описан только у одного больного.
2. Агликогенозы
Агликогеноз (гликогеноз 0 по классификации) — заболевание, возникающее в результате дефекта гликогенсинтазы. В печени и других тканях больных наблюдают очень низкое содержание гликогена. Это проявляется резко выраженной гипогликемией в постабсорбтивном периоде. Характерный симптом — судороги, проявляющиеся особенно по утрам. Болезнь совместима с жизнью, но больные дети нуждаются в частом кормлении.