БИОХИМИЯ УЧЕБНИК ДЛЯ ВУЗОВ - Е. С. Северина - 2004
РАЗДЕЛ 8. ОБМЕН ЛИПИДОВ
III. Транспорт жиров из кишечника хиломикронами
Липиды в водной среде (а значит, и в крови) нерастворимы, поэтому для транспорта липидов кровью в организме образуются комплексы липидов с белками — липопротеины.
А. Общая характеристика липопротеинов
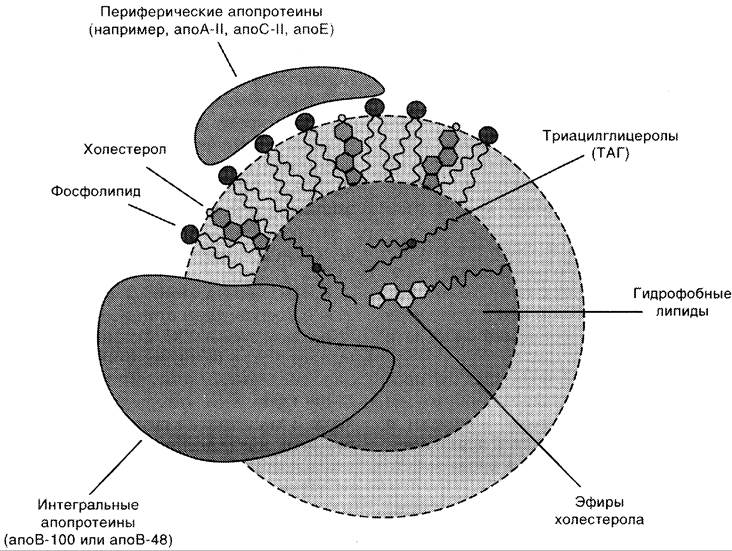
Все типы липопротеинов имеют сходное строение — гидрофобное ядро и гидрофильный слой на поверхности (рис. 8-18). Гидрофильный слой образован белками, которые называют апопротеинами, и амфифильными молекулами липидов — фосфолипидами и холестеролом. Гидрофильные группы этих молекул обращены к водной фазе, а гидрофобные части — к гидрофобному ядру липопротеина, в котором находятся транспортируемые липиды. Некоторые апопротеины интегральные и не могут быть отделены от липопротеина, а другие могут свободно переноситься от одного типа липопротеина к другому. Апопротеины выполняют несколько функций:
✵ формируют структуру липопротеинов;
✵ взаимодействуют с рецепторами на поверхности клеток и таким образом определяют, какими тканями будет захватываться данный тип липопротеинов;
✵ служат ферментами или активаторами ферментов, действующих на липопротеины.
Рис. 8-18. Липопротеины плазмы крови.
В организме синтезируются следующие типы липопротеинов (см. ниже табл. 8-5): хиломикроны (ХМ), липопротеины очень низкой плотности (ЛПОНП), липопротеины промежуточной плотности (ЛППП), липопротеины низкой плотности (ЛПНП) и липопротеины высокой плотности (ЛПВП).
Каждый из типов ЛП образуется в разных тканях и транспортирует определённые липиды. Например, ХМ транспортируют экзогенные (пищевые жиры) из кишечника в ткани, поэтому триацилглицеролы составляют до 85% массы этих частиц.
ЛП хорошо растворимы в крови, не коалесцируют, так как имеют небольшой размер и отрицательный заряд на поверхности. Некоторые ЛП легко проходят через стенки капилляров кровеносных сосудов и доставляют липиды к клеткам.
Большой размер ХМ не позволяет им проникать через стенки капилляров, поэтому из клеток кишечника они сначала попадают в лимфатическую систему и потом через главный грудной проток вливаются в кровь вместе с лимфой.
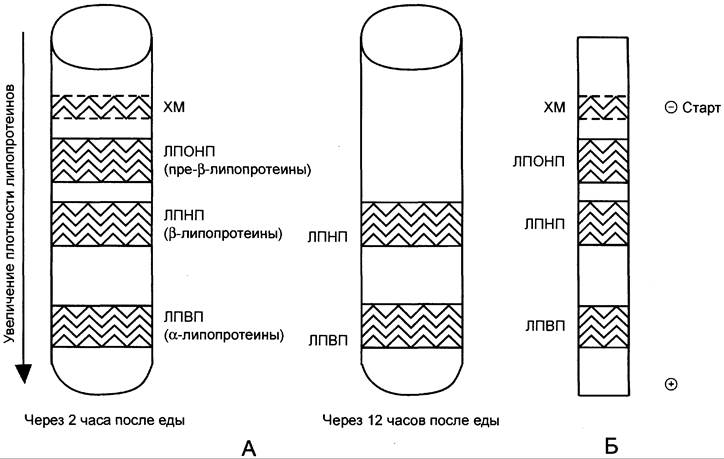
Методы исследования. Состав ЛП крови можно исследовать разными методами (рис. 8-19). Метод ультрацентрифугирования позволяет разделить ЛП, используя их различие в плотности, которая зависит от соотношения количества липидов и белков в частице. Так как жир имеет меньшую, чем вода, плотность, то ХМ, содержащие более 85% жиров, располагаются на поверхности сыворотки крови, а ЛПВП, содержащие наибольшее количество белков, имеют самую большую плотность и при центрифугировании располагаются в нижней части центрифужной пробирки. Так как ЛП впервые были выделены из сыворотки крови методом ультрацентрифугирования, то в названии указывают плотность частиц. Однако метод ультрацентрифугирования непригоден для широкого использования, поэтому в клинических лабораториях обычно применяют метод электрофореза. Скорость движения частиц при электрофорезе зависит от их заряда и размера. Заряд, в свою очередь, зависит от количества белков на поверхности ЛП (табл. 8-5). При электрофорезе в геле все типы ЛП движутся к положительному полюсу; ближе к старту располагаются ХМ, а ЛПВП, имеющие наибольшее количество белков и наименьший размер, удаляются от старта дальше других частиц.
Состав ЛП крови значительно изменяется в течение суток. В абсорбтивный период (особенно при употреблении жирной пищи) в крови появляются ХМ. Богатая углеводами пища способствует образованию ЛПОНП, так как эти ЛП транспортируют жиры, синтезированные в печени из углеводов. В постабсорбтивный период и при голодании в крови присутствуют только ЛПНП и ЛПВП, основная функция которых заключается в транспорте холестерола.
Б. Образование хиломикронов
Жиры, образовавшиеся в результате ресинтеза в клетках слизистой оболочки кишечника, упаковываются в ХМ. Основной апопротеин в составе ХМ — белок апоВ-48. Этот белок закодирован в том же гене, что и белок ЛПОНП — В-100 (табл. 8-5), который синтезируется в печени. В кишечнике в результате посттранскрипционных превращений «считывается» последовательность мРНК, которая кодирует только 48% от длины белка В-100, поэтому этот белок называется апоВ-48. Белок апоВ-48 синтезируется в шероховатом ЭР и там же гликозилируется. Затем в аппарате Гольджи происходит формирование ХМ, называемых «незрелыми». По механизму экзоцитоза они выделяются в хилус, образующийся в лимфатической системе кишечных ворсинок, и через главный грудной лимфатический проток попадают в кровь. В лимфе и крови с ЛПВП на ХМ переносятся апопротеины Е (апоЕ) и С-II (апоС-II); ХМ превращаются в «зрелые». ХМ имеют довольно большой размер, поэтому после приёма жирной пищи они придают плазме крови опалесцирующий, похожий на молоко, вид. ХМ транспортируют жир к различным тканям, где он утилизируется, поэтому концентрация ХМ в крови постепенно снижается, и плазма опять становится прозрачной. ХМ исчезают из крови в течение нескольких часов.
Таблица 8-5. Липопротеины — транспортные формы липидов
Типы липопротеинов |
Хиломикроны (ХМ) |
ЛПОНП |
ЛППП |
ЛПНП |
ЛПВП |
Состав, % Белки |
2 |
10 |
11 |
22 |
50 |
ФЛ |
3 |
18 |
23 |
21 |
27 |
ХС |
2 |
7 |
8 |
8 |
4 |
ЭХС |
3 |
10 |
30 |
42 |
16 |
ТАГ |
85 |
55 |
26 |
7 |
3 |
Функции |
Транспорт липидов из клеток кишечника (экзогенных липидов) |
Транспорт липидов, синтезируемых в печени (эндогенных липидов) |
Промежуточная форма превращения ЛПОНП в ЛПНП под действием фермента ЛП-липазы |
Транспорт холестерола в ткани |
Удаление избытка холестерола из клеток и других липопротеинов. Донор апопротеинов А, С-II |
Место образования |
Эпителий тонкого кишечника |
Клетки печени |
Кровь |
Кровь (из ЛПОНП и ЛППП) |
Клетки печени — ЛПВП-предшественники |
Плотность, г/мл |
0,92-0,98 |
0,96-1,00 |
1,00-1,06 |
1,06-1,21 |
|
Диаметр частиц, нМ |
Больше 120 |
30-100 |
21-100 |
7-15 |
|
Основные аполипопротеины |
В-48 С-II Е |
В-100 С-II Е |
В-100 Е |
В-100 |
А-I С-II Е |
Примечания: ФЛ — фосфолипиды; ХС — холестерол; ЭХС — эфиры холестерола; ТАГ — триацилглицеролы. Функции апопротеинов:
✵В-48 — основной белок ХМ;
✵ В-100 — основной белок ЛПОНП, ЛПНП, ЛППП, взаимодействует с рецепторами ЛПНП;
✵ С-II — активатор ЛП-липазы, переносится с ЛПВП на ХМ и ЛПОНП в крови;
✵ Е — взаимодействует с рецепторами ЛПНП;
✵ А-I — активатор фермента лецитин: холестеролацилтрансферазы (ЛХАТ).
При редком наследственном заболевании — дефекте гена апопротеина В — нарушается синтез белков апоВ-100 в печени и апоВ-48 в кишечнике. В результате в клетках слизистой оболочки кишечника не формируются ХМ, а в печени — ЛПОНП. В клетках этих органов накапливаются капельки жира. Такое заболевание называется абеталипопротеинемия, так как второе название ЛПОНП — пре-β-липопротеины.
Рис. 8-19. Разделение липопротеинов сыворотки крови. А — метод ультрацентрифугирования. Б — метод электрофореза в полиакриламидном геле через 2 ч после еды.
В. Использование экзогенных жиров тканями
Действие липопротеинлипазы на ХМ. В крови триацилглицеролы, входящие в состав зрелых ХМ, гидролизуются ферментом липопротеин-липазой, или ЛГТ-липазой (рис. 8-20). ЛП-липаза связана с гепарансульфатом (гетерополисахаридом), находящимся на поверхности эндотелиальных клеток, выстилающих стенки капилляров кровеносных сосудов. ЛП-липаза гидролизует молекулы жиров до глицерола и 3 молекул жирных кислот. На поверхности ХМ различают 2 фактора, необходимых для активности ЛП-липазы — апоС-II и фосфолипиды. АпоС-II активирует этот фермент, а фосфолипиды участвуют в связывании фермента с поверхностью ХМ.
ЛП-липаза синтезируется в клетках многих тканей: жировой, мышечной, в лёгких, селезёнке, клетках лактирующей молочной железы. Изоферменты ЛП-липазы в разных тканях отличаются по значению Кm: ЛП-липаза жировой ткани имеет в 10 раз более высокое значение Кm, чем, например, ЛП-липаза сердца, поэтому гидролиз жиров ХМ в жировой ткани происходит в абсорбтивный период. Жирные кислоты поступают в адипоциты и используются для синтеза жиров. В постабсорбтивном состоянии, когда количество жиров в крови снижается, ЛП-липаза сердечной мышцы продолжает гидролизовать жиры в составе ЛПОНП, которые присутствуют в крови в небольшом количестве, и жирные кислоты используются этой тканью как источники энергии, даже при низкой концентрации жиров в крови. ЛП-липазы нет в печени, но на поверхности клеток этого органа имеется другой фермент — печёночная липаза, не действующая на зрелые ХМ, но гидролизующая жиры в ЛППП, которые образуются из ЛПОНП.
Судьба жирных кислот, глицерола и остаточных хиломикронов. В результате действия ЛП- липазы на жиры ХМ образуются жирные кислоты и глицерол. Основная масса жирных кислот проникает в ткани (рис. 8-20). В жировой ткани в абсорбтивный период жирные кислоты депонируются в виде триацилглицеролов, в сердечной мышце и работающих скелетных мышцах используются как источник энергии. Другой продукт гидролиза жиров, глицерол, растворим в крови, транспортируется в печень, где в абсорбтивный период может быть использован для синтеза жиров.
Рис. 8-20. Путь экзогенных жиров и хиломикронов. *ЛПЛ — липопротеинлипаза, ЖК — жирные кислоты.
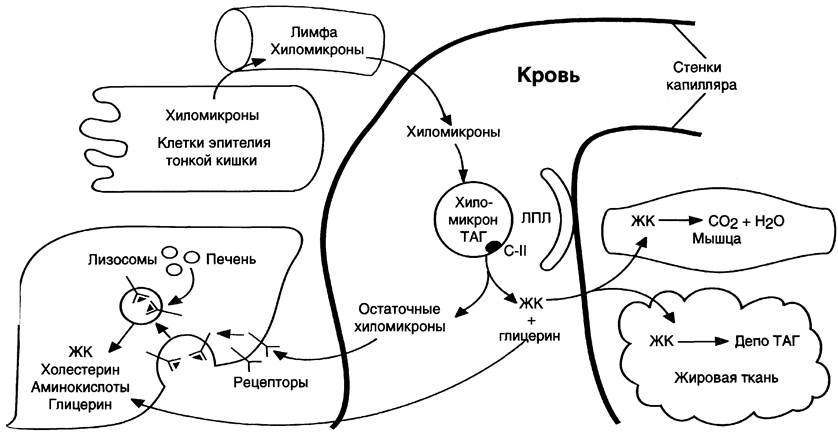
В результате действия ЛП-липазы на ХМ количество жиров в них снижается на 90%, уменьшаются размеры частиц, апопротеин С-Н переносится обратно на ЛПВП. Образовавшиеся частицы называются остаточными ХМ. Они содержат в себе фосфолипиды, холестерол, жирорастворимые витамины и апопротеины В-48 и Е. Остаточные ХМ захватываются гепатоцитами, которые имеют рецепторы, взаимодействующие с этими апопротеинами. Путём эндоци- тоза остаточные ХМ попадают внутрь клеток, и ферментами лизосом белки и липиды гидролизуются, а затем утилизируются. Жирорастворимые витамины и экзогенный холестерол используются в печени или транспортируются в другие ткани.
Гиперхиломикронемия, гипертриглицеролемия. После приёма пищи, содержащей жиры, развивается физиологическая гипертриглицеролемия и, соответственно, гиперхиломикронемия, которая может продолжаться до нескольких часов.
Скорость удаления ХМ из кровотока зависит от:
✵ активности ЛП-липазы;
✵ присутствия ЛПВП, поставляющих апо-протеины С-II и Е для ХМ;
✵ активности переноса апоС-II и апоЕ на ХМ.
Генетические дефекты любого из белков, участвующих в метаболизме ХМ, приводят к развитию семейной гиперхиломикронемии — гиперлипопротеинемии типа I. У таких больных в постабсорбтивном периоде концентрация триацилглицеролов повышена (более 200 мг/дл), плазма крови по виду напоминает молоко и при оставлении на холоде (+4 °С) в ней всплывают белые жирные хлопья, что характерно для гипертригл ицеролемии и гиперхиломикронемии.
В тяжёлых случаях при этом заболевании происходит отложение триацилглицеролов в коже и сухожилиях в виде ксантом, у пациентов рано нарушается память, появляются боли в животе из-за сужения просвета сосудов и уменьшения кровотока, нарушается функция поджелудочной железы, что часто бывает причиной смерти больных. Если концентрация триацилглицеролов в крови превышает 4000 мг/дл, то липиды откладываются в сетчатке глаза, однако это не всегда влияет на зрительную функцию. При лечении гиперхиломикронемий необходимо прежде всего снизить потребление жиров с пищей, так как ХМ транспортируют экзогенные жиры.