БИОХИМИЯ УЧЕБНИК ДЛЯ ВУЗОВ - Е. С. Северина - 2004
РАЗДЕЛ 9. ОБМЕН И ФУНКЦИИ АМИНОКИСЛОТ
V. Обмен аммиака
А. Источники аммиака в клетках
Катаболизм аминокислот в тканях происходит постоянно со скоростью -100 г/сут. При этом в результате дезаминирования аминокислот освобождается большое количество аммиака. Значительно меньшие количества его образуются при дезаминировании биогенных аминов и нуклеотидов. Основные источники аммиака в клетках представлены в табл. 9-3.
Таблица 9-3. Основные источники аммиака
Источник |
Процесс |
Ферменты |
Локализация процесса |
Аминокислоты |
Непрямое дезаминирование (основной путь дезаминирования аминокислот) |
Аминотрансферазы, ПФ Глутаматдегидрогеназа, NАD+ |
Все ткани |
Окислительное дезаминирование глутамата |
Глутаматдегидрогеназа, NАD+ |
Все ткани |
|
Неокислительное дезаминирование Гис, Сер, Тре |
Гистидаза-Серин, треониндегидратазы, ПФ |
Преимущественно печень |
|
Окислительное дезаминирование аминокислот (малозначимый путь дезаминирования) |
Оксидаза L-аминокислот, FМN |
Печень и почки |
|
Биогенные амины |
Окислительное дезаминирование (путь инактивации биогенных аминов) |
Аминооксидазы, FАD |
Все ткани |
АМФ |
Гидролитическое дезаминирование |
АМФ-дезаминаза |
Интенсивно работающая мышца |
Часть аммиака образуется в кишечнике в результате действия бактерий на пищевые белки (гниение белков в кишечнике) и поступает в кровь воротной вены. Концентрация аммиака в крови воротной вены существенно больше, чем в общем кровотоке. В печени задерживается большое количество аммиака, что поддерживает низкое содержание его в крови. Концентрация аммиака в крови в норме редко превышает 0,4 — 0,7 мг/л (или 25 — 40 мкмоль/л). В крови и цитозоле клеток при физиологических значениях pH аммиак переходит в ион аммония — NН4+, количество неионизированного NН3 невелико (~ 1%).
![]()
Аммиак — токсичное соединение. Даже небольшое повышение его концентрации оказывает неблагоприятное действие на организм, и прежде всего на ЦНС. Так, повышение концентрации аммиака в мозге до 0,6 ммоль вызывает судороги. К симптомам гипераммониемии относят тремор, нечленораздельную речь, тошноту, рвоту, головокружение, судорожные припадки, потерю сознания. В тяжёлых случаях развивается кома с летальным исходом.
Механизм токсического действия аммиака на мозг и организм в целом, очевидно, связан с действием его на несколько функциональных систем.
✵ Аммиак легко проникает через мембраны в клетки и в митохондриях сдвигает реакцию, катализируемую глутаматдегидрогеназой, в сторону образования глутамата:
α-Кетоглутарат + NADH + Н+ + NН3 —> Глутамат + NAD+.
Уменьшение концентрации α-кетоглутарата вызывает: угнетение обмена аминокислот (реакции транса- минирования) и, следовательно, синтеза из них нейромедиаторов (ацетилхолина, дофамина и др.); гипоэнергетическое состояние в результате снижения скорости ЦТК.
Недостаточность α-кетоглутарата приводит к снижению концентрации метаболитов ЦТК, что вызывает ускорение реакции синтеза оксалоацетата из пирувата, сопровождающейся интенсивным потреблением СO2. Усиленное образование и потребление диоксида углерода при гипераммониемии особенно характерны для клеток головного мозга.
✵ Повышение концентрации аммиака в крови сдвигает pH в щелочную сторону (вызывает алкалоз). Это, в свою очередь, увеличивает сродство гемоглобина к кислороду, что приводит к гипоксии тканей, накоплению СO2 и гипоэнергетическому состоянию, от которого главным образом страдает головной мозг.
✵ Высокие концентрации аммиака стимулируют синтез глутамина из глутамата в нервной ткани (при участии глутаминсинтетазы):
Глутамат + NН3 + АТФ —> Глутамин + АДФ + Н3РO4.
Накопление глутамина в клетках нейроглии приводит к повышению осмотического давления в них, набуханию астроцитов и в больших концентрациях может вызвать отёк мозга. Снижение концентрации глутамата нарушает обмен аминокислот и нейромедиаторов, в частности синтез y-аминомасляной кислоты (ГАМК), основного тормозного медиатора. При недостатке ГАМК и других медиаторов нарушается проведение нервного импульса, возникают судороги.
✵ Ион NН4+ практически не проникает через цитоплазматические и митохондриальные мембраны. Избыток иона аммония в крови способен нарушать трансмембранный перенос одновалентных катионов Na+ и К+, конкурируя с ними за ионные каналы, что также влияет на проведение нервных импульсов.
Б. Связывание (обезжиривание) аммиака
Высокая интенсивность процессов дезаминирования аминокислот в тканях и очень низкий уровень аммиака в крови свидетельствуют о том, что в клетках активно происходит связывание аммиака с образованием нетоксичных соединений, которые выводятся из организма с мочой. Эти реакции можно считать реакциями обезвреживания аммиака. В разных тканях и органах обнаружено несколько типов таких реакций.
Основной реакцией связывания аммиака, протекающей во всех тканях организма, является синтез глутамина под действием глутамин- синтетазы:
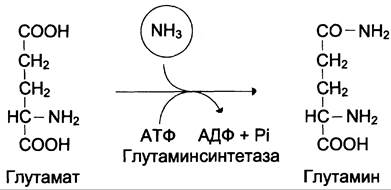
Глутаминсинтетаза локализована в митохондриях клеток, для работы фермента необходим кофактор — ионы Мg2+. Глутаминсинтетаза — один из основных регуляторных ферментов обмена аминокислот и аллостерически ингибируется АМФ, глюкозо-6-фосфатом, а также Гли, Ала и Гис.
Глутамин легко транспортируется через клеточные мембраны путём облегчённой диффузии (для глутамата возможен только активный транспорт) и поступает из тканей в кровь. Основными тканями-поставщиками глутамина служат мышцы, мозг и печень. С током крови глутамин транспортируется в кишечник и почки.
В клетках кишечника под действием фермента глутаминазы происходит гидролитическое освобождение амидного азота в виде аммиака:
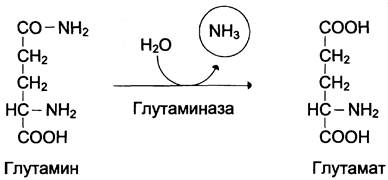
Образовавшийся в реакции глутамат подвергается трансаминированию с пируватом. α-Аминогруппа глутаминовой кислоты переносится в состав аланина (рис. 9-10). Большие количества аланина поступают из кишечника в кровь воротной вены и поглощаются печенью. Около 5% образовавшегося аммиака удаляется в составе фекалий, небольшая часть через воротную вену попадает в печень, остальные ~90% выводятся почками.
Рис. 9-10. Метаболизм азота глутамина в кишечнике.
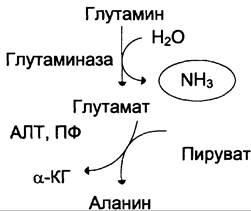
В почках также происходит гидролиз глутамина под действием глутаминазы с образованием аммиака. Этот процесс является одним из механизмов регуляции кислотно-щелочного равновесия в организме и сохранения важнейших катионов для поддержания осмотического давления. Глутаминаза почек значительно индуцируется при ацидозе, образующийся аммиак нейтрализует кислые продукты обмена и в виде аммонийных солей экскретируется с мочой (рис. 9-11). Эта реакция защищает организм от излишней потери ионов Na+ и К+, которые также могут использоваться для выведения анионов и утрачиваться. При алкалозе количество глутаминазы в почках снижается.
Рис. 9-11. Метаболизм амидного азота глутамина в почках.
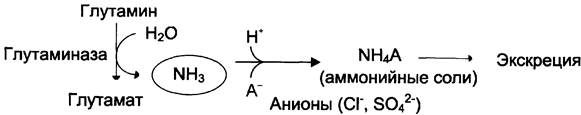
В почках образуется и выводится около 0,5 г солей аммония в сутки.
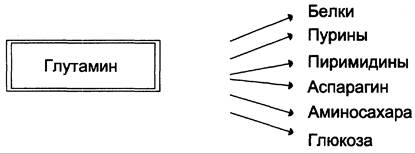
Высокий уровень глутамина в крови и лёгкость его поступления в клетки обусловливают использование глутамина во многих анаболических процессах. Глутамин —основной донор азота в организме. Амидный азот глутамина используется для синтеза пуриновых и пиримидиновых нуклеотидов, аспарагина, аминосахаров и других соединений (рис. 9-12).
Рис. 9-12. Пути использования глутамина в организме.
Ещё одной реакцией обезвреживания аммиака в тканях можно считать синтез аспарагина под действием аспарагинсинтетазы.
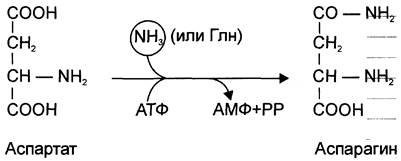
Существуют 2 изоформы этого фермента — глутаминзависимая и аммиакзависимая, которые используют разные доноры амидных групп. Первая функционирует в животных клетках, вторая преобладает в бактериальных клетках, но присутствует и у животных. Однако такой путь обезвреживания аммиака в клетках человека используется редко и к тому же требует больших энергетических затрат (энергию двух макроэргических связей), чем синтез глутамина.
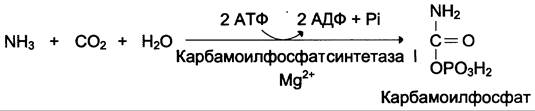
Наиболее значительные количества аммиака обезвреживаются в печени путём синтеза мочевины. В первой реакции процесса аммиак связывается с диоксидом углерода с образованием карбамоилфосфата, при этом затрачиваются 2 молекулы АТФ. Реакция происходит в митохондриях гепатоцитов под действием фермента карбамоилфосфатсинтетазы I. Карбамоилфосфатсинтетаза II локализована в цитозоле клеток всех тканей и участвует в синтезе пиримидиновых нуклеотидов (см. раздел 10). Карбамоилфосфат затем включается в орнитиновый цикл и используется для синтеза мочевины.
В мозге и некоторых других органах может протекать восстановительное аминирование α-кетоглутарата под действием глутаматдегидрогеназы, катализирующей обратимую реакцию. Однако этот путь обезвреживания аммиака в тканях используется слабо, так как глутаматдегидрогеназа катализирует преимущественно реакцию дезаминирования глутамата. Хотя, если учитывать последующее образование глутамина, реакция выгодна для клеток, так как способствует связыванию сразу 2 молекул NH3.
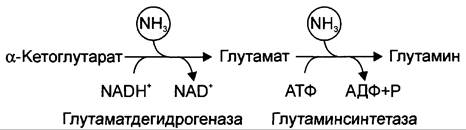
Из мышц и кишечника избыток аммиака выводится преимущественно в виде аланина. Этот механизм необходим, так как активность глутаматдегидрогеназы в мышцах невелика и непрямое дезаминирование аминокислот малоэффективно. Поэтому в мышцах существует ещё один путь выведения азота. Образование аланина в этих органах можно представить следующей схемой (см. схему ниже).
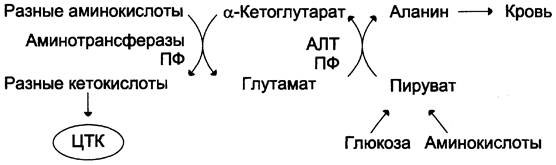
Аминогруппы разных аминокислот посредством реакций трансаминирования переносятся на пируват, основным источником которого служит процесс окисления глюкозы.
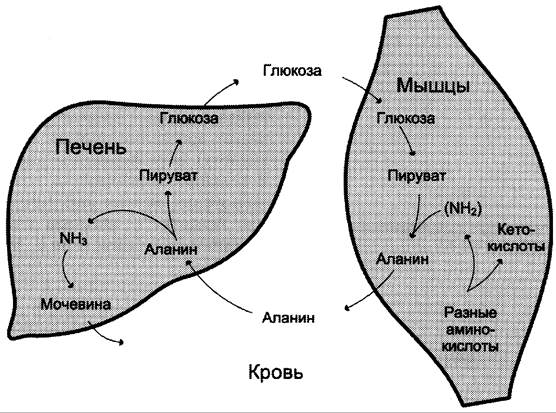
Мышцы выделяют особенно много аланина в силу их большой массы, активного потребления глюкозы при физической работе, а также потому, что часть энергии они получают за счёт распада аминокислот. Образовавшийся аланин поступает в печень, где подвергается непрямому дезаминированию. Выделившийся аммиак обезвреживается, а пируват включается в глюконеогенез. Глюкоза из печени поступает в ткани и там, в процессе гликолиза, опять окисляется до пирувата (рис. 9-13).
Образование аланина в мышцах, его перенос в печень и перенос глюкозы, синтезированной в печени, обратно в мышцы составляют глюкозо- аланиновый цикл, работа которого сопряжена с работой глюкозо-лактатного цикла (см. раздел 7).
Рис. 9-13. Глюкозо-аланиновый цикл.
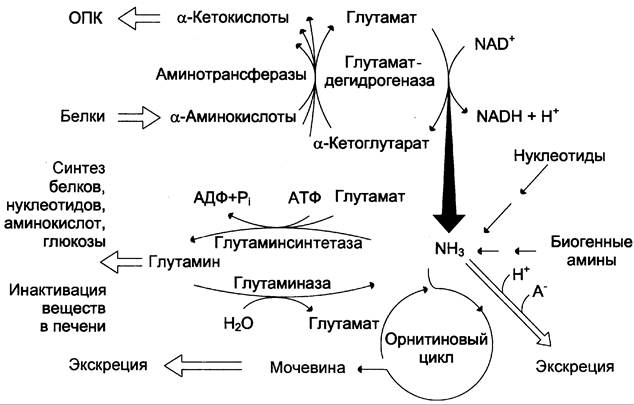
Совокупность основных процессов обмена аммиака в организме представлена на рис. 9-14. Доминирующими ферментами в обмене аммиака служат глутаматдегидрогеназа и глутаминсинтетаза.
Рис. 9-14. Обмен аммиака. Основной источник аммиака — аминокислоты. Большая часть образовавшегося аммиака обезвреживается в орнитиновом цикле в печени и выделяется в виде мочевины. Основной реакцией обезвреживания аммиака в тканях является синтез глутамина, который затем используется в анаболических процессах и для обезвреживания веществ в печени. Ферменты глутаматдегидрогеназа и глутаминсинтетаза являются регуляторными и обусловливают скорость процессов образования и обезвреживания аммиака.
В. Орнитиновый цикл
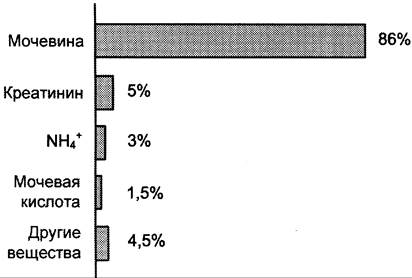
Мочевина — основной конечный продукт азотистого обмена, в составе которого из организма выделяется до 90% всего выводимого азота (рис. 9-15). Экскреция мочевины в норме составляет ~25 г/сут.
Рис. 9-15. Количество азотсодержащих веществ в моче (%) при нормальном белковом питании.
При повышении количества потребляемых с пищей белков экскреция мочевины увеличивается. Мочевина синтезируется только в печени, что было установлено ещё в опытах И. П. Павлова. Поражение печени и нарушение синтеза мочевины приводят к повышению содержания в крови и тканях аммиака и аминокислот (в первую очередь, глутамина и аланина).
В 40-х годах XX века немецкие биохимики Г. Кребс и К. Гензелейт установили, что синтез мочевины представляет собой циклический процесс, состоящий из нескольких стадий, ключевым соединением которого, замыкающим цикл, является орнитин. Поэтому процесс синтеза мочевины получил название «орнитиновый цикл», или «цикл Кребса—Гензелейта».
1. Реакции синтеза мочевины
Мочевина (карбамид) — полный амид угольной кислоты — содержит 2 атома азота.
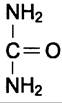
Источником одного из них является аммиак, который в печени связывается с диоксидом углерода с образованием карбамоилфосфата под действием карбамоилфосфатсинтетазы I (см. схему А).
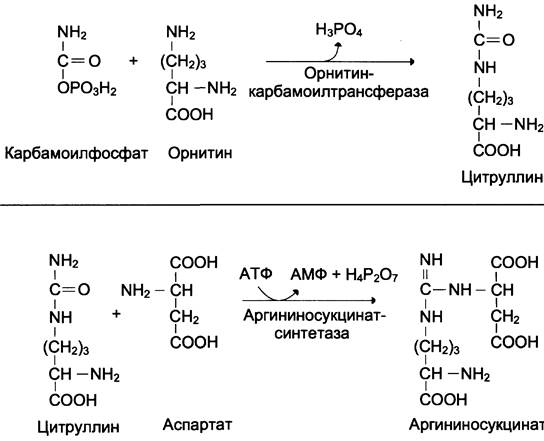
Далее под действием орнитин-карбамоил- трансферазы карбамоильная группа карбамоилфосфата переносится на α-аминокислоту орнитин, и образуется другая α-аминокислота — цитруллин (см. схему Б).
В следующей реакции аргининосукцинатсин- тетаза связывает цитруллин с аспартатом и образует аргининосукцинат (аргининоянтарную кислоту). Этот фермент нуждается в ионах Мg2+. В реакции затрачивается 1 моль АТФ, но используется энергия двух макроэргических связей. Аспартат — источник второго атома азота мочевины (см. схему А).
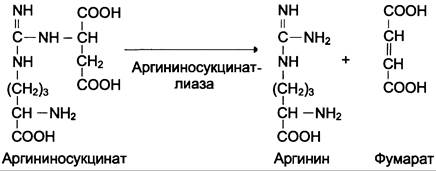
Далее фермент аргининосукцинатлиаза (аргининосукциназа) расщепляет аргининосукцинат на аргинин и фумарат, при этом аминогруппа аспартата оказывается в молекуле аргинина (см. схему Б ниже).
Аргинин подвергается гидролизу под действием аргиназы, при этом образуются орнитин и мочевина. Кофакторами аргиназы являются ионы Са2+ или Мn2+. Высокие концентрации орнитина и лизина, являющихся структурными аналогами аргинина, подавляют активность этого фермента:
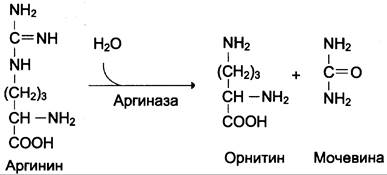
Образующийся орнитин взаимодействует с новой молекулой карбамоилфосфата, и цикл замыкается.
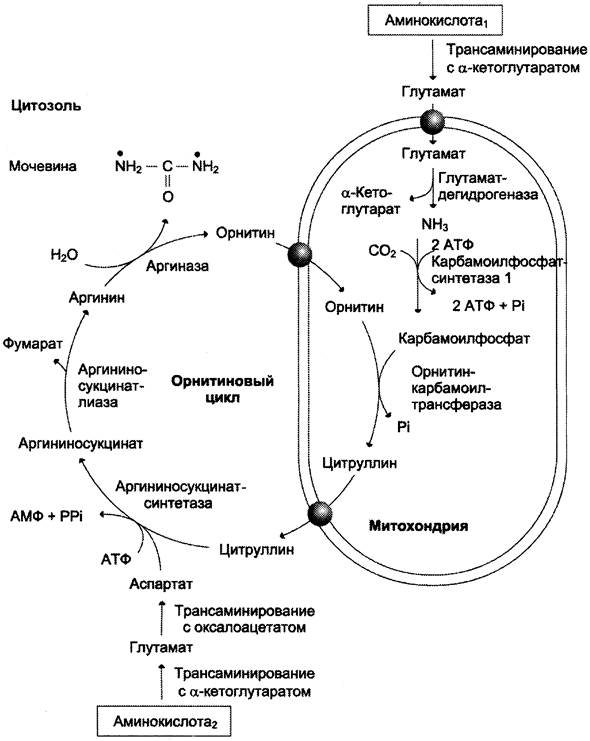
Первые две реакции процесса происходят в митохондриях гепатоцитов. Затем цитруллин, являющийся продуктом этих реакций, транспортируется в цитозоль, где и осуществляются дальнейшие превращения (рис. 9-16).
Рис. 9-16. Орнитиновый цикл Кребса-Гензелейта. Окислительное дезаминирование глутамата происходит в митохондриях. Ферменты орнитинового цикла распределены между митохондриями и цитозолем. Поэтому необходим трансмембранный перенос глутамата, цитруллина и орнитина с помощью специфических транслоказ. На схеме показаны пути включения азота двух разных аминокислот (аминокислота 1 и аминокислота 2) в молекулу мочевины: • одна аминогруппа — в виде аммиака в матриксе митохондрии; • вторую аминогруппу поставляет аспартат цитозоля.
Суммарное уравнение синтеза мочевины:
СO2 + NH3 + Аспартат + 3 АТФ + 2 Н2O —> Мочевина + Фумарат + 2 (АДФ + Н3РO4) + АМФ + Н4Р2O7.
Аммиак, используемый карбамоилфосфатсинтетазой I, поставляется в печень с кровью воротной вены. Роль других источников, в том числе окислительного дезаминирования глутаминовой кислоты в печени, существенно меньше.
Аспартат, необходимый для синтеза аргининосукцината, образуется в печени путём транс-аминирования аланина с оксалоацетатом. Аланин поступает главным образом из мышц и клеток кишечника. Источником оксалоацетата, необходимого для этой реакции, можно считать превращение фумарата, образующегося в реакциях орнитинового цикла. Фумарат в результате двух реакций цитратного цикла превращается в оксалоацетат, из которого путём трансаминирования образуется аспартат (рис. 9-17). Таким образом, с орнитиновым циклом сопряжён цикл регенерации аспартата из фумарата. Пируват, образующийся в этом цикле из аланина, используется для глюконеогенеза.
Рис. 9-17. Цикл регенерации аспартата, сопряжённый с орнитиновым циклом.
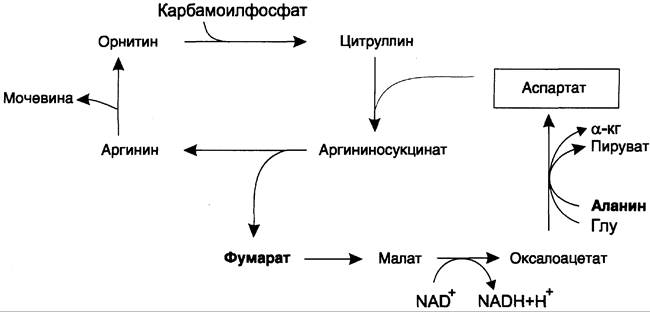
Ещё одним источником аспартата для орнитинового цикла является трансаминирование глутамата с оксалоацетатом.
2. Энергетический баланс процесса
В реакциях орнитинового цикла расходуются четыре макроэргических связи трёх молекул АТФ на каждый оборот цикла. Однако процесс превращения аминокислот в безазотистые остатки и мочевину имеет пути компенсации энергозатрат:
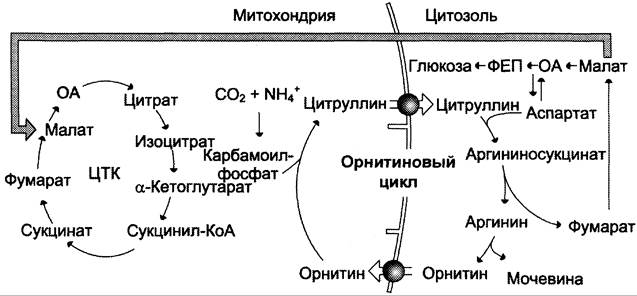
✵ при включении фумарата в ЦТК на стадии дегидрирования малата образуется NАDН, который обеспечивает синтез 3 молекул АТФ (рис. 9-18);
✵ при окислительном дезаминировании глутамата в разных органах также образуется NАDН, соответственно — ещё 3 молекулы АТФ.
Затраты энергии происходят также и при трансмембранном переносе веществ, связанном с синтезом и экскрецией мочевины (рис. 9-18). Первые две реакции орнитинового цикла происходят в митохондриях, а последующие три — в цитозоле. Цитруллин, образующийся в митохондрии, должен быть перенесён в цитозоль, а орнитин, образующийся в цитозоле, необходимо транспортировать в митохондрию. Кроме того, в почках перенос мочевины из крови в мочу происходит путём активного транспорта за счёт градиента ионов натрия, создаваемого К+, Na+-АТФ-азой, что тоже сопряжено с энергозатратами.
Рис. 9-18. Взаимосвязь орнитинового цикла и общего пути катаболизма. Фумарат, образующийся в результате расщепления аргининосукцината, превращается в малат, который затем переносится в митохондрии, включается в ЦТК и дегидрируется с образованием оксалоацетата. Эта реакция сопровождается выделением 3 молекул АТФ, которые и компенсируют затраты энергии на синтез одной молекулы мочевины.
Полный набор ферментов орнитинового цикла есть только в гепатоцитах. Отдельные же ферменты орнитинового цикла обнаруживаются не только в печени, но и в других клетках. В энтероцитах, например, имеется карбамоилфосфат- синтетаза I и орнитинкарбамоилтрансфераза, следовательно, может синтезироваться цитрул
лин. В почках обнаружены аргининосукцинат- синтетаза и аргининосукцинатлиаза. Цитруллин, образовавшийся в энтероцитах, может поступать в почки и превращаться там в аргинин, который переносится в печень и гидролизуется аргиназой. Активность этих рассеянных по разным органам ферментов значительно ниже, чем в печени.
3. Биологическая роль орнитинового цикла Кребса—Гензелейта
Орнитиновый цикл в печени выполняет 2 функции:
✵ превращение азота аминокислот в мочевину, которая экскретируется и предотвращает накопление токсичных продуктов, главным образом аммиака;
✵ синтез аргинина и пополнение его фонда в организме.
Регуляторные стадии процесса — синтез карбамоилфосфата, синтез цитруллина и заключительная стадия, катализируемая аргиназой. Эффективность работы орнитинового цикла при нормальном питании человека и умеренных физических нагрузках составляет примерно 60% его мощности. Запас мощности необходим для избежания гипераммониемии при изменениях количества белка в пище. Увеличение скорости синтеза мочевины происходит при длительной физической работе или длительном голодании, которое сопровождается распадом тканевых белков. Некоторые патологические состояния, характеризующиеся интенсивным распадом белков тканей (сахарный диабет и др.), также сопровождаются активацией орнитинового цикла.
При избыточном белковом питании количество ферментов орнитинового цикла в печени увеличивается, что приводит к интенсификации синтеза мочевины.
4. Типераммониемия
Нарушение реакций обезвреживания аммиака может вызвать повышение содержания аммиака в крови — гипераммониемию, что оказывает токсическое действие на организм. Причинами гипераммониемии могут выступать как генетический дефект ферментов орнитинового цикла в печени, так и вторичное поражение печени в результате цирроза, гепатита и других заболеваний. Известны пять наследственных заболеваний, обусловленных дефектом пяти ферментов орнитинового цйкла (табл. 9-4).
Таблица 9-4. Наследственные нарушения орнитинового цикла и основные их проявления
Заболевание |
Дефект фермента |
Тип наследования |
Клинические проявления |
Метаболиты |
|
кровь |
моча |
||||
Гипераммониемия, тип I |
Карбамоил- фосфат- синтетаза I |
Аутосомно-рецессивный |
В течение 24-48 ч после рождения кома, смерть |
Глн Ала NH3 |
Оротат |
Гипераммониемия, тип II |
Орнитин-карбамоил- трансфераза |
Сцепленный с Х-хромосомой |
Гипотония, снижение толерантности к белкам |
Глн Ала NH3 |
Оротат |
Цитруллинемия |
Аргинино-сукцинат-синтетаза |
Аутосомно-рецессивный |
Гипераммониемия тяжёлая у новорождённых. У взрослых — после белковой нагрузки |
Цитруллин NH3 |
Цитруллин |
Аргинино- сукцинатурия |
Аргинино-сукцинат-лиаза |
Аутосомно-рецессивный |
Гипераммониемия, атаксия, судороги, выпадение волос |
Аргининосукцинат NH3 |
Аргининосукцинат, Глн, Ала, Лиз |
Гипераргининемия |
Аргиназа |
Аутосомно-рецессивный |
Гипераргининемия |
Apr NH3 |
Apг Лиз Орнитин |
В литературе описаны случаи всех этих довольно редких энзимопатий, среди которых отмечено больше всего случаев гипераммониемии II типа.
Нарушение орнитинового цикла наблюдается при гепатитах различной этиологии и некоторых других вирусных заболеваниях. Например, установлено, что вирусы гриппа и других острых респираторных вирусных инфекций снижают активность карбамоилфосфатсинтетазы I. При циррозе и других заболеваниях печени также часто наблюдают гипераммониемию.
Снижение активности какого-либо фермента синтеза мочевины приводит к накоплению в крови субстрата данного фермента и его предшественников. Так, при дефекте аргининосукцинатсинтетазы повышается содержание цитруллина (цитруллинемия); при дефекте аргиназы — концентрация аргинина, аргининосукцината, цитруллина и т. д. При гипераммониемиях I и II типа вследствие дефекта орнитинкарбамоилтрансферазы происходит накопление карбамоилфосфата в митохондриях и выход его в цитозоль. Это вызывает увеличение скорости синтеза пиримидиновых нуклеотидов (вследствие активации карбамоилфосфатсинтетазы II), что приводит к накоплению оротата, уридина и урацила и выведению их с мочой. Содержание всех метаболитов повышается, и состояние больных ухудшается при увеличении количества белков в пище. Тяжесть течения заболевания зависит также от степени снижения активности ферментов.
Все нарушения орнитинового цикла приводят к значительному повышению в крови концентрации аммиака, глутамина и аланина.
Гипераммониемия сопровождается появлением следующих симптомов:
✵ тошнота, повторяющаяся рвота;
✵ головокружение, судороги;
✵ потеря сознания, отёк мозга (в тяжёлых случаях);
✵ отставание умственного развития (при хронической врождённой форме).
Все симптомы гипераммониемии — проявление действия аммиака на ЦНС (см. выше подраздел IV, Б).
Для диагностики различных типов гипераммониемии производят определение содержания аммиака в крови, метаболитов орнитинового цикла в крови и моче, активности фермента в биоптатах печени.
Основной диагностический признак — повышение концентрации аммиака в крови. Содержание аммиака в крови может достигать 6000 мкмоль/л (в норме — 60 мкмоль/л). Однако в большинстве хронических случаев уровень аммиака может повышаться только после белковой нагрузки или в течение острых осложнённых заболеваний.
Лечение больных с различными дефектами орнитинового цикла в основном направлено на снижение концентрации аммиака в крови за счёт малобелковой диеты, введения кетоаналогов аминокислот в рацион и стимуляцию выведения аммиака в обход нарушенных реакций:
✵ путём связывания и выведения NН3 в составе фенилацетилглутамина и гиппуровой кислоты;
✵ повышением концентрации промежуточных метаболитов цикла (аргинина, цитруллина, глутамата), образующихся вне блокируемых реакций (рис. 9-19).
Рис. 9-19. Пути выведения аммиака при включении в диету глутамата и фенилацетата (А), бензоата (Б), цитруллина и аргинина (В). На рисунке обозначены ферментные блоки: 1 — дефект карбамоилфосфатсинтетазы I; 2 — дефект орнитинкарбамоилтрансферазы; 3 — дефект аргининосукцинатлиазы.
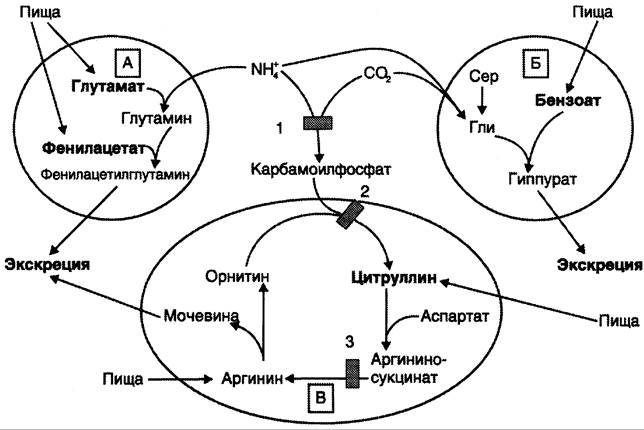
Вводимый больным с дефектом карбамоил- фосфатсинтетазы I в качестве пищевой добавки фенилацетат в результате его конъюгации с глутамином образует фенилацетилглутамин, который экскретируется почками. Состояние больных при этом улучшается, так как происходит активация синтеза глутамина и снижение концентрации аммиака в крови (рис. 9-19, А).
Аналогичное действие оказывает введение бензоата, который связывает молекулу глицина. Образующаяся гиппуровая кислота выводится с мочой (рис. 9-19, Б). В составе гиппурата происходит выделение азота из организма. Недостаток глицина компенсируется либо путём синтеза его из серина, либо за счёт образования из NH3 и СO2 в реакции, катализируемой глицинсинтетазой. При этом образование глицина сопровождается связыванием одной молекулы аммиака.
При гипераммониемии II типа (дефект орнитинкарбамоилтрансферазы) введение больших доз цитруллина стимулирует синтез мочевины из аспартата (рис. 9-19, В), что также приводит к выведению азота из организма. Введение больших доз аргинина при аргининосукцинатурии (дефект аргининосукцинатлиазы) стимулирует регенерацию орнитина и выведение азота в составе цитруллина и аргининосукцината.
Г. Обмен аммиака и аминокислот между органами и тканями
В катаболизме аминокислот и образовании аммиака участвуют многие ткани. В клетках происходит связывание аммиака. Из организма азот выводится почками в виде двух конечных продуктов азотистого обмена — аммонийных солей (~0,5 г/сут), которые образуются в почках, и мочевины (~25 г/сут), которая содержит до 90% выводимого азота. Синтез мочевины происходит в печени в орнитиновом цикле, причём на образование 1 моля мочевины используется 1 моль аммиака и 1 моль аспарагиновой кислоты. Таким образом, для синтеза 25 г мочевины в сутки затрачивается 6,3 г аммиака и 50 г аспартата. Для доставки азота в печень должны интенсивно функционировать специальные механизмы.
Транспорт азота из тканей в печень происходит, в основном, в составе 3 соединений: глутамина, аланина, аммиака (небольшое количество в несвязанном виде).
Кроме глутамина и аланина, в крови присутствуют и другие свободные аминокислоты, причём содержание их и направление транспорта зависят от приёма пищи и использования эндогенных белков. Наибольшее количество свободных аминокислот поступает из мышц и кишечника, причём до 50% составляют аланин и глутамин. Существует направленный поток аминокислот из этих тканей в печень, который усиливается в абсорбтивный период при белковом питании.
Основное количество глутамина поставляют в кровь мышцы и мозг. Из кровеносного русла его поглощают печень и почки, где он подвергается действию глутаминазы. Почки —основной источник серина и частично аланина, которые сорбируются из плазмы печенью. Головной мозг, в отличие от всех других тканей, способен поглощать и окислять большие количества аминокислот с разветвлённой боковой цепью (валин, лейцин, изолейцин).
После приёма пищи из кишечника в плазму крови поступает много аминокислот, причём преобладают аминокислоты с разветвлённой боковой цепью (до 20% от общего количества), которые затем поглощаются, в основном, печенью, мышцами и мозгом (рис. 9-20). В мышцах происходит усиленный катаболизм этих аминокислот, причём они выступают основными донорами аминогруппы в синтезе аланина из пирувата (см. выше «глюкозо-аланиновый цикл»).
Рис. 9-20. Обмен аминокислот между тканями и органами в абсорбтивном периоде. В абсорбтивный период основным источником свободных аминокислот служит кишечник. Большую часть поступивших аминокислот составляют гидрофобные аминокислоты с разветвлённой цепью. Экзогенные полярные аминокислоты из воротной вены сорбируются и используются в основном печенью. Разветвлённые аминокислоты поглощаются из кровотока клетками мозга или мышц.
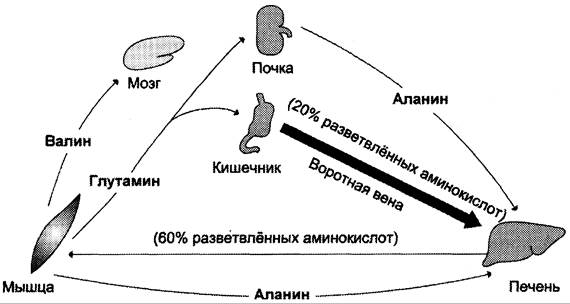
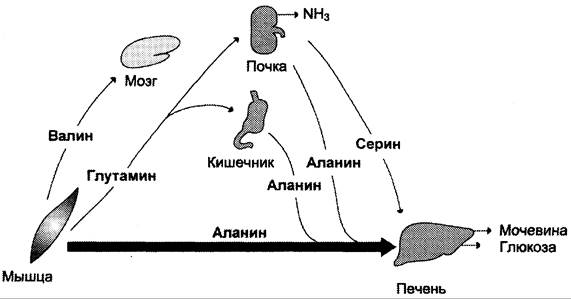
В постабсорбтивном периоде основными источниками свободных аминокислот служат мышцы. Они поставляют в основном аланин и глутамин (рис. 9-21). Аланин поглощается печенью, глутамин — кишечником и почками. В кишечнике азот глутамина переносится в аланин или серин и в их составе транспортируется в печень, где активируется процесс глюконеогенеза. Интенсивность глюконеогенеза из этих аминокислот намного выше, чем из всех других. Таким образом, аланин и серин — основные гликогенные аминокислоты. Аминокислоты с разветвлённой боковой цепью (валин, лейцин, изолейцин и др.), которые освобождаются из мышц, направляются в мозг, где окисляются и служат важным источником энергии.
Рис. 9-21. Обмен аминокислот между тканями и органами в постабсорбтивном периоде. В постабсорбтивный период свободные аминокислоты поступают преимущественно из мышц, в которых усиливается катаболизм белков. Аминокислоты используются в глюконеогенезе в печени. В крови повышен уровень аланина, серина и глутамина.