БИОХИМИЯ УЧЕБНИК ДЛЯ ВУЗОВ - Е. С. Северина - 2004
РАЗДЕЛ 9. ОБМЕН И ФУНКЦИИ АМИНОКИСЛОТ
IX. Азотсодержащие соединения — производные аминокслот
Большую роль в организме человека играют непептидные азотсодержащие соединения — производные аминокислот. К ним можно отнести гормоны надпочечников (норадреналин, адреналин), щитовидной железы (тироксин, трийодтиронин), а также медиаторы ЦНС (ацетилхолин, ГАМК и др.), медиатор воспаления (гистамин) и другие соединения.
А. Декарбоксилирование аминокислот и их производных
Некоторые аминокислоты и их производные могут подвергаться декарбоксилированию — отщеплению α-карбоксидьной группы. В тканях млекопитающих декарбоксилированию может подвергаться целый ряд аминокислот или их производных: Три, Тир, Вал, Тис, Глу, Цис, Apг, Орнитин, SAM, ДОФА, 5-окситриптофан и др. Продуктами реакции являются СО2 и амины, которые оказывают выраженное биологическое действие на организм (биогенные амины):
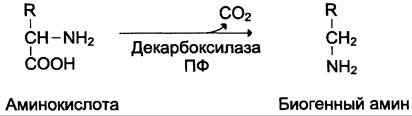
Реакции декарбоксилирования необратимы и катализируются ферментами декарбоксилазами. Простетическая группа декарбоксилаз в клетках животных — пиридоксальфосфат. Некоторые декарбоксилазы микроорганизмов могут содержать вместо ПФ остаток пирувата — гистидиндекарбоксилаза Micrococcus и Lactobacilus, SAM-декарбоксилаза Е. coli и др. Механизм реакции напоминает реакцию трансаминирования с участием пиридоксальфосфата и также осуществляется путём формирования шиффова основания ПФ и аминокислоты на первой стадии.
Амины, образовавшиеся при декарбоксилиро- вании аминокислот, часто являются биологически активными веществами. Они выполняют функцию нейромедиаторов (серотонин, дофамин, ГАМК и др.), гормонов (норадреналин, адреналин), регуляторных факторов местного действия (гистамин, карнозин, спермин и др.).
1. Синтез и биологическая роль серотонина
Серотонин — нейромедиатор проводящих путей. Образуется в надпочечниках и ЦНС из аминокислоты 5-гидрокситриптофана в результате действия декарбоксилазы ароматических аминокислот. Этот фермент обладает широкой специфичностью и способен также декарбоксилировать триптофан и ДОФА, образующийся из тирозина. 5-Гидрокситриптофан синтезируется из триптофана под действием фенилаланингидроксилазы с коферментом Н4БП (этот фермент обладает специфичностью к ароматическим аминокислотам и гидроксилирует также фенилаланин) (см. схему ниже).
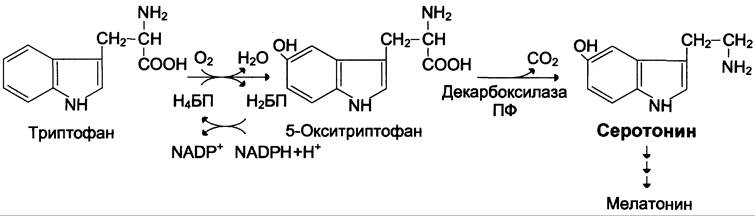
Серотонин может превращаться в гормон мелатонин, регулирующий суточные и сезонные изменения метаболизма организма и участвующий в регуляции репродуктивной функции.
Серотонин — биологически активное вещество широкого спектра действия. Он стимулирует сокращение гладкой мускулатуры, оказывает сосудосуживающий эффект, регулирует АД, температуру тела, дыхание, обладает антидепрессантным действием. По некоторым данным он может принимать участие в аллергических
реакциях, поскольку в небольших количествах синтезируется в тучных клетках.
2. Синтез и биологическая роль ацетилхолина
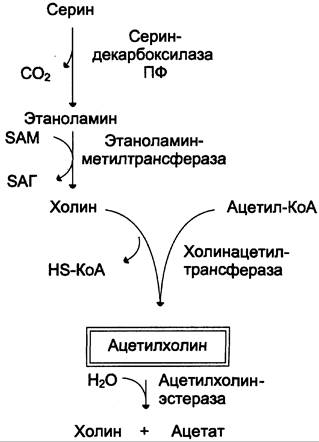
Ацетилхолин синтезируется в нервной ткани и служит одним из важнейших возбуждающих нейромедиаторов вегетативной нервной системы. Его предшественник — аминокислота серин:
3. Синтез и биологическая роль y-аминомасляной кислоты
В нервных клетках декарбоксилирование глутамата (отщепление α-карбоксильной группы) приводит к образованию y-аминомасляной кислоты (ГАМК), которая служит основным тормозным медиатором высших отделов мозга (см. схему).
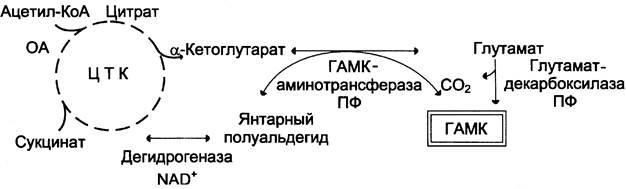
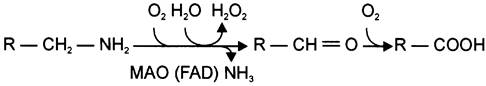
Цикл превращений ГАМК в мозге включает три сопряжённые реакции, получившие название ГАМК-шунта. Первую катализирует глутаматдекарбоксилаза, которая является пиридоксальзависимым ферментом. Эта реакция является регуляторной и обусловливает скорость образования ГАМК в клетках мозга. Продукт реакции — ГАМК. Последующие 2 реакции можно считать реакциями катаболизма ГАМК. ГАМК-аминотрансфераза, также пиридоксальзависимая, образует янтарный полуальдегид, который затем подвергается дегидрированию и превращается в янтарную кислоту. Сукцинат используется в цитратном цикле. Инактивация ГАМК возможна и окислительным путём под действием МАО.
Содержание ГАМК в головном мозге в десятки раз выше других нейромедиаторов. Она увеличивает проницаемость постсинаптических мембран для ионов К+, что вызывает торможение нервного импульса; повышает дыхательную активность нервной ткани; улучшает кровоснабжение головного мозга.
ГАМК в виде препаратов гаммалон или аминалон применяют при сосудистых заболеваниях головного мозга (атеросклероз, гипертония), нарушениях мозгового кровообращения, умственной отсталости, эндогенных депрессиях и травмах головного мозга, а также заболеваниях ЦНС, связанных с резким возбуждением коры мозга (например, эпилепсии).
4. Другие медиаторы ЦНС: глицин, глутамат
Свободные аминокислоты играют исключительно важную роль в головном мозге как предшественники белков и таких биологически активных веществ, как нейропептиды, гормоны, биогенные амины и др. Некоторые аминокислоты могут участвовать в синаптической передаче, выполняя функцию нейромедиаторов. Очень
важна для головного мозга и энергетическая роль аминокислот. Содержание свободных аминокислот в головном мозге достигает ~35 мкмоль/г ткани, что значительно выше, чем в плазме крови (-3,5 мкмоль/л) и в спинномозговой жидкости. Преобладают глутаминовая кислота, глутамин, аспарагиновая кислота, глицин, ГАМК, N-ацетиласпартат и др. Аминокислоты глицин и глутамат — важнейшие нейромедиаторы.
Глутамат содержится в головном мозге в очень больших количествах (до ~10 мкмоль/г ткани) и выполняет разнообразные функции:
✵ один из основных возбуждающих медиаторов в коре, гиппокампе, полосатом теле и гипоталамусе;
✵ участвует в регуляции процессов памяти;
✵ составная часть ряда малых и средних регуляторных пептидов мозга, таких как глутатион. В виде пироглутамата (циклическая форма) входит в целый ряд нейропептидов — люлиберин, тиролиберин, нейротензин, бомбезин и др.
✵ велика его энергетическая роль, так как глутамат служит поставщиком α-кетоглутарата — компонента цитратного цикла;
✵ участвует в обезвреживании аммиака с образованием глутамина, который в больших количествах поступает через мембраны в нейроны, где присутствует фермент глутаминаза. Под действием этого фермента вновь образуется глутамат, который используется для синтеза ГАМК. Учитывая, что биомембраны менее проницаемы для глутамата, чем для глутамина, его можно расценивать как глиально-нейрональный переносчик глутамата (а значит, и ГАМК).
Нарушение глутаматергической системы происходит при целом ряде патологических нарушений ЦНС: эпилепсии, расстройствах вестибулярной системы, ишемии и др. Глутамат и его аналоги используют как лекарственные средства при хронической недостаточности аминокислотного обмена, вегетососудистой дистонии, эпилепсии (в качестве предшественника ГАМК — тормозного медиатора).
Другая аминокислота-нейромедиатор — глицин. Концентрация глицина в плазме крови невысока, поэтому в мозг поступают недостаточные количества этой аминокислоты. Значительная часть глицина синтезируется из глюкозы, которая поступает из крови (реакции синтеза рассмотрены выше).
Глицин — важнейший (после ГАМК) тормозной нейромедиатор в спинном мозге, промежуточном мозге и некоторых отделах головного мозга. Высокий уровень глицина в плазме крови и моче обычно свидетельствует о нарушении функций мозга.
Разрушение глицина может происходить тремя путями:
✵ превращением глицина в серин под действием сериноксиметилтрансферазы;
✵ расщеплением глицина на аммиак, оксид углерода и метилен-Н4-фолат;
✵ окислением под действием оксидазы аминокислот (см. выше подраздел IV).
Гиперглицинемия развивается в раннем возрасте и сопровождается эпизодической рвотой, подавлением двигательной активности, нарушением электроэнцефалограммы и часто завершается летальным исходом. Гиперглицинемия может быть следствием нарушения обычных путей разрушения глицина в нервных клетках.
Б. Азотсодержащие соединения — производные гистидина
Аминокислота гистидин в разных тканях подвергается действию различных ферментов и включается в два разных метаболических пути:
✵ катаболизм до конечных продуктов;
✵ синтез гистамина (рис. 9-31).
Рис. 9-31. Схема обмена гистидина в разных тканях.
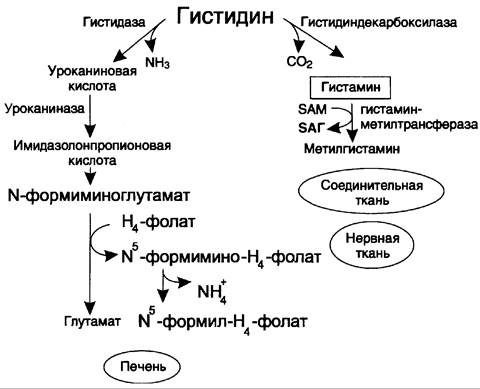
В печени и коже гистидин подвергается дезаминированию под действием фермента гистидазы с образованием уроканиновой кислоты. Конечным продуктом катаболизма гистидина служит глутамат, NН3 и производные Н4-фолата (N5-формимино-Н4-фолат и N5-формил-Н4-фолат). Наследственный дефект гистидазы вызывает накопление гистидина и развитие гистидинемии, которая проявляется задержкой в умственном и физическом развитии детей. Наследственный дефект уроканиназы в печени может вызвать уроканинемию, при которой в крови повышается уровень уроканата. Симптомы этого патологического состояния во многом аналогичны симптомам других энзимопатий и проявляются отставанием умственного и физического развития.
Ферменты гистидаза и уроканиназа гепатоспецифичны, поэтому их определение используют в клинике для диагностики поражений печени.
1. Синтез и биологическая роль гистамина
Гистамин образуется путём декарбоксилирования гистидина в тучных клетках соединительной ткани (см. схему А).
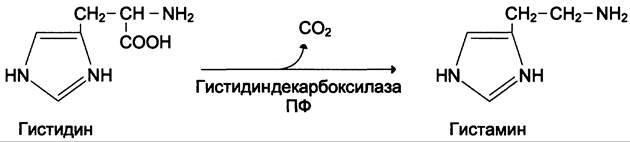
Гистамин образует комплекс с белками и сохраняется в секреторных гранулах тучных клеток. Секретируется в кровь при повреждении ткани (удар, ожог, воздействие эндо- и экзогенных веществ), развитии иммунных и аллергических реакций. Гистамин выполняет в организме человека следующие функции:
✵ стимулирует секрецию желудочного сока, слюны (т. е. играет роль пищеварительного гормона);
✵ повышает проницаемость капилляров, вызывает отёки, снижает АД (но увеличивает внутричерепное давление, вызывает головную боль);
✵ сокращает гладкую мускулатуру лёгких, вызывает удушье;
✵ участвует в формировании воспалительной реакции — вызывает расширение сосудов, покраснение кожи, отёчность ткани;
✵ вызывает аллергическую реакцию;
✵ выполняет роль нейромедиатора;
✵ является медиатором боли.
2. Синтез и биологическая роль карнозина и анзерина
В мышцах и головном мозге синтезируются гистидиновые дипептиды карнозин и анзерин, причём в скелетных мышцах их содержание особенно велико и достигает величин порядка 100-200 мг/100 г ткани. Карнозин был обнаружен в 1900 г. российским биохимиком В. С. Гулевичем, анзерин — несколько позже.
Карнозин образуется из β-аланина и гистидина под действием карнозинсинтетазы (см. схему Б).
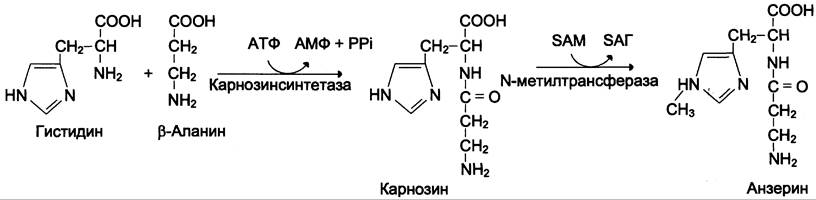
Далее в присутствии SAM идёт реакция метилирования карнозина под действием фермента N-метилтрансферазы и образуется анзерин, β-Аланин, необходимый для синтеза, получается при катаболизме пиримидиновых нуклеотидов.
Карнозин может поступать из мышц в кровь и поглощаться почками и энтероцитами. В крови и почках человека присутствует Zn-зависимый фермент карнозиназа, способный гидролизовать карнозин на β-аланин и гистидин.
Физиологическое действие гистидиновых дипептидов изучалось российским биохимиком С. Е. Севериным в 60-х годах и исследуется до настоящего времени многими учёными. Карнозин увеличивает амплитуду сокращения скелетных мышц и активирует работу ионных насосов мышечных клеток, стимулирует АТФ-азную активность миозина. Содержание гистидиновых пептидов в гладкой и сердечной мускулатуре во много раз ниже, чем в скелетной. Они создают до 40% буферной ёмкости быстрых мышц и позволяют накапливать много лактата. Избыток лактата в отсутствие гистидиновых пептидов приводит к ацидозу и контрактуре. Карнозин и анзерин обладают антиоксидантной активностью, ингибируют NО-зависимую гуанилатциклазу, замедляют процессы старения человека, влияя на скорость апоптоза.
В. Роль аргинина и орнитина в синтезе биологически активных молекул
Обмен аминокислоты аргинина связан с реакциями орнитинового цикла, которые можно рассматривать как путь синтеза аргинина. Под действием аргиназы в цикле происходит и распад аргинина на орнитин и мочевину.
Аргинин выполняет в организме важные функции:
✵ используется в синтезе креатина, который в виде креатинфосфата способен служить источником энергии для работы мышц человека и млекопитающих. В мышцах беспозвоночных аналогичную энергетическую функцию способен выполнять аргининфосфат.
✵ служит источником NO в организме;
✵ служит предшественником орнитина, из которого синтезируются полиамины.
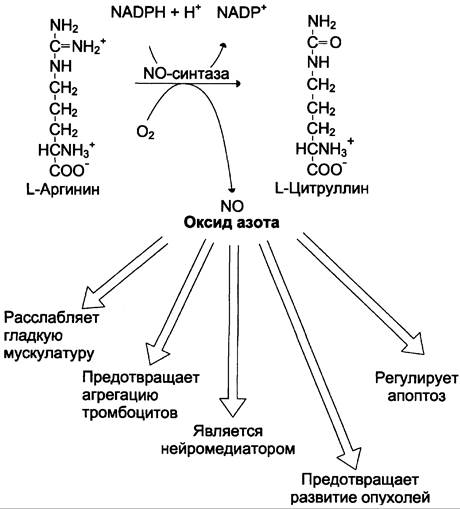
1. Аргинин — источник NО в организме
Аминокислота аргинин служит в организме источником оксида азота (NО). Образование NО в клетках катализирует сложный Са2+-зависимый фермент NО-синтаза. В состав фермента входит гем, необходимы два флавиновых кофермента FАD и FMN, Н4БП, а также ионы Zn2+.
Образование NO происходит во всех клетках и тканях. В настоящее время в разных клетках обнаружены три изоферментные формы NO-синтазы: нейрональная и эпителиальная — конститутивные, и индуцибельная, которая преобладает в печени, мышцах, миокарде.
Оксид азота — важная сигнальная молекула, активирующая гуанилатциклазу и стимулирующая быстрое образование цГМФ. Это вызывает снижение силы сердечных сокращений, регулирует тонус сосудов. Кроме этого, NO-paдикaл участвует в регуляции скорости апоптоза, предотвращает агрегацию тромбоцитов и тромбоз, регулирует секрецию медиаторов и гормонов, обладает антиканцерогенной активностью (рис. 9-32).
Рис. 9-32. Биосинтез и биологическая роль оксида азота.
2. Образование спермидина и спермина, их биологическая роль
Аргинин под действием аргиназы превращается в аминокислоту орнитин, которая не входит в состав белков организма. Из орнитина синтезируются полиамины спермидин и спермин (см. схему А).
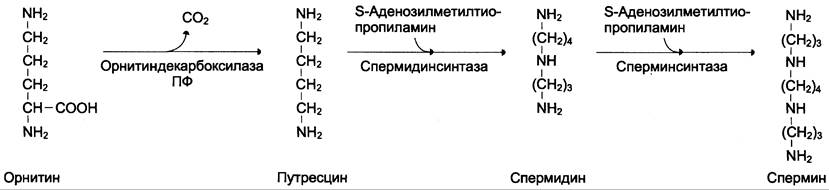
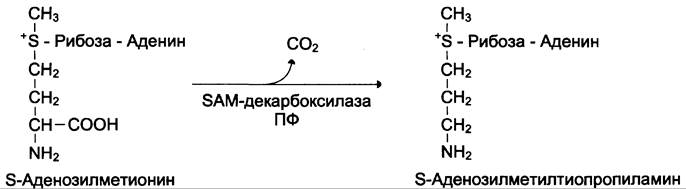
Реакция проходит под действием орнитин- декарбоксилазы в присутствии пиридоксальфосфата. Далее под действием спермидинсинтазы и сперминсинтазы происходит включение остатков аминопропана. Донором этих групп служит производное SAM — S-аденозилметилти- опропиламин (см. схему Б).
Спермидин, спермин и путресцин обнаружены в ядрах клеток всех органов человека. Они имеют большой положительный заряд, легко связываются с отрицательно заряженными молекулами ДНК и РНК, входят в состав хроматина и участвуют в репликации ДНК, стимулируют транскрипцию и трансляцию. Их концентрация сильно возрастает при интенсивной пролиферации тканей.
Фермент орнитиндекарбоксилаза — регулируемый. Он отличается очень коротким Т1/2 — всего 10 мин. Гормон роста, кортикостероиды, тестостерон быстро увеличивают его количество в 10 — 200 раз.
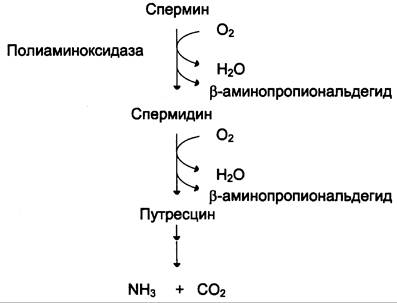
Катаболизм полиаминов до СО2 и Н2О происходит под действием полиаминоксидазы в печени. Часть их в ацетилированном виде экскретируется почками.
Основные биогенные амины и их аминокислоты-предшественники представлены в табл. 9-6.
Таблица 9-6. Предшественники и биологическая роль некоторых биогенных аминов
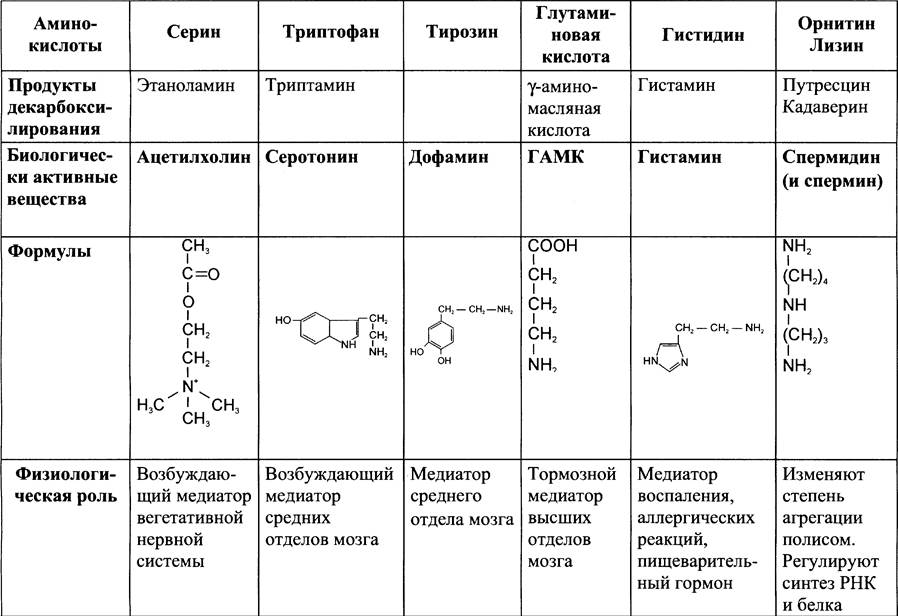
К биогенным аминам относят и катехоламины (дофамин, норадреналин и адреналин). Дофамин, в частности, является медиатором среднего отдела мозга. Норадреналин —возбуждающий медиатор в гипоталамусе, а также медиатор синаптической нервной системы и разных отделов головного мозга. Адреналин — гормон, активно синтезирующийся при стрессе и регулирующий основной обмен, а также усиливающий сокращение сердечной мышцы.
Г. Инактивация биогенных аминов
Для осуществления биологической функции в нервных клетках требуется определённая концентрация биогенных аминов. Избыточное накопление их может вызывать различные патологические отклонения. В связи с этим большое значение приобретают механизмы инактивации биогенных аминов.
Инактивация биогенных аминов происходит двумя путями:
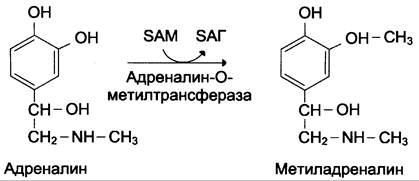
1) метилированием с участием SAM под действием метилтрансфераз. Таким образом могут инактивироваться различные биогенные амины, но чаще всего происходит инактивация гистамина и адреналина. Так, инактивация адреналина происходит путём метилирования гидроксильной группы в орто-положении (см. схему ниже).
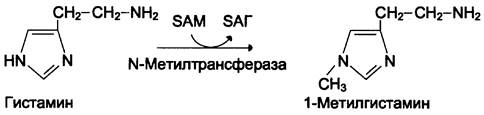
Реакция инактивации гистамина также преимущественно происходит путём метилирования (см. схему А).
2) окислением ферментами моноаминооксидазами (МАО) с коферментом FAD — таким путём чаще происходит инактивация дофамина, норадреналина, серотонина, ГАМК. При этом происходит окислительное дезаминирование биогенных аминов с образованием альдегидов, а затем соответствующих кислот, которые выводятся почками (см. схему Б).