БИОХИМИЯ УЧЕБНИК ДЛЯ ВУЗОВ - Е. С. Северина - 2004
РАЗДЕЛ 12. ОБЕЗВРЕЖИВАНИЕ ТОКСИЧЕСКИХ ВЕЩЕСТВ В ОРГАНИЗМЕ
III. Метаболизм этанола в печени
Катаболизм этилового спирта осуществляется главным образом в печени. Здесь окисляется от 75% до 98% введённого в организм этанола.
Окисление алкоголя — сложный биохимический процесс, в который вовлекаются основные метаболические процессы клетки. Превращение этанола в печени осуществляется тремя путями с образованием токсического метаболита — ацетальдегида (рис. 12-22).
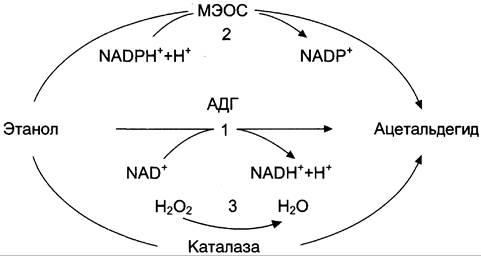
Рис. 12-22. Метаболизм этанола. 1 — окисление этанола NАD+-зависимой алкогольдегидрогеназой (АДГ); 2 — МЭОС — микросомальная этанолокисляющая система; 3 — окисление этанола каталазой.
А. Окисление этанола NAD-зависимой алькогольдегидрогеназой
Основную роль в метаболизме этанола играет цинксодержащий NАD+-зависимый фермент — алкогольдегидрогеназа, локализующаяся в основном в цитозоле и митохондриях печени (95%). В ходе реакции происходит дегидрирование этанола, образуются ацетальдегид и восстановленный кофермент NADH.
Алкогольдегидрогеназа катализирует обратимую реакцию, направление которой зависит от концентрации ацетальдегида и соотношения NADH/NAD+ в клетке.
С2Н5ОН + NАD+ <-> СН3СНО + NADH + Н+.
Фермент алкогольдегидрогеназа — димер, состоящий из идентичных или близких по первичной структуре полипептидных цепей, кодируемых аллелями одного гена. Существуют 3 изоформы алкогольдегидрогеназы (АДГ): АДГ1, АДГ2, АДГ3, различающиеся по строению протомеров, локализации и активности. Для европейцев характерно присутствие изоформ АДГ, и АДГ3. У некоторых восточных народов преобладает изоформа АДГ2, характеризующаяся высокой активностью, это может быть причиной их повышенной чувствительности к алкоголю. При хроническом алкоголизме количество фермента в печени не увеличивается, т. е. он не является индуцируемым ферментом.
Б. Окисление этанола при участии цитохром Р450-зависимой микросомальной этанолокисляющей системы
Цитохром Р450-зависимая микросомальная этанолокисляющая система (МЭОС) локализована в мембране гладкого ЭР гепатоцитов. МЭОС играет незначительную роль в метаболизме небольших количеств алкоголя, но индуцируется этанолом, другими спиртами, лекарствами типа барбитуратов и приобретает существенное значение при злоупотреблении этими веществами. Этот путь окисления этанола происходит при участии одной из изоформ Р450 — изофермента Р450 II Е1. При хроническом алкоголизме окисление этанола ускоряется на 50-70% за счёт гипертрофии ЭР и индукции цитохрома Р450II Е1.
С2Н5ОН + NADРН + Н+ + O2 —> СН3СНО + NADP+ + 2 Н2O.
Кроме основной реакции, цитохром Р450 катализирует образование активных форм кислорода (O2- , Н2O2), которые стимулируют ПОЛ в печени и других органах (см. раздел 8).
В. Окисление этанола каталазой
Второстепенную роль в окислении этанола играет каталаза, находящаяся в пероксисомах цитоплазмы и митохондрий клеток печени. Этот фермент расщепляет примерно 2% этанола, но при этом утилизирует пероксид водорода.
СН3СН2ОН + H2O2 —> СН3СНО +2 H2O.
Г. Метаболизм и токсичность ацетальдегида
Ацетальдегид, образовавшийся из этанола, окисляется до уксусной кислоты двумя ферментами: FАD-зависимой альдегидоксидазой и NAD+-зaвиcимoй ацетальдегиддегидрогеназой (АлДГ).
CH3CHO + O2 + H2O —> CH3COOH +H2O2.
Повышение концентрации ацетальдегида в клетке вызывает индукцию фермента альдегид- оксидазы. В ходе реакции образуются уксусная кислота, пероксид водорода и другие активные формы кислорода, что приводит к активации ПОЛ.
Другой фермент ацетальдегиддегидрогеназа (АлДГ) окисляет субстрат при участии кофермента NАD+.
СН3СНО + Н2O + NАD+ —> СН3СООН + NАDН + Н+.
Полученная в ходе реакции уксусная кислота активируется под действием фермента ацетил-КоА-синтетазы. Реакция протекает с использованием кофермента А и молекулы АТФ. Образовавшийся ацетил-КоА, в зависимости от соотношения АТФ/АДФ и концентрации окса- лоацетата в митохондриях гепатоцитов, может «сгорать» в ЦТК, идти на синтез жирных кислот или кетоновых тел.
В разных тканях организма человека встречаются полиморфные варианты АлДГ. Они характеризуются широкой субстратной специфичностью, разным распределением по клеткам тканей (почки, эпителий, слизистая оболочка желудка и кишечника) и в компартментах клетки. Например, изоформа АлДГ, локализованная в митохондриях гепатоцитов, обладает более высоким сродством к ацетальдегиду, чем цитозольная форма фермента.
Ферменты, участвующие в окислении этанола, — алкогольдегидрогеназа и АлДГ поразному распределены: в цитозоле — 80%/20% и митохондриях — 20%/80%. При поступлении больших доз алкоголя (более 2 г/кг) из-за разных скоростей окисления этанола и ацетальдегида в цитозоле резко повышается концентрация последнего. Ацетальдегид — очень реакционноспособное соединение; он неферментативно может ацетилировать SН-, NН2-группы белков и других соединений в клетке и нарушать их функции. В модифицированных (ацетилированных) белках могут возникать «сшивки», нехарактерные для нативной структуры (например, в белках межклеточного матрикса — эластине и коллагене, некоторых белках хроматина и липопротеинов, формирующихся в печени). Ацетилирование ядерных, цитоплазматических ферментов и структурных белков приводит к снижению синтеза экспортируемых печенью в кровь белков, например, альбумина, который, удерживая Na+, поддерживает коллоидно-осмотическое давление, а также участвует в транспорте многих гидрофобных веществ в крови (см. раздел 14). Нарушение функций альбумина в сочетании с повреждающим действием ацетальдегида на мембраны сопровождается поступлением в клетки по градиенту концентрации ионов натрия и воды, происходит осмотическое набухание этих клеток и нарушение их функций.
Активное окисление этанола и ацетальдегида приводит к увеличению отношения NADH/ NAD+, что снижает активность NАD+-зависимых ферментов в цитозоле и менее значительно в митохондриях.
Равновесие следующей реакции смещается вправо:
Дигидроксиацетонфосфат + NADH + Н+ Глицерол-3-фосфат + NAD+,
Пируват + NADH + Н+ <-> Лактат +NAD+.
Восстановление дигидроксиацетонфосфата, промежуточного метаболита гликолиза и глюконеогенеза, приводит к снижению скорости глюконеогенеза. Образование глицерол-3-фосфата повышает вероятность синтеза жира в печени. Увеличение концентрации NADH по сравнению с NAD+ (NADH>NAD+) замедляет реакцию окисления лактата, увеличивается соотношение лактат/пируват и ещё больше снижается скорость глюконеогенеза (см. раздел 7). В крови возрастает концентрация лактата, это приводит к гиперлактацидемии и лактоацидозу (рис. 12-23).
Рисунок 12-23. Эффекты этанола в печени. 1 —> 2 —> 3 — окисление этанола до ацетата и превращение его в ацетил-КоА (1 — реакция катализируется алкогольдегидрогеназой, 2 — реакция катализируется АлДГ). Скорость образования ацетальдегида (1) часто при приёме большого количества алкоголя выше, чем скорость его окисления (2), поэтому ацетальальдегид накапливается и оказывает влияние на синтез белков (4), ингибируя его, а также понижает концентрацию восстановленного глутатиона (5), в результате чего активируется ПОЛ. Скорость глюконеогенеза (6) снижается, так как высокая концентрация NАDH, образованного в реакциях окисления этанола (1, 2), ингибирует глюконеогенез (6). Лактат выделяется в кровь (7), и развивается лактоацидоз. Увеличение концентрации NАDН замедляет скорость ЦТК; ацетил-КоА накапливается, активируется синтез кетоновых тел (кетоз) (8). Окисление жирных кислот также замедляется (9), увеличивается синтез жира (10), что приводит к ожирению печени и гипертриацилглицеролемии.
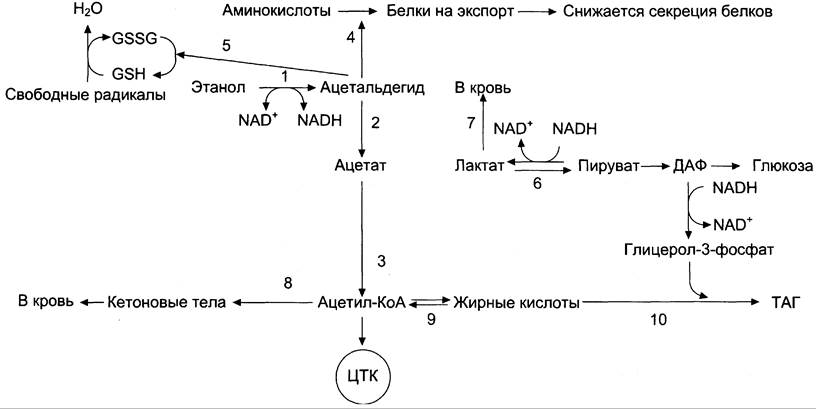
NADH окисляется ферментом дыхательной цепи NADH-дегидрогеназой. Возникновение трансмембранного электрического потенциала на внутренней митохондриальной мембране не приводит к синтезу АТФ в полном объёме. Этому препятствует нарушение структуры внутренней мембраны митохондрий, вызванное мембранотропным действием этилового спирта и повреждающим действием ацетальдегида на мембраны.
Можно сказать, что ацетальдегид опосредованно активирует ПОЛ, так как связывая SH- группы глутатиона, он снижает количество активного (восстановленного) глутатиона в клетке, который необходим для функционирования фермента глутатионпероксидазы (см. раздел 8), участвующего в катаболизме Н2O2. Накопление свободных радикалов приводит к активации ПОЛ мембран и нарушению структуры липидного бислоя.
На начальных стадиях алкоголизма окисление ацетил-КоА в ЦТК — основной источник энергии для клетки. Избыток ацетил-КоА в составе цитрата выходит из митохондрий, и в цитоплазме начинается синтез жирных кислот. Этот процесс, помимо АТФ, требует участия NADPH, который образуется при окислении глюкозы в пентозофосфатном цикле. Из жирных кислот и глицерол-3-фосфата образуются ТАГ, которые в составе ЛПОНП секретируются в кровь. Повышенная продукция ЛПОНП печенью приводит к гипертриацилглицеролемии. При хроническом алкоголизме снижение синтеза фосфолипидов и белков в печени, в том числе и апобелков, участвующих в формировании ЛПОНП, вызывает внутриклеточное накопление ТАГ и ожирение печени.
Однако в период острой алкогольной интоксикации, несмотря на наличие большого количества ацетил-КоА, недостаток оксалоацетата снижает скорость образования цитрата. В этих условиях избыток ацетил-КоА идёт на синтез кетоновых тел, которые выходят в кровь. Повышение в крови концентрации лактата, ацетоуксусной кислоты и β-гидроксибутирата служит причиной метаболического ацидоза при алкогольной интоксикации.
Как уже было сказано ранее, реакция образования ацетальдегида из этанола протекает под действием алкогольдегидрогеназы. Поэтому при повышении концентрации ацетальдегида и NАDН в клетках печени направление реакции меняется — образуется этанол. Этанол — мембранотропное соединение, он растворяется в липидном бислое мембран и нарушает их функции. Это негативно отражается на трансмембранном переносе веществ, межклеточных контактах, взаимодействиях рецепторов клетки с сигнальными молекулами. Этанол может проходить через мембраны в межклеточное пространство и кровь и далее в любую клетку организма.
Д. Влияния этанола и ацетальдегида на метаболизм ксенобиотиков и лекарств в печени
Характер влияния этанола на метаболизм ксенобиотиков и лекарств зависит от стадии алкогольной болезни: начальная стадия алкоголизма, хронический алкоголизм или острая форма алкогольной интоксикации.
Микросомальная этанолокисляющая система (МЭОС) наряду с метаболизмом этанола участвует в детоксикации ксенобиотиков и лекарств. На начальной стадии алкогольной болезни биотрансформация лекарственных веществ протекает более активно вследствие индукции ферментов системы. Этим объясняют феномен лекарственной «устойчивости». Однако при острой интоксикации этиловым спиртом тормозится биотрансформация лекарственных веществ. Этанол конкурирует с ксенобиотиками за связывание с цитохромом Р450II Е1, вызывая гиперчувствительность (лекарственную «неустойчивость») к некоторым принятым одновременно с ним лекарственным препаратам.
Кроме того, у людей, страдающих хроническим алкоголизмом, наблюдают избирательную индукцию изоформы Р450 II Е1 и конкурентное ингибирование синтеза других изоформ, принимающих участие в метаболизме ксенобиотиков и лекарств. При злоупотреблении алкоголем индуцируется также синтез глюкуронил-трансфераз, но снижается образование УДФ-глюкуроната.
Алкогольдегидрогеназа обладает широкой субстратной специфичностью и может окислять разные спирты, в том числе и метаболиты сердечных гликозидов — дигитоксина, дигоксина и гитоксина. Конкуренция этанола с сердечными гликозидами за активный центр алкоголь- дегидрогеназы приводит к снижению скорости биотрансформации этой группы лекарств и повышает опасность их побочного эффекта у лиц, принимающих большие дозы алкоголя.
Повышение концентрации ацетальдегида вызывает целый ряд нарушений в структуре белков (ацетилирование), мембран (ПОЛ), модификацию глутатиона, необходимого для одного из самых важных ферментов обезвреживания ксенобиотиков — глутатионтрансферазы и фермента антиоксидазной защиты глутатион- пероксидазы. Таким образом, представленные данные свидетельствуют, что алкогольное поражение печени сопровождается нарушением важнейшей функции этого органа — детоксикационной.