БИОХИМИЯ УЧЕБНИК ДЛЯ ВУЗОВ - Е. С. Северина - 2004
РАЗДЕЛ 14. БИОХИМИЯ КРОВИ
Кровь — жидкая внутренняя среда организма. Общий объём крови взрослого человека составляет 5 — 6 л. Кровь состоит из жидкой части — плазмы, составляющей 55% её общего объёма, и форменных элементов, к которым относят эритроциты, лейкоциты и тромбоциты.
Благодаря работе сердца кровь циркулирует по замкнутой системе кровеносных сосудов и осуществляет транспорт различных химических веществ. Она переносит кислород из лёгких к тканям и углекислый газ из тканей в лёгкие в составе гемоглобина эритроцитов (дыхательная функция); доставляет продукты переваривания пищи из кишечника в ткани (трофическая функция); уносит конечные продукты обмена из тканей в выделительные органы (выделительная функция); перемещает промежуточные продукты обмена веществ, синтез и использование которых происходит в разных органах.
Кровь участвует в регуляции обмена веществ, доставляя сигнальные молекулы от органов внутренней секреции к тканям- мишеням.
Защитная функция крови имеет две стороны. Во-первых, в ней содержатся клеточные (лейкоциты) и гуморальные (антитела) элементы иммунного реагирования, которые защищают организм от любой чужеродной молекулы. Во-вторых, это способность крови свёртываться. При повреждении сосуда прерывается замкнутость циркуляции крови, а уменьшение количества крови может привести к серьёзным нарушениям функций клеток, вплоть до их гибели. Кровь здорового человека образует тромб в месте повреждения, который закупоривает просвет повреждённого сосуда и останавливает кровотечение.
Кровь поддерживает кислотно-щелочной и водный баланс организма. В норме pH крови составляет 7,36 — 7,4. Сохранение постоянства pH является важнейшей задачей, так как в кровь выделяется большое количество кислых (например, лактат, кетоновые тела, угольная кислота), а также основных (аммиак) продуктов метаболизма. Регуляцию pH осуществляют буферные системы крови, которые подробно рассмотрены в курсе физиологии.
Выполняя терморегуляторную функцию, кровь поддерживает постоянство температуры тела в разных его частях.
Химический состав растворимых в плазме крови веществ относительно постоянен, так как существуют мощные нервные и гуморальные механизмы, поддерживающие гомеостаз (постоянство внутренней среды). Растворимые вещества плазмы составляют около 10% массы крови, из них на долю белков приходится около 7%, на долю неорганических солей — 0,9%, остальную часть образуют небелковые органические соединения. Диапазон концентраций разных веществ плазмы крови у здорового человека представлен в специальных биохимических справочниках и является важнейшим материалом для медицинской биохимии.
Кровь связана со всеми тканями организма, поэтому возникновение патологического процесса в каком-либо органе приводит к изменению биохимических показателей крови. Эта информация может быть ценной при постановке диагноза и оценке эффективности лечебных мероприятий.
I. Метаболизм эритроцитов
Эритроциты — высокоспециализированные клетки, которые переносят кислород от лёгких к тканям и диоксид углерода, образующийся при метаболизме, из тканей к альвеолам лёгких. Транспорт O2 и СO2 в этих клетках осуществляет гемоглобин, составляющий 95% их сухого остатка. Организм взрослого человека содержит около 25 x 1012эритроцитов, при этом каждые сутки обновляется примерно 1% этого количества клеток, т. е. в течение одной секунды в кровоток поступает около 2 млн эритроцитов.
А. Особенности строения и дифференцировки эритроцитов
Эритроциты — единственные клетки, которые имеют только клеточную мембрану и цитоплазму. Дифференцировка стволовых клеток в специализированные происходит в клетках костного мозга и заканчивается в кровотоке. Особенности строения эритроцитов соответствуют их функциям: большая площадь поверхности обеспечивает эффективность газообмена, эластичная клеточная мембрана облегчает движение по узким капиллярам, специальная ферментативная система защищает эти клетки от активных форм кислорода.
Дифференцировка эритроцитов. Эритроциты, так же, как и другие клетки крови, образуются из полипотентных стволовых клеток костного мозга (рис. 14-1).
Рис. 14-1. Схема дифференцировки стволовых клеток костного мозга в зрелые эритроциты.
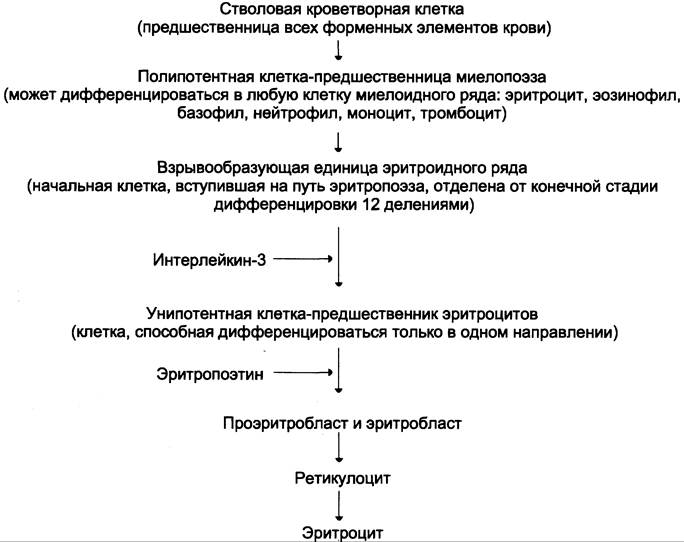
Размножение и превращение начальной клетки эритроидного ряда в унипотентную стимулирует ростовой фактор интерлейкин-3. Интерлейкин-3 синтезируется Т-лимфоцитами, а также клетками костного мозга. Это низкомолекулярный белок группы цитокинов — регуляторов роста и дифференцировки клеток.
Дальнейшую пролиферацию и дифференцировку унипотентной клетки эритроидного ряда регулирует синтезирующийся в почках гормон эритропоэтин. Скорость образования эритропоэтина в почках зависит от парциального давления кислорода. При недостатке кислорода скорость образования гормона повышается и, соответственно, количество эритроцитов тоже увеличивается. Хроническая почечная недостаточность сопровождается снижением образования эритропоэтина в почках, что приводит к развитию анемии.
В процессе дифференцировки на стадии эритробласта происходят интенсивный синтез гемоглобина, конденсация хроматина, уменьшение размера ядра и его удаление. Образующийся ретикулоцит ещё содержит глобиновую мРНК и активно синтезирует гемоглобин. Циркулирующие в крови ретикулоциты лишаются рибосом, ЭР, митохондрий и в течение двух суток превращаются в эритроциты. Стволовая клетка превращается в эритроцит за две недели. Эритроциты не содержат ядра и поэтому не способны к самовоспроизведению и репарации возникающих в них повреждений. Эти клетки циркулируют в крови около 120 дней и потом разрушаются макрофагами в печени, селезёнке и костном мозге (см. раздел 13).
Строение эритроцитов. Двояковогнутая форма эритроцитов имеет большую площадь поверхности по сравнению с клетками сферической формы такого же размера. Это облегчает газообмен между клеткой и внеклеточной средой. Кроме того, такая форма, а также особенности строения мембраны и цитоскелета обеспечивают большую пластичность эритроцитов при прохождении ими мелких капилляров.
Важную роль в сохранении формы и способности к обратимой деформации эритроцитов играют липиды и белки плазматической мембраны. Липиды бислоя плазматической мембраны эритроцитов, так же, как плазматические мембраны других клеток, содержат глицерофосфолипиды, сфингофосфолипиды, гликолипиды и холестерол (см. раздел 5). Увеличение содержания холестерола в составе мембраны, которое может наблюдаться при некоторых заболеваниях, снижает её текучесть и эластичность, а, следовательно, и способность к обратимой деформации. Это, в свою очередь, затрудняет движение эритроцитов через капилляры и может способствовать развитию гемостаза.
Методом электрофореза в мембране эритроцитов обнаруживают около 15 основных мембранных белков с молекулярной массой от 15 до 250 кД. Около 60% массы мембранных белков приходится на спектрин, гликофорин и белок полосы 3 (называется так по расположению этой белковой фракции на электрофореграмме относительно других белков). Интегральный гликопротеин гликофорин присутствует только в плазматической мембране эритроцитов (рис. 14-2). К N-концевой части белка, расположенной на наружной поверхности мембраны, присоединено около 20 олигосахаридных цепей (см. раздел 5). Олигосахариды гликофорина — антигенные детерминанты системы групп крови ABO (см. раздел 10).
Рис. 14-2. Строение спектрина (А), околомембранного белкового комплекса (Б) и цитоскелета эритроцитов (В). Каждый димер спектрина состоит из двух антипараллельных, нековалентносвязанных между собой α- и β-полипептидных цепей (А). Белок полосы 4.1 образует со спетрином и актином «узловой комплекс», который посредством белка полосы 4.1 связывается с цитоплазматическим доменом гликофорина. Анкирин соединяет спектрин с основным интегральным белком плазматической мембраны — белком полосы 3 (Б). На цитоплазматической поверхности мембраны эритроцита имеется гибкая сетеобразная структура, состоящая из белков и обеспечивающая пластичность эритроцита при прохождении им через мелкие капилляры (В).
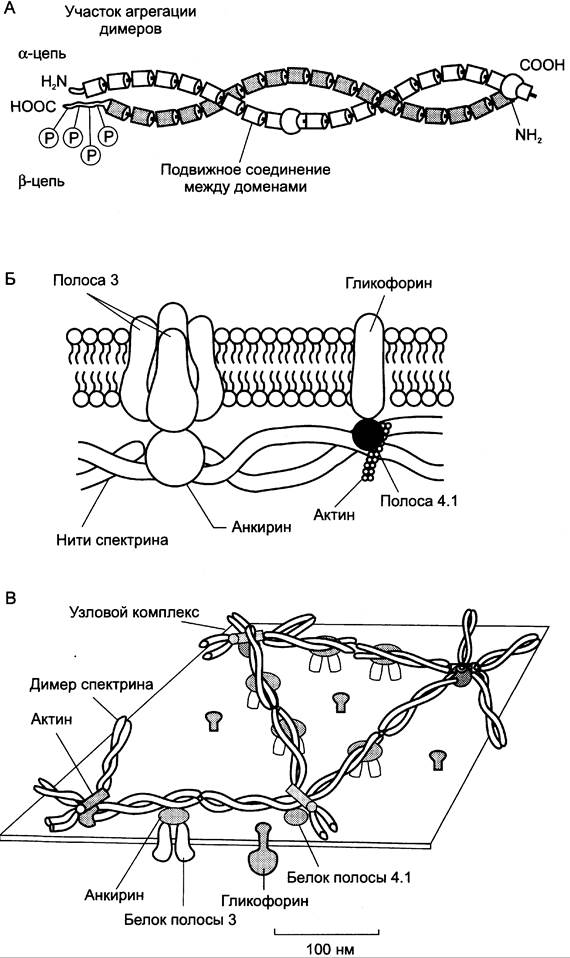
Спектрин — периферический мембранный белок, нековалентно связанный с цитоплазматической поверхностью липидного бислоя мембраны. Он представляет собой длинную, тонкую, гибкую фибриллу и является основным белком цитоскелета эритроцитов. Спектрин состоит из α- и β-полипептидных цепей, имеющих доменное строение; α- и β-цепи димера расположены антипараллельно, перекручены друг с другом и нековалентно взаимодействуют во многих точках. Спектрин может прикрепляться к мембране и с помощью белка анкирина. Этот крупный белок соединяется с β-цепью спектрина и цитоплазматическим доменом интегрального белка мембраны — белка полосы 3. Анкирин не только фиксирует спектрин на мембране, но и уменьшает скорость диффузии белка полосы 3 в липидном слое. Таким образом, на цитоплазматической поверхности эритроцитов образуется гибкая сетевидная структура, которая обеспечивает сохранение их формы при прохождении через узкие капилляры сосудов (рис. 14-2).
Интегральный белок полосы 3 — белок-переносчик ионов Сl- и НСO3- через плазматическую мембрану эритроцитов по механизму пассивного антипорта. В разделе 1 подробно описана роль эритроцитов в газообмене. Поступающий из тканей в эритроциты СO2 под действием фермента карбоангидразы превращается в слабую угольную кислоту, которая распадается на Н+ и НСО3-. Образующиеся при этом протоны присоединяются к гемоглобину, уменьшая его сродство к О2, а бикарбонаты с помощью белка полосы 3 обмениваются на Сl- и выходят в плазму крови.
Н2O + СO2 —> Н2СO3 —> Н+ + НСO3- —> обмен на Сl-.
В лёгких увеличение парциального давления кислорода и взаимодействие его с гемоглобином приводят к вытеснению протонов из гемоглобина, обмену внутриклеточного Сl- на НСO3- через белок полосы 3, образованию угольной кислоты и её разрушению на СO2 и Н2O.
Мембранный фермент Nа+, К-АТФ-аза обеспечивает поддержание градиента концентраций Na+ и К+ по обе стороны мембраны. При снижении активности Na+, К-АТФ-азы концентрация Na+ в клетке повышается, так как небольшие ионы могут проходить через мембрану простой диффузией. Это приводит к увеличению осмотического давления, увеличению поступления воды в эритроцит и к его гибели в результате разрушения клеточной мембраны — гемолизу.
Са2+-АТФ-аза — ещё один мембранный фермент, осуществляющий выведение из эритроцитов ионов кальция и поддерживающий градиент концентрации этого иона по обе стороны мембраны.
Б. Метаболизм глюкозы в эритроцитах
Эритроциты лишены митохондрий, поэтому в качестве энергетического материала они могут использовать только глюкозу. В эритроцитах катаболизм глюкозы обеспечивает сохранение структуры и функции гемоглобина, целостность мембран и образование энергии для работы ионных насосов. Глюкоза поступает в эритроциты путём облегчённой диффузии с помощью ГЛЮТ-2. Около 90% поступающей глюкозы используется в анаэробном гликолизе, а остальные 10% — в пентозофосфатном пути.
Конечный продукт анаэробного гликолиза лактат выходит в плазму крови и используется в других клетках, прежде всего гепатоцитах. АТФ, образующийся в анаэробном гликолизе, обеспечивает работу Na+, К+-АТФ-азы и поддержание самого гликолиза, требующего затраты АТФ в гексокиназной и фосфофруктокиназной реакциях (см. раздел 7).
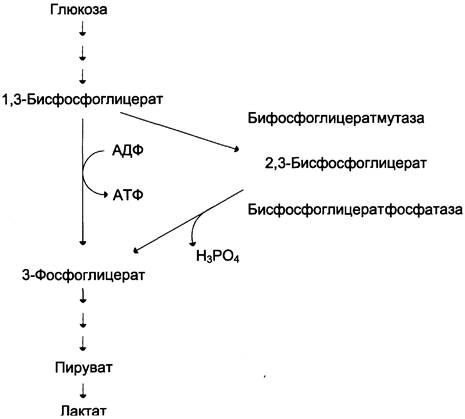
Важная особенность анаэробного гликолиза в эритроцитах по сравнению с другими клетками — присутствие в них фермента бисфосфоглицератмутазы. Бисфосфоглицератмутаза катализирует образование 2,3-бисфосфоглицерата из 1,3-бисфосфоглицерата (рис. 14-3). Образующийся только в эритроцитах 2,3-бисфосфоглицерат служит важным аллостерическим регулятором связывания кислорода гемоглобином (см. раздел 1).
Рис. 14-3. Метаболизм 2,3-бисфосфоглицерата в эритроцитах.
Глюкоза в эритроцитах используется и в пентозофосфатном пути, окислительный этап которого обеспечивает образование кофермента NADPH, необходимого для восстановления глутатиона (рис. 14-4).
В. Обезвреживание активных форм кислорода в эритроцитах
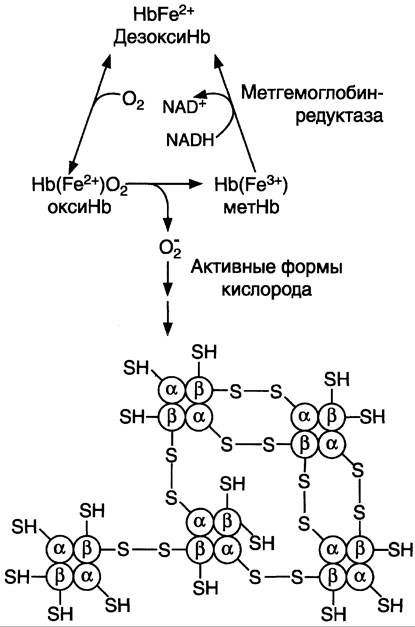
Большое содержание кислорода в эритроцитах определяет высокую скорость образования супероксидного анион-радикала (O2-), пероксида водорода (Н2O2) и гидроксил радикала (ОН•). Эритроциты содержат ферментативную систему, предотвращающую токсическое действие активных форм кислорода и разрушение мембран эритроцитов (рис. 14-4). Постоянный источник активных форм кислорода в эритроцитах — неферментативное окисление гемоглобина в метгемоглобин:
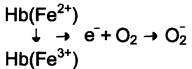
В течение суток до 3% гемоглобина может окисляться в метгемоглобин. Однако постоян но метгемоглобинредуктазная система восстанавливает метгемоглобин в гемоглобин. Метгемоглобинредуктазная система состоит из цитохрома b5 и флавопротеина цитохром b5 редуктазы, донором водорода для которой служит NАDН, образующийся в глицеральдегиддегидрогеназной реакции гликолиза (рис. 14-4).
Рисунок 14-4. Образование и обезвреживание активных форм кислорода в эритроците: 1 — спонтанное окисление Fе2+ в геме гемоглобина — источник супероксидного аниона в эритроцитах; 2 — супероксиддисмутаза превращает супероксидный анион в пероксид водорода и воду: O2- + O2- + 2 Н+ —> Н2O2 + O2; 3 — пероксид водорода расщепляется каталазой: 2 Н2O2 —> 2 Н2O + O2 или глутатионпероксидазой: 2 GSН + Н2O2 —> GSSG +2 Н2O; 4 — глутатионредуктаза восстанавливает окисленный глутатион: GSSG + NАDРН + Н+ —> 2 GSН + NАDР+; 5 — NАDРН, необходимый для восстановления глутатиона, образуется на окислительном этапе пентозофосфатного пути превращения глюкозы; 6 — NАDН, необходимый для восстановления гемоглобина метгемоглобинредуктазной системой, образуется в глицеральдегидфосфатдегидрогеназной реакции гликолиза.
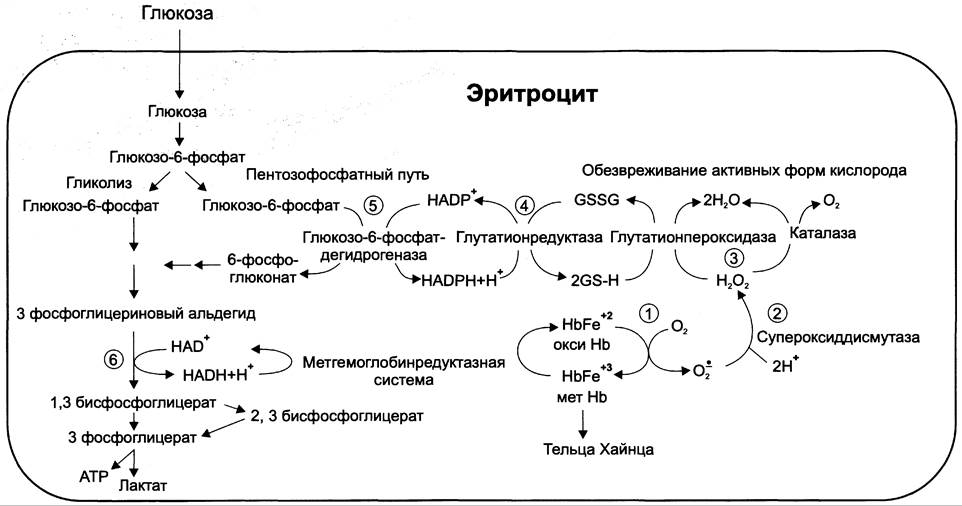
Цитохром b5 восстанавливает Fе3+ метгемоглобина в Fе2+:
Нb-Fе3+ + цит. b5 восст. —> НbFе2+ + цит. b5 ок.
Окисленный цитохром b5 далее восстанавливается цитохром b5 редуктазой:
Цит. b5 ок. + NАDН —> цит. b5 восст. + NАD+.
Супероксидный анион с помощью фермента супероксидцисмутазы превращается в пероксид водорода:
O2- + O2- + 2 Н+ —> Н2O2 + O2.
Пероксид водорода разрушается каталазой и содержащим селен ферментом глутатионпероксидазой. Донором водорода в этой реакции служит глутатион — трипептид глутамилцистеинил- глицин (GSН) (см. раздел 12).
2Н2O —> 2 Н2O + O2; 2GSН + Н2O2 —> GSSG +2 Н2O.
Окисленный глутатион (GSSG) восстанавливается NАDРН-зависимой глутатионредуктазой. Восстановление NАDР для этой реакции обеспечивают окислительные реакции пентозофосфатного пути (см. раздел 7).
Г. Нарушения метаболизма эритроцитов
Энзимопатии, обусловливающие гемолиз эритроцитов. Для эффективного обезвреживания активных форм кислорода, образующихся в эритроцитах, необходимы все перечисленные выше ферментативные системы защиты. Однако у людей обнаружено около 3000 генетических дефектов глюкозо-6-фосфатдегидрогеназы. Этот фермент катализирует скорость-лимитирующую реакцию пентозофосфатного пути окисления глюкозы, которая обеспечивает образование NАDРН + Н+. Как известно, от количества NАDР + Н+ зависит активность глутатионредуктазы и глутатионпероксидазы — ферментов, разрушающих пероксид водорода. Не менее 100 млн
человек, у которых активность этого фермента снижена, являются носителями дефектных генов глкжозо-6-фосфатдегидрогеназы. При приёме некоторых лекарств, являющихся сильными окислителями (антималярийного препарата примахина, сульфаниламидов), у пациентов, имеющих генетические дефекты глюкозо-6-фосфатдегидрогеназы или глутатионредуктазы, глутатионовой защиты может оказаться недостаточно. Активные формы кислорода вызывают образование гидроперекисей ненасыщенных жирных кислот фосфолипидов, входящих в состав клеточных мембран, их разрушение и гемолиз эритроцитов.
Генетический дефект любого фермента гликолиза приводит к уменьшению образования АТФ и NАDН + Н+ в этих клетках. Вследствие снижения скорости синтеза АТФ падает активность Nа+, К+-АТФ-азы, повышается осмотическое давление и возникает осмотический шок. Дефицит NАDН + Н+ приводит к накоплению метгемоглобина и увеличению образования активных форм кислорода, вызывающих окисление SН-групп в молекулах гемоглобина. Молекулы метгемоглобина образуют дисульфидные связи между протомерами и агрегируют с образованием телец Хайнца (рис. 14-5).
Рис. 14-5. Схема образования телец Хайнца— агрегация гемоглобина. В норме супероксиддисмутаза катализирует образование пероксида водорода, который под действием глутатионпероксидазы превращается в Н2O. При недостаточной активности ферментов обезвреживания активных форм кислорода между протомерами метгемоглобина образуются дисульфидные связи, и они агрегируют.
Гемоглобинопатии
Серповидноклеточная анемия — тяжёлое наследственное заболевание, обусловленное точечной мутацией гена, кодирующего структуру β-цепи гемоглобина (см. раздел 4). В результате в эритроцитах больных присутствует НbS, β-цепи которого в шестом положении вместо гидрофильной глутаминовой кислоты содержат гидрофобную аминокислоту валин. Появление гидрофобной аминокислоты недалеко от начала молекулы способствует возникновению нового центра связывания, поэтому при низком парциальном давлении кислорода тетрамеры дезокси-НbS ассоциируют, образуя длинные микротрубчатые образования, которые полимеризуются внутри эритроцитов. Полимеризация приводит к нарушению структуры эритроцитов, они приобретают серповидную форму и легко разрушаются. При этом заболевании отмечают анемию, прогрессирующую слабость, отставание в развитии и желтуху.
Носители гена серповидноклеточной анемии чаще всего встречаются среди африканского населения, так как они приобретают некоторое преимущество при заболевании малярией, часто встречающейся в странах с тропическим климатом. Причина сохранения гена серповидноклеточной анемии в популяции связана с тем, что в эритроцитах гетерозигот хуже развивается малярийный плазмодий, часть жизненного цикла которого проходит в эритроцитах человека. В связи с этим гетерозиготные носители дефектного гена выживали при эпидемиях малярии, однако четверть их потомства погибала от серповидноклеточной анемии.
Талассемии — наследственные заболевания, обусловленные отсутствием или снижением скорости синтеза α- или β-цепей гемоглобина. В результате несбалансированного образования глобиновых цепей образуются тетрамеры гемоглобина, состоящие из одинаковых протомеров. Это приводит к нарушению основной функции гемоглобина — транспорту кислорода к тканям. Нарушение эритропоэза и ускоренный гемолиз эритроцитов и клеток- предшественников при талассемиях приводит к анемии.
При β-талассемии не синтезируются β-цепи гемоглобина. Это вызывает образование нестабильных тетрамеров, содержащих только серели. При этом заболевании в костном мозге из-за преципитации нестабильных α-цепей усиливается разрушение эритробластов, а ускорение разрушения эритроцитов в циркулирующей крови приводит к внутрисосудистому гемолизу. Как известно, для образования фетального гемоглобина β-цепи не требуются (см. раздел 4), поэтому клинически β-талассемия не проявляется до рождения, после чего происходит переключение синтеза НbF на НbА.
В случае α-талассемии недостаток образования α-глобиновых цепей приводит к нарушению образования НbF у плода. Избыточные y-цепи образуют тетрамеры, называемые гемоглобином Барта. Этот гемоглобин при физиологических условиях имеет повышенное сродство к кислороду и не проявляет кооперативных взаимодействий между протомерами. В результате гемоглобин Барта не обеспечивает развивающийся плод необходимым количеством кислорода, что приводит к тяжёлой гипоксии. При α-талассемии отмечают высокий процент внутриутробной гибели плода. Выжившие новорождённые при переключении с у- на β-ген синтезируют β-тетрамеры или НbН, который, подобно гемоглобину Барта, имеет слишком высокое сродство к кислороду, менее стабилен, чем НbА и быстро разрушается. Это ведёт к развитию у больных тканевой гипоксии и к смерти вскоре после рождения.
Наследственный сфероцитоз. Причиной этой патологии чаще всего является дефект белков цитоскелета эритроцитов — спектрина или ан- кирина, которые обеспечивают поддержание двояковогнутой формы клетки и эластичности мембраны. Эритроциты приобретают шарообразную форму, что приводит к уменьшению площади их поверхности и снижению скорости газообмена. Потеря эластичности клеточной мембраны приводит к повышению хрупкости и травматичности клеток и, как следствие, к ускорению их разрушения в сосудистом русле и селезёнке. Заболевание сопровождается анемией и желтухой. Удаление селезёнки (спленэктомия) при наследственном сфероцитозе улучшает состояние больных, так как предотвращает разрушение сфероцитов в селезёнке.
Мегалобластная (макроцитарная) анемия развивается при дефиците фолиевой кислоты или витамина В12.
Фолиевая кислота в виде кофермента (Н4-фолата) участвует в синтезе нуклеотидов. Недостаток фолиевой кислоты приводит к снижению скорости синтеза ДНК в быстроделящихся клетках, и в первую очередь в предшественниках эритроцитов. Клетки дольше пребывают в интерфазе, синтезируя гемоглобин, и становятся крупнее. Кроме того, из-за недостатка нуклеотидов они реже делятся, и количество эритроцитов снижается, а крупные мегалобласты быстрее разрушаются. Всё это в конечном итоге приводит к развитию анемии.
Аналогичная симптоматика развивается при недостатке в организме витамина В12. Этот витамин участвует в переносе метальной группы с N5-метил-Н4-фолата на гомоцистеин с образованием метионина и Н4-фолата (см. раздел 10). Недостаточность витамина В12 приводит к накоплению N5-метил-Н4-фолата в клетках. Дефицит Н4-фолата приводит к нарушению деления клеток и развитию анемии.