Підручник - БІОЛОГІЧНА ХІМІЯ - Губський Ю.І. - 2000
Розділ II. ЗАГАЛЬНІ ЗАКОНОМІРНОСТІ МЕТАБОЛІЗМУ
ГЛАВА 9. БІОЕНЕРГЕТИЧНІ ПРОЦЕСИ: ТРАНСПОРТ ЕЛЕКТРОНІВ; ОКИСНЕ ФОСФОРИЛЮВАННЯ В МІТОХОНДРІЯХ
9.2. ФЕРМЕНТИ БІОЛОГІЧНОГО ОКИСЛЕННЯ
1. Дегідрогенази, залежні від нікотинамідних коферментів (НАД(Ф)-залежні дегідрогенази).
Коферментами цих дегідрогеназ є нуклеотиди НАД+ або НАДФ+, у структурі молекул яких міститься похідне піридину — нікотинамід (глава 6).
Зв’язок між НАД+ (або НАДФ+) та білковою частиною ферменту (апоферментом) у складі піридинзалежних дегідрогеназ нестійкий: він утворюється та руйнується в процесі каталітичного циклу, що дозволяє вважати нікотинамідні нуклеотиди скоріше субстратами, ніж простетичними групами.
Реакції, що каталізуються НАД(Ф)-залежними дегідрогеназами, можуть бути зображені в загальному вигляді такими рівняннями:
![]()
Активною структурою в молекулі НАД+ або НАДФ+, що акцептує відновлювальні еквіваленти від субстрату, є піридинове кільце никотинаміду. У ході ферментативної реакції субстрат відщеплює два атоми водню (2Н+ + 2е-), один з яких у формі гідрид-іону: Н- (тобто Н+ + 2е-) приєднується до піридинового кільця НАД(Ф)+, а другий у вигляді протону (іону Н+) надходить у реакційне середовище:
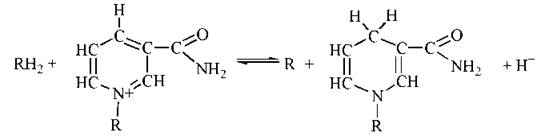
Як свідчить наведене рівняння, під час реакції до четвертого вуглецевого атома нікотинаміду приєднується атом водню (тобто Н+ + е-), а додатковий електрон гідрид-іону взаємодіє з азотом піридинового кільця. В подальшому викладенні тексту відновлені форми нікотинамідних коферментів (системи НАД(Ф)Н + Н+) для спрощення будуть в деяких випадках позначатися як НАД(Ф)Н.
Дегідрогенази, залежні від нікотинамідних коферментів, дуже поширені в живих клітинах. Вони виконують функції анаеробних дегідрогеназ, що відщеплюють протони та електрони від багатьох субстратів, відновлюючи НАД+ або НАДФ+, передаючи в подальшому відновлювальні еквіваленти на інші акцептори.
НАД-залежні дегідрогенази — ці ферменти каталізують окислювально-відновлювальні реакції, що містяться на окислювальних шляхах метаболізму — гліколізу, циклу лимонної кислоти, β-окислення жирних кислот, окисного дезамінування амінокислот, дихального ланцюга мітохондрій.
НАДФ-залежні дегідрогенази — ці ферменти беруть участь у процесах відновлювального синтезу, що відбуваються в цитозолі, зокрема постачають атоми водню при синтезі жирних кислот та стероїдів. Головним джерелом відновленого НАДФ є дегідрогеназні реакції пентозофосфатного шляху окислення глюкози.
2. Флавінзалежні дегідрогенази.
Дегідрогенази цього типу за хімічною природою є флавопротеїнами, простетичними групами, в яких є флавінаденіндинуклеотид (ФАД) та флавінмононуклеотид (ФАД) (будову див. главу 6).
На відміну від піридинзалежних дегідрогеназ, у більшості флавінзалежних ферментів коферменти (ФАД та ФМН) міцно зв’язані з білковою частиною і не відщеплюються від неї на жодній стадії каталітичного циклу. Виключенням є ФАД-залежна оксидаза D-амінокислот, у складі якої білок має низьку спорідненість із коферментом.
Загальні рівняння окислення субстратів за участю флавінзалежних дегідрогеназ:
![]()
Активною частиною молекули ФАД або ФМН, що бере участь в окислювально-відновлювальній реакції, є ізоалоксазинове кільце рибофлавіну, яке акцептує два атоми водню (2Н+ + 2е-) від субстрату:
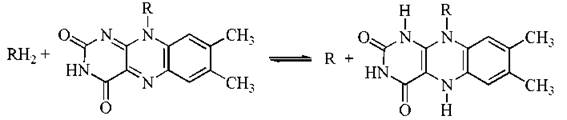
У процесах біологічного окислення певні флавопротеїнові ферменти відіграють роль як анаеробних, так і аеробних дегідрогеназ.
Флавопротеїни — анаеробні дегідрогенази:
- НАДН-дегідрогеназа — ФМН-залежний компонент внутрішньої мембрани мітохондрій; виконує функцію колектора електронів, що забирає їх від НАДН і передає на більш електропозитивні компоненти дихального ланцюга мітохондрій;
- сукцинатдегідрогеназа — ФАД-залежний фермент циклу трикарбонових кислот, що окислює янтарну кислоту;
- дигідроліпоїлдегідрогеназа — ФАД-залежний фермент, що бере участь в окислювальному декарбоксилюванні піровиноградної кислоти;
- ацил-КоА-дегідрогеназа — ФАД-залежний фермент системи в-окислення жирних кислот;
- гліцерол-3-фосфат-дегідрогеназа — ФАД-залежний фермент, що окислює гліцерол-3-фосфат у мітохондріях.
Флавопротеїни — аеробні дегідрогенази.
- дегідрогеназа (оксидаза) L-амінокислот — ФМН-залежний фермент нирок, специфічний до природних L-амінокислот;
- ксантиноксидаза (ксантиндегідрогеназа) — ФАД-залежний фермент, який окислює пурини до сечової кислоти;
- глюкозоксидаза — ФАД-залежний рослинний фермент, що використовується для кількісного визначення глюкози в біологічних рідинах.
3. Цитохроми.
Цитохроми — залізовмісні білки мітохондрій, що належать до класу гемопротеїнів. У цитохромах іон заліза входить до складу металопорфіринового комплексу (гемінове залізо), близького за хімічною структурою до простетичних груп гемоглобіну та міоглобіну.
За рахунок оберненої зміни валентності гемінового заліза цитохроми виконують функцію транспорту електронів у ланцюгах біологічного окислення в аеробних клітинах:
![]()
Залежно від характерних особливостей спектрів поглинання, розрізняють три класи цитохромів (a, b, c). У мітохондріях еукаріотів наявні п’ять різновидів цитохромів — b, c, c1, a, a3; в ендоплазматичному ретикулумі гепатоцитів містяться цитохроми Р-450 та b5, що беруть участь у реакціях окислювального гідроксилювання.