Підручник - БІОЛОГІЧНА ХІМІЯ - Губський Ю.І. - 2000
Розділ III. МЕТАБОЛІЗМ ОСНОВНИХ КЛАСІВ БІОМОЛЕКУЛ
ГЛАВА 11. МЕТАБОЛІЗМ ВУГЛЕВОДІВ. I. АЕРОБНЕ ТА АНАЕРОБНЕ ОКИСЛЕННЯ ГЛЮКОЗИ
11.3. ГЛІКОЛІЗ: РЕАКЦІЇ, ЕНЕРГЕТИКА, РЕГУЛЯЦІЯ
Загальна характеристика гліколізу
Гліколіз (шлях Ембдена-Мейергофа) — центральний шлях катаболізму глюкози, сукупність ферментативних реакцій, в результаті яких шостивуглецева молекула глюкози C6H12O6розщеплюється до двох тривуглецевих молекул піровиноградної або молочної кислоти. Гліколіз є шляхом катаболізму глюкози, в якому кисень не бере безпосередньої участі, проте, за рахунок наявності в гліколізі окислювально-відновлювальних реакцій, у результаті гліколітичного розщеплення глюкози генерується дві молекули АТФ.

Рис. 11.1. Ембден (Embden) Густав (1874-1933). німецький біохімік. Професор та завідувач кафедри біохімії, ректор ун-ту у Франкфурті-на-Майні.

Рис. 11.2. Мейєргоф (Meyerhoff) Отто (18741951), німецький біохімік. Працював у Німеччині, США. Нобелівська премія (1922).
Гліколіз є різновидом бродіння — біохімічного процесу, за рахунок якого забезпечують свою потребу в енергії у формі АТФ більшість існуючих на Землі анаеробних організмів або аеробів при функціонуванні в умовах недостатнього забезпечення молекулярним киснем. Поширеним типом бродіння в анаеробів є утворення з глюкози етилового спирту — процес, що каталізується ферментами дріжджів і широко використовується для виробництва алкогольних напоїв:
![]()
В організмі людини та тварин розрізняють:
- аеробний гліколіз, що супроводжується утворенням з однієї молекули глюкози двох молекул піровиноградної кислоти (пірувату):
![]()
Аеробний гліколіз можна також розглядати як проміжний (гліколітичний) етап аеробного окислення глюкози до кінцевих продуктів — двоокису вуглецю та води (див. п. 11.2);
- анаеробний гліколіз, що супроводжується утворенням з однієї молекули глюкози двох молекул молочної кислоти (лактату):
![]()
Для більшості тканин людини та вищих тварин в умовах нормальної життєдіяльності характерний аеробний гліколіз, тобто утворення з глюкози пірувату, який у подальшому окислюється до вуглекислого газу й води. Анаеробний гліколіз має місце переважно в м’язах при інтенсивній фізичній діяльності, тобто при відносній кисневій недостатності, та в деяких високоспеціалізованих клітинах (зокрема, в еритроцитах, в яких відсутні мітохондрії) або за певних патологічних умов (клітини злоякісних пухлин).
Реакції гліколізу перебігають у цитозолі клітини і каталізуються ферментами, що локалізовані в цьому компартменті.
Виділяють дві стадії гліколізу:
1. Розщеплення молекули глюкози до двох молекул фосфотріоз (гліцеральдегід-3-фосфату та діоксіацетонфосфату). Ця стадія включає в себе послідовність реакцій, які потребують витрати двох молекул ATP на кожну молекулу глюкози, що розщеплюється.
2. Перетворення двох молекул фосфотріоз на дві молекули пірувату (або лактату). Ця стадія включає в себе окислювально-відновлювальні реакції («гліколітична оксидоредукція»), які супроводжуються генерацією чотирьох молекул ATP.
Таким чином, у результаті розщеплення однієї молекули глюкози в реакціях аеробного або анаеробного гліколізу сумарний вихід АТР складає дві молекули, що можна подати таким рівнянням:
![]()
Ферментативні реакції гліколізу
Реакції аеробного та анаеробного гліколізу повністю співпадають на першій стадії розщеплення глюкози і розрізняються лише після утворення пірувату, який для аеробного гліколізу є кінцевим продуктом, а для анаеробного — метаболітом, який відновлюється до лактату. Крім того, анаеробний та аеробний типи гліколізу розрізняються за метаболічною часткою відновленого НАД+(НАДН), що утворюється на етапі гліколітичної оксидоредукції.
Ферментативні реакції аеробного гліколізу:
1. Активація молекули глюкози шляхом її фосфорилювання до фосфорного ефіру— глюкозо-6-фосфату. Джерелом фосфату в реакції є молекула АТФ:
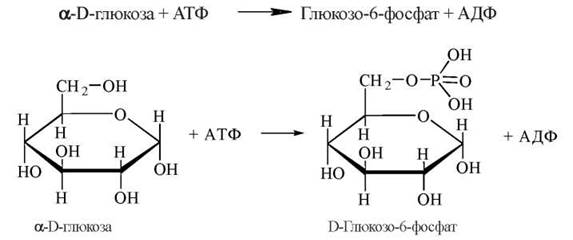
Ця реакція каталізується ферментом гексокіназою, що найбільш активна в м’язовій тканині. У клітинах печінки в утворенні глюкозо-6-фосфату з вільної молекули глюкози значну роль відіграє також фермент глюкокіназа. Гексокіназа здатна фосфорилювати різні гексози. Глюкокіназа специфічна для глюкози, проте її активність проявляється лише при концентраціях глюкози в крові, що перевищують фізіологічний рівень глікемії (аліментарна гіперглікемія, цукровий діабет).
2. Перетворення (ізомеризація) глюкозо-6-фосфату у фруктозо-6-фосфат:
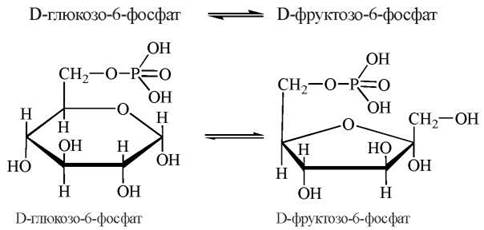
Реакція каталізується ферментом фосфогексоізомеразою і є зворотною, тобто легко перебігає в обох напрямках залежно від переважної концентрації субстрату (глюкозо-6-фосфату або фруктозо-6-фосфату, відповідно). У фізіологічних умовах рівновагу реакції зсунуто праворуч у зв’язку з використанням фруктозо-6-фосфату в подальших реакціях гліколізу.
3. Фосфорилювання фруктозо-6-фосфату з утворенням фруктозо-1,6-дифосфату. Джерелом фосфату, як і в 1-й реакції гліколізу, є молекула АТФ.
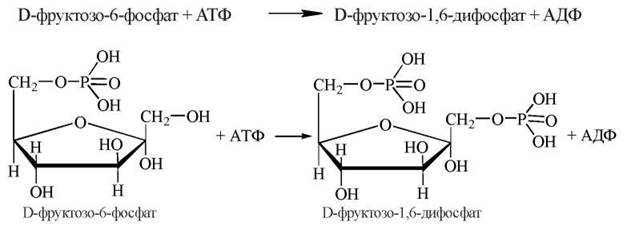
Ферментом, що каталізує цю реакцію, є фосфофруктокіназа, яка належить до регуляторних ферментів гліколізу з алостеричним механізмом регуляції.
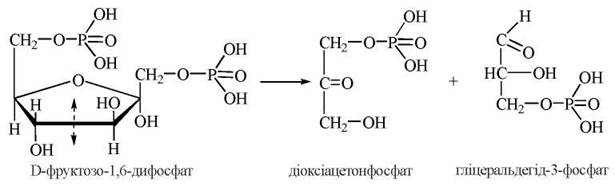
4. Розщеплення фруктозо-1,6-дифосфату на дві молекули фосфотріоз шляхом розриву ковалентного -С-С-зв’язку між 3-м та 4-м атомами вуглецю в шести- вуглецевому ланцюзі фруктозо-1,6-дифосфату.
Реакція каталізується ферментом фруктозо-1,6-дифосфатальдолазою (альдолазою). У результаті альдолазної реакції утворюються діоксіацетонфосфат (ДОАФ) та гліцеральдегід-3-фосфат (Г-3-Ф):
![]()
5. Взаємоперетворення двох фосфогріоз (ДОАФ та Г-3-Ф), що каталізується ферментом тріозофосфатізомеразою:
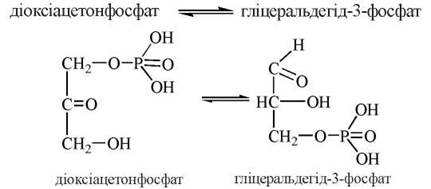
Оскільки за фізіологічних умов рівновагу даної реакції зсунуто праворуч у зв’язку з використанням у подальших реакціях гліколізу саме гліцеральдегід-3-фосфату, сумарним результатом зазначених п’яти реакцій розщеплення глюкози є перетворення однієї молекули глюкози на дві молекули Г-3-Ф:
![]()
6. Окислення гліцеральдегід-3-фосфату до 3-фосфогліцеринової кислоти (3-ФГК). Цей процес (гліколітична оксидоредукція) складається з двох етапів, що каталізуються окремими ферментами:
6.1. Окислення гліцеральдегід-3-фосфату до 1,3-дифосфогліцерату (1,3-дифосфогліцеринової кислоти — 1,3-диФГК).
Реакція каталізується ферментом гліцеральдегід-3-фосфатдегідрогеназою, коферментом якого є НАД+, що акцептує відновлювальні еквіваленти (електрони) від альдегідної групи Г-3-Ф. У реакції бере також участь неорганічний фосфат:
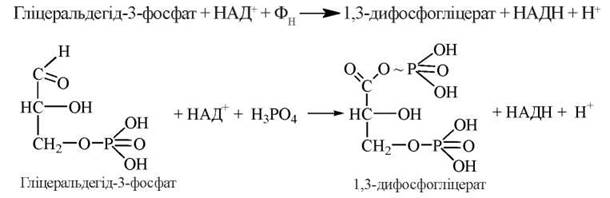
1,3-диФГК, що утворилася, є мішаним ангідридом фосфорної та 3-фосфогліцеринової кислот (ацилфосфат) і містить у своєму складі макроергічний фосфатний зв’язок, тобто 1,3-диФГК — це сполука з високим потенціалом переносу фосфатної групи (див. главу 8).
Другим продуктом гліцеральдегід-3-фосфатдегідрогеназної реакції є НАДН («гліколітичний НАДН»), який в аеробних умовах передає свої відновлювальні еквіваленти на внутрішньомітохондріальний НАД+ та, послідовно, на мітохондріальний ланцюг електронного транспорту, генеруючи при цьому в результаті окисного фосфорилювання три молекули АТФ.
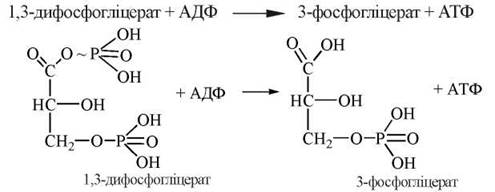
6.2. Перетворення 1,3-дифосфогліцерату на 3-фосфогліцерат (3-фосфогліцеринову кислоту — 3-ФГК).
Ця реакція супроводжується перенесенням макроергічної фосфатної групи від 1,3-диФГК на АДФ з утворенням молекули АТФ і каталізується ферментом фосфогліцераткіназою:
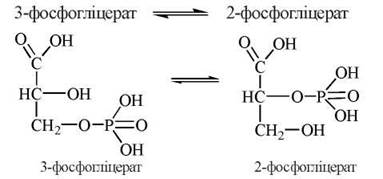
7. Перетворення 3-фосфогліцерату на 2-фосфогліцерат (2-фосфогліцеринову кислоту — 2-ФГК).
Реакція каталізується ферментом фосфогліцеромутазою:
8. Дегідратація 2-фосфогліцерату з утворенням фосфоенолпірувату (ФЕП).
Реакція каталізується ферментом енолазою:
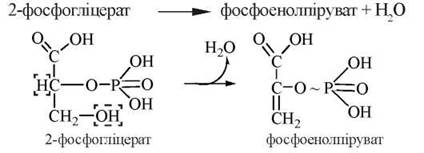
Ця реакція є другою в ході гліколізу, в результаті якої генерується макроергічний зв’язок (в молекулі ФЕП).
9. Утворення з фосфоенолпірувату пірувату.
Реакція каталізується ферментом піруваткіназою і супроводжується перенесенням макроергічної фосфатної групи від молекули ФЕП на АДФ:
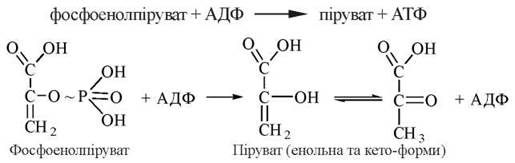
Піруваткіназна реакція є заключною для аеробного гліколізу. В її результаті утворюються дві молекули пірувату та дві молекули АТФ (на кожну молекулу глюкози, яка стає на шлях гліколітичного розщеплення). Піруваткіназа, як і фосфофруктокіназа, є регуляторним ферментом, на рівні якого здійснюється регуляція гліколізу.
Ферментативні реакції анаеробного гліколізу
Як свідчать зазначені вище реакції, в аеробних умовах кінцевим продуктом гліколізу в тваринних тканинах є піруват; при цьому НАДН, що утворився в результаті окислення гліцеральдегід-3-фосфату, реокислюється в мітохондріях за рахунок молекулярного кисню. За умов анаеробного гліколізу (наприклад, в інтенсивно працюючих скелетних м’язах або в молочнокислих бактеріях) гліколітичний НАДН не віддає свої відновлювальні еквіваленти в дихальний ланцюг мітохондрій, а використовується для відновлення пірувату до L-лактату:
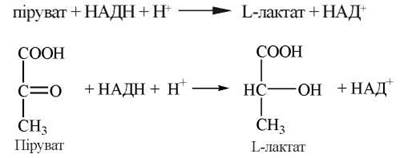
Реакція каталізується ферментом лактатдегідрогеназою, яка існує у вигляді п’яти різних ізоферментних форм (ЛДГ1—ЛДГ5), що відрізняються за своїми кінетичними властивостями (KM, Vmax, ступенем алостеричного інгібірування піруватом).
Загальну послідовність ферментативних реакцій гліколізу подано на рис. 11.3.
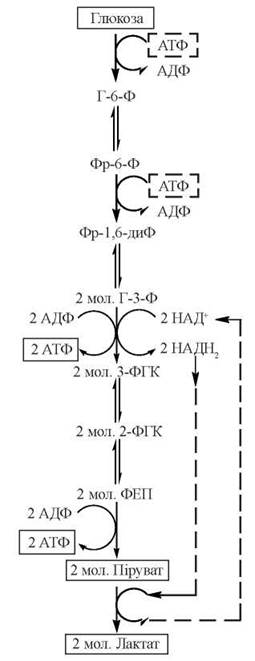
Рис. 11.3. Метаболічна карта гліколізу.
Таким чином, ферментативні реакції анаеробного гліколізу майже повністю співпадають із реакціями аеробного гліколізу, відрізняючись лише на етапі, що відбувається після утворення пірувату: при аеробному гліколізі піруват є субстратом перетворення на ацетилкоензим А та подальшого окислення (див: Аеробне окислення глюкози), а при анаеробному гліколізі піруват відновлюється до лактату за рахунок НАДН, що утворився в реакціях гліколітичної оксидоредукції. Інакше кажучи, після утворення пірувату подальше його перетворення може відбуватися за одним із двох альтернативних шляхів, що залежать від стану окислювально-відновлювальних процесів у певній тканині:
- в аеробних умовах відбувається окисне декарбоксилювання пірувату до ацетил-КоА, який у подальшому окислюється до СО2 та Н2О в циклі Кребса; НАДН, що утворився при окисленні гліцеральдегід-3-фосфату, віддає свої відновлювальні еквіваленти на дихальний ланцюг мітохондрій через спеціальні човникові механізми;
- в анаеробних умовах (або в умовах гіпоксії) реокислення гліколітичного НАДН відбувається за рахунок дії лактатдегідрогенази, яка відновлює піруват до лактату; течія лактатдегідрогеназної реакції в даному напрямку генерує НАД+, що знову використовується для окислення гліцеральдегід-3-фосфату і подальшого накопичення лактату як продукту анаеробного гліколізу. Така послідовність реакцій найбільш характерна для інтенсивно працюючих скелетних м’язів; крім скелетних м’язів та еритроцитів, клітини деяких інших органів та тканин (головного мозку, шлунково-кишкового тракту, мозкового шару нирок, сітківки та шкіри) частково задовольняють свої енергетичні потреби за рахунок анаеробного гліколізу, утворюючи молочну кислоту.
Взаємовідношення між аеробним окисленням глюкози, аеробним та анаеробним гліколізом подано на рис. 11.4.
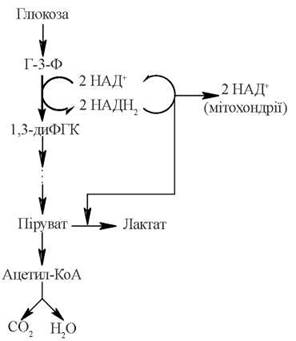
Рис. 11.4. Взаємовідношення між аеробним окисленням глюкози, аеробним та анаеробним гліколізом.
Човникові механізми окислення НАДН
Мембрани мітохондрій непроникні для НАДН, тому гліколітичний НАДН, що утворюється в цитозолі, не може безпосередньо окислюватися НАДН-дегідрогеназою мітохондріального електронотранспортного ланцюга. Для окислення цитозольного НАДН існують човникові системи, що транспортують відновлю- вальні еквіваленти від цієї сполуки до мітохондрій непрямим шляхом. Сутність цих процесів полягає в тому, що гліколітичний НАДН у цитозолі відновлює певний метаболіт, який здатний проникати через внутрішню мітохондріальну мембрану в матрикс мітохондрій, де він окислюється, відновлюючи внутрішньомітохондріальний НАД+, і знову повертається до цитозолю.
Транспорт цитозольного (гліколітичного) водню в мітохондрії здійснюється малат-аспартатною та гліцерофосфатною човниковими системами.
Малат-аспартатна човникова система — сутність її полягає у відновленні за рахунок водню системи (НАДН+ + Н+) оксалоацетату до малату (цитозольна реакція) з подальшим транспортом малату всередину мітохондрії і повторним його окисленням до оксалоацетату з відновленням НАД+ (мітохондріальна реакція); зворотний транспорт оксалоацетату в цитозоль здійснюється після його перетворення до аспартату (зворотна реакція трансамінування) — рис. 11.5.
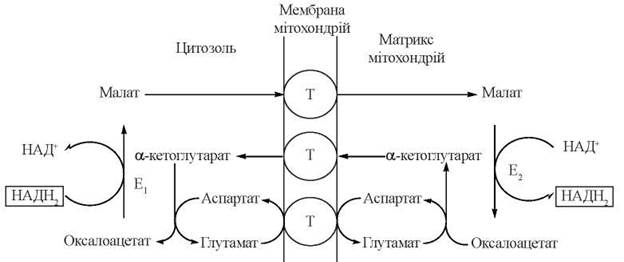
Рис. 11.5. Малат-аспартатний шунт транспорту відновлювальних еквівалентів гліколітичного НАДН+ в мітохондрії. Е1, Е2 - мітохондріальний та цитоплазматичний ізоферменти малатдегідрогенази; Т - транслокази мітохондріальних мембран.
Гліцерофосфатна човникова система функціонує шляхом відновлення (за рахунок гліколітичного водню) діоксіацетонфосфату до гліцерол-3-фосфату (цитозольний процес), транспорту гліцерол-3-фосфату всередину мітохондрії та його окислення в дихальному ланцюзі до діоксіацетонфосфату, який знову повертається в цитозоль.
Регуляція гліколізу
Регуляція гліколізу здійснюється за рахунок впливу негативних та позитивних модуляторів (інгібіторів, активаторів) на каталітичну активність регуляторних ферментів, що каталізують незворотні реакції гліколізу:
- гексокінази — для ферменту м’язів алостеричним інгібітором є продукт реакції глюкозо-6-фосфат;
- фосфофруктокінази — інгібіторами є метаболіт трикарбонового циклу цитрат та АТФ; активаторами — субстрат ферменту фруктозо-6-фосфат та АМФ; висока інтенсивність окислювальних процесів, що характеризується накопиченням у клітині субстратів ЦТК та АТФ, сприяє за рахунок даного механізму збереженню пулу глюкози; фосфофруктокіназа є швидкість-лімітуючоюреакцією гліколізу;
- піруваткінази — фермент інгібується АТФ, а також субстратами циклу лимонної кислоти — ацетил-КоА та жирними кислотами, що забезпечує гальмування гліколізу в умовах високої інтенсивності окислювальних процесів; печінкова ізоформа піруваткінази регулюється за допомогою ковалентної модифікації — цАМФ-залежного фосфорилювання (дефосфорильована форма активна, фосфорильована — неактивна); крім того, піруваткіназа гепатоцитів є індукованим ферментом, синтез якого стимулюється в умовах підвищеного надходження з їжею вуглеводів та зростання рівня інсуліну.
Гальмування реакцій гліколізу за рахунок пригнічення в умовах активного клітинного дихання каталітичних активностей фосфофруктокінази та піруваткінази є молекулярною основою ефекту Пастера.