Підручник - БІОЛОГІЧНА ХІМІЯ - Губський Ю.І. - 2000
Розділ I. БІОМОЛЕКУЛИ ТА КЛІТИННІ СТРУКТУРИ
ГЛАВА 2. БІЛКИ І ПЕПТИДИ
2.3. РІВНІ СТРУКТУРНОЇ ОРГАНІЗАЦІЇ БІЛКОВИХ МОЛЕКУЛ
Усі білки та пептиди мають унікальну тримірну просторову організацію (конформацію), що є структурною основою їх специфічної біологічної функції.
Високовпорядковані конформації білкових молекул створюються на основі поліпептидних ланцюгів, що мають ковалентну структуру, та стабілізуються за рахунок утворення між амінокислотними залишками певних пептидних ділянок слабких фізико-хімічних зв’язків і взаємодій.
Типи зв’язків у білкових молекулах
1. Ковалентні зв’язки.
1.1. Пептидні зв’язки — виникають внаслідок взаємодії α-карбоксильних та α-аміногруп амінокислот, що утворюють пептидний ланцюг.
1.2. Дисульфідні зв’язки (-S-S-) — утворюються між залишками молекул цистеїну, що входять до одного або різних пептидних ланцюгів.
2. Нековалентні зв’язки та слабкі взаємодії — фізико-хімічні зв’язки, що беруть участь у взаємодії як певних частин одного пептидного ланцюга, так і різних, близько розташованих ланцюгів, утворюючи вищі рівні конформації білкових молекул.
2.1. Водневі зв’язки — виникають між двома електронегативними атомами за рахунок атома водню, ковалентно зв’язаного з одним із електронегативних атомів. Вони найчастіше утворюються між воднем, що входить до складу груп =NH, -OH, -SH, та сусіднім атомом кисню, наприклад:
![]()
2.2. Іонні зв’язки — зв’язують між собою іонізовані амінні та карбоксильні групи (головним чином, бічних радикалів діаміно- та дикарбонових амінокислот).
2.3. Дипольні зв’язки — електростатичні взаємодії постійних чи індукованих диполей, які можуть утворюватися між радикалами полярних амінокислот (серину, треоніну, цистеїну, тирозину тощо), що входять до складу білкових молекул.
2.4. Гідрофобні взаємодії — слабкі взаємодії, що виникають між бічними радикалами таких амінокислот, як валін, лейцин, ізолейцин, фенілаланін тощо за рахунок їх «виштовхування» з полярної (звичайно, водної) фази.
Рівні структурної організації білків
Первинна структура білків
Під первинною структурою білків розуміють пептидний (поліпептидний) ланцюг, побудований із залишків L-амінокислот. У поняття первинної структури білка або пептиду входять його якісний та кількісний амінокислотний склад та порядок чергування (послідовність) окремих амінокислотних залишків.
Фрагмент первинної структури поліпептидного ланцюга із структурними параметрами, що встановлені на підставі рентгеноструктурного аналізу пептидів, представлено на рис. 2.4.
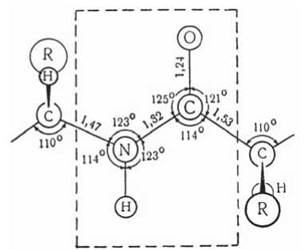
Рис. 2.4. Параметри структурних елементів поліпептидного ланцюга (розміри подано в ангстремах; 1Å = 0,1 нм).
Крім пептидних зв’язків, первинну структуру білків створюють також дисульфідні зв’язки, що з’єднують певні ділянки поліпептидного ланцюга або окремі пептиди.
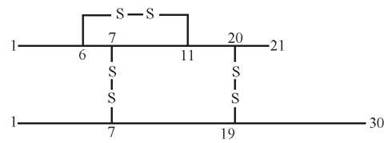
Прикладом може бути розміщення дисульфідних зв’язків у молекулі білкового гормону інсуліну, яка складається з двох пептидних ланцюгів (А-ланцюг — 21 амінокислотний залишок та В-ланцюг — 30 залишків):
Назви пептидів, що визначають їх первинну структуру, будуються таким чином:
а) першим вказується залишок амінокислоти, що має вільну α-аміногрупу (так званої «N-кінцевої амінокислоти»);
б) у назвах усіх амінокислот, що беруть участь в утворенні пептидного зв’язку α-карбоксильною групою, закінчення -ин (-ін) змінюється на -іл (-іл);
в) амінокислота, що має вільну α-карбоксильну групу («С-кінцева амінокислота»), свого закінчення (-ин (-ін)) не змінює.
Приклад назви пептиду аланіл-гліцил-метіоніл-серин:
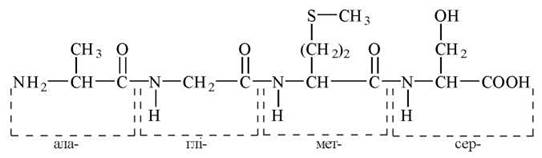
За допомогою міжнародних скорочених символів цей тетрапептид може бути позначений так:
Ala - Gly - Met - Ser
Ці скорочені записи пептидів мають особливе значення для позначення білків, до первинної структури яких входить багато сотень амінокислотних залишків.
У зв’язку із зазначеною вище здатністю окремих функціональних груп пептидного ланцюга до внутрішньоланцюгових взаємодій, пептидний ланцюг набуває певної просторової структури (конформації). Розрізняють два рівні конформації пептидного ланцюга (та, відповідно, білкової молекули, що утворюється на його основі) — вторинну та третинну структури. Вторинну, третинну та четвертинну (див. нижче) структури називають разом вищими рівнями структурної організації білкових молекул.
Вторинна структура білків
Вторинна структура білків — це ряд конформацій, утворення яких зумовлено, головним чином, водневими зв’язками між окремими ділянками (переважно, пептидними групами) пептидного ланцюга або різними пептидними ланцюгами.
Розрізняють два основних типи впорядкованої вторинної структури білкових молекул: α-спіраль та β-структуру.
1. α-Спіраль — конформація, яка утворюється при просторовому скручуванні поліпептидного ланцюга за рахунок водневих зв’язків, що виникають між С=О- та NH-групами поліпептидного ланцюга, що віддалені одна від одної на чотири амінокислотних залишки. Водневі зв’язки в α-спіралі спрямовані паралельно до осі молекули.
α-Спіраль можна уявити собі у вигляді лінії, що йде по боковій поверхні уявного циліндра. На один оберт α-спіралі припадає 3,6 амінокислотних залишків. Напрямок обертання поліпептидного ланцюга в природних білках — правий («права» α-спіраль) (рис. 2.5).
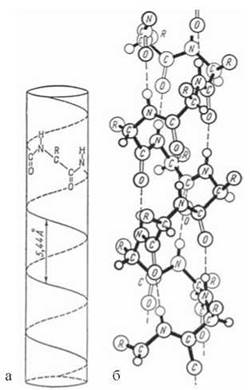
Рис. 2.5. Модель вторинної структури поліпептидного ланцюга у вигляді α-спіралі (за Л. Полінгом та Р. Корі).
Геометричні параметри а-спіралі: радіус — 0,25 нм; крок (період ідентичності) — 0,54 нм; висота зсунення на один амінокислотний залишок — 0,15 нм; на один оберт α-спіралі припадає 3,6 амінокислотних залишків.
α-Спіраль є молекулярною структурою, що утворюється за умов певних стеричних взаємовідносин між амінокислотними залишками, і її формування залежить від амінокислотного складу поліпептидного ланцюга. Окремі амінокислоти (Pro, Gly, Glu, Asp, Arg тощо) протидіють утворенню α-спіралі або дестабілізують її. У зв’язку з цим, можливе виникнення спіральних структур, що за своїми геометричними параметрами відрізняються від α-спіралі. Прикладом є спіраль білка колагену — головного білкового компонента сполучної тканини, у складі якого міститься 33 % гліцину і 21 % проліну та гідроксипроліну.
Декілька білкових молекул із вторинною структурою у вигляді спіралей можуть взаємодіяти одна з одною, утворюючи міжмолекулярні комплекси, що являють собою суперспіралізовані(«супервторинні») структури.
2. β-Структура — структура типу складчастого шару, складається із зигзагоподібно розгорнутих поліпептидних ланцюгів, що розташовані поряд (двох або більшої кількості) — рис. 2.6.
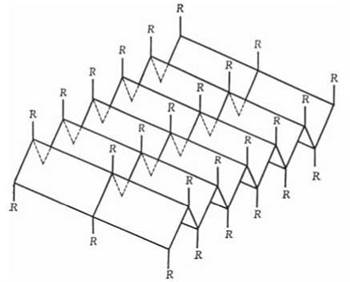
Рис. 2.6. β-Конформація поліпептидного ланцюга.
Схематично зображені три паралельних ланцюги, що утворюють структуру типу складчастого шару.
β-Структури утворюються за рахунок міжланцюгових водневих зв’язків, що з’єднують групи С=О та NH сусідніх поліпептидів (рис. 2.7):
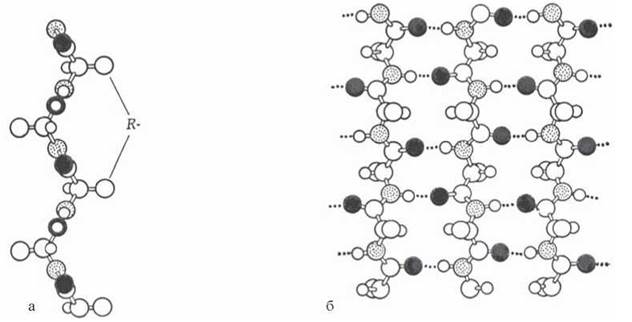
Рис. 2.7. Утворення β-структур: а - вигляд збоку; б - вигляд зверху.
β-Конформацію мають білки β-кератини, які складаються з зигзагоподібних, антипаралельно орієнтованих поліпептидних ланцюгів. Представником β-кератинів є фіброїн — фібрилярний нерозчинний білок шовку та павутиння.
Крім упорядкованих типів (α-спіралі та β-структури), вторинна структура може являти собою нерегулярну, невпорядковану (хаотичну) конформацію.
У багатьох природних білках вздовж одного поліпептидного ланцюга, що становить первинну структуру даного білка, присутні як α-спіралізовані ділянки, так і зони, що становлять складчастий шар (β-структури) або мають нерегулярну конформацію. Наприклад, у молекулі хімотрипсину до 14 % загальної кількості амінокислотних залишків входить до складу α-спіралей, 45 % — β-структур, 61 % — ділянок із невпорядкованою структурою. Поліпептидні ланцюги в молекулах міоглобіну та тропоміозину майже повністю α-спіралізовані (на 80 та 100 %, відповідно).
Третинна структура білків
Третинна структура білків являє собою спосіб укладання в тримірному просторі поліпептидного ланцюга з певною вторинною структурою. В утворенні та стабілізації третинної структури беруть участь водневі, іонні, гідрофобні зв’язки та взаємодії.
Залежно від форми та особливостей тримірної просторової організації, виділяють глобулярні та фібрилярні білки.
Глобулярні білки — білки, що мають округлу (кулеподібну, або еліпсоїдну) форму. Відношення довгої та короткої осей молекули в глобулярних білках — від 1:1 до 50:1. Це альбумін сироватки крові, міоглобін м’язів, гемоглобін, більшість ферментних білків.
Глобулярні білки побудовані з одного або декількох зв’язаних дисульфідними місточками поліпептидних ланцюгів, що згорнуті в щільні кулеподібні форми. Модель просторової структурної організації молекули міоглобіну, вперше запропоновану Дж. Кендр’ю (J. Kendrew) в 1958 р. на підставі рентгеноструктурного аналізу білкових кристалів, подано на рис. 2.8.
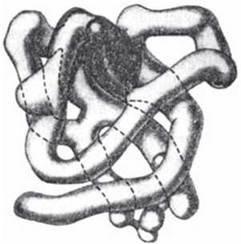
Рис. 2.8. Модель третинної структури молекули міоглобіну. Зображено просторове розташування поліпептидного ланцюга, зв’язаного з молекулою гему.
Тримірна організація глобулярних білків утворюється за рахунок просторового згортання поліпептидного ланцюга, окремі частини якого можуть містити α-спіралі, β-структури та ділянки без упорядкованої структури (див.: Вторинна структура білків).
Схему просторової конформації міоглобіну, значна частина поліпептидного ланцюга якого α-спіралізована, подано на рис. 2.9.
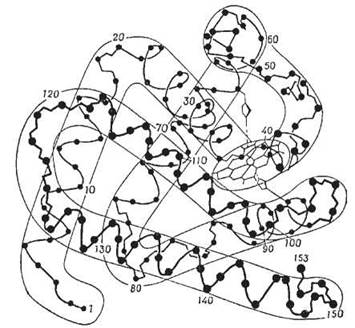
Рис. 2.9. Просторова конформація міоглобіну із зображенням характеру вторинної структури поліпептидного ланцюга.
Третинну структуру глобулярного ферментного білка гексокінази, поліпептидний ланцюг якого утворює як α-спіралі, так і складчасті шари, зображено на рис. 2.10.
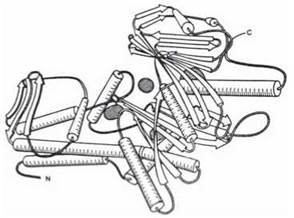
Рис. 2.10. Тримірна організація ферменту гексокінази. На цьому рисунку і на рисунку 2.13 α-спіралі умовно зображено у вигляді циліндрів, β-структури - у вигляді стрілок (за А.Я. Ніколаєвим, 1989).
Стабілізація компактної глобули реалізується за рахунок водневих та інших слабких зв’язків між бічними радикалами амінокислотних залишків, які фіксують відносно один одного певні частини поліпептидного ланцюга (або ланцюгів, з’єднаних S-S-зв’язками).
Особливістю третинної структури глобулярних білків, що визначає їх важливі фізико- хімічні та біологічні властивості, є характер розташування полярних та неполярних амінокислотних залишків. У більшості глобулярних білків полярні (гідрофільні) залишки розміщені на поверхні глобули, де вони контактують із водною фазою, тоді як неполярні радикали занурені у внутрішню гідрофобну фазу молекули. Такі особливості будови білкових глобул визначають ступінь їх розчинності, особливості взаємодії з іншими білками та лігандами різної хімічної природи.
Фібрилярні білки — білки, структурною особливістю яких є витягнута форма молекул. Вони схильні до утворення мультимолекулярних ниткоподібних комплексів — фібрил, що складаються з декількох паралельних поліпептидних ланцюгів.
Фібрилярні білки є структурними компонентами сполучної або інших опорних тканин організму. Прикладами структурних фібрилярних білків є колаген — найбільш розповсюджений білок організму людини, що становить до 30 % загальної кількості тканинних білків, еластин сполучної тканини, α-кератин опірних тканин, епідермісу шкіри, волосся.
Формування багатьох біологічно важливих фібрилярних білків відбувається шляхом утворення супервторинних (суперспіралізованих) структур, зокрема:
1. Молекули тропоколагену — структурні одиниці колагенових фібрил сполучної тканини. Молекули тропоколагену складаються з трьох поліпептидних ланцюгів (спіралей колагену), що обвиті один навколо одного за типом тугого джгута. Стабілізація тропоколагену досягається за рахунок водневих зв’язків між С=О- та NH-групами сусідніх поліпептидних ланцюгів.
2. Білки α-кератини — основний тип фібрилярних білків, з яких побудовано зовнішні захисні покриття хребцевих тварин (епідерміс шкіри, волосся, нігті людини; шерсть, пір’я, рогові утворення). α-Кератини являють собою мікрофібрили діаметром приблизно 2 нм, побудовані з трьох α-спіралізованих поліпептидних ланцюгів (суперспіраль). Окремі мікрофібрили, з’єднані міжланцюговими дисульфідними зв’язками, утворюють структури, подібні до багатожильного канату, що забезпечує міцність волосся та інших тканин, побудованих з α-кератинів.
Схему утворення фібрилярних білків за рахунок суперспіралізації окремих поліпептидних ланцюгів, що мають конформацію α-спіралі, подано на рис. 2.11.
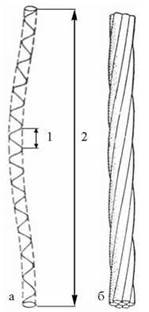
Рис. 2.11. Модель формування фібрилярних білків з окремих α-спіралізованих поліпептидів: а — поліпептидний ланцюг, що являє собою «велику » спіраль, сформовану на основі «малої» α-спіралі; в моделі, що зображена, крок «малої» спіралі (1) у 12,5 раза менший від кроку «великої» спіралі (2); б — суперспіраль типу багатожильного каната, побудована із семи α-спіралізованих поліпептидів.
Четвертинна структура білків
Четвертинна структура білків утворюється при об’єднанні (агрегації) декількох поліпептидних ланцюгів або протомерів, кожен з яких має свою характерну впорядковану конформацію.
Окремі протомери (субодиниці) в білках з четвертинною структурою об’єднані нековалентними зв’язками, що спричиняє порівняно легку їх дисоціацію при зміні фізико-хімічних властивостей середовища. Разом із тим, така дисоціація призводить до втрати специфічної для даного білка біологічної активності, яка притаманна лише цілісному олігомерному утворенню.
Прикладами білків із четвертинною структурою є олігомерні білки з м.м. вище 50 кД, що подані в табл. 2.1.
Значний фізіологічний та клінічний інтерес становить білок еритроцитів гемоглобін (Hb), що є транспортером кисню в організмі людини та вищих тварин. Він є типовим представником білків, що мають четвертинну структуру. М.м. гемоглобіну дорівнює 68 кД; його молекула побудована з чотирьох попарно однакових субодиниць — двох α- та двох β-поліпептидних ланцюгів, кожен з яких з’єднаний з небілковою сполукою гемом — порфіриновим похідним, що зв’язує молекулу кисню (рис. 2.12):
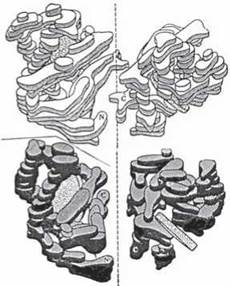
Рис. 2.12. Четвертинна структура молекули гемоглобіну.
Білки з четвертинною структурою можуть включати як однакові протомери (як у прикладі гемоглобіну), так і різні. У складі багатьох білків-ферментів містяться різні протомери, що виконують різні біохімічні функції (зокрема, каталітичну та регуляторну).
Доменні білки
Домени — структурні ділянки білкових молекул, що являють собою глобулярні утворення всередині білків із третинною структурою. Діаметр глобулярного домену дорівнює в середньому 2,5 нм; до його складу входить 100-150 амінокислотних залишків.
Окремі домени є функціонально відносно автономними утвореннями в складі білкових молекул, і доменні білки в цьому відношенні подібні до олігомерних білків. Але, на відміну від білків із четвертинною структурою (олігомерів), окремі доменні глобули утворюються тим самим поліпептидним ланцюгом і, відповідно, зв’язані між собою пептидними фрагментами («шарнірними» ділянками). Зв’язки між доменами можна розщепити тільки за допомогою протеолітичних ферментів.
Прикладами доменних білків є ферменти гліколітичного шляху окислення глюкози — гліцеральдегідфосфатдегідрогеназа та фосфогліцераткіназа (рис. 2.13), у складі яких окремі домени реалізують різні етапи складного каталітичного акту.
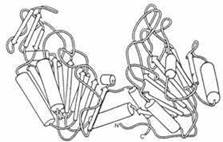
Рис. 2.13. Доменна організація ферменту фосфогліцераткінази.
Завершуючи розгляд молекулярних механізмів формування вищих рівнів структурної організації білків, необхідно зауважити, що всі високовпорядковані форми просторової конформації білкових молекул детерміновані первинною структурою поліпептидного ланцюга, тобто амінокислотною послідовністю, яка визначається генетичним кодом клітини, в якій синтезується даний білок.
Вторинна, третинна, четвертинна та доменна організації білків є результатом довільного, спонтанного формування просторових угруповань, що спрямовані на досягнення складним біофізичним утворенням, яке являє собою макромолекулу білка, термодинамічно стабільного стану (рис. 2.14).
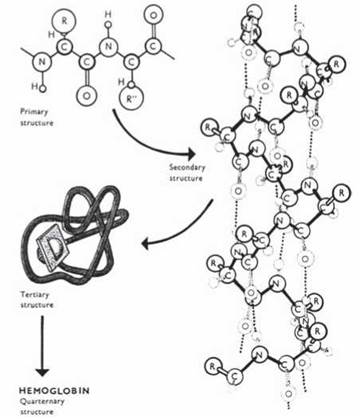
Рис. 2.14. Формування вищих рівнів структурної організації білків на основі первинної структури.