Підручник - БІОЛОГІЧНА ХІМІЯ - Губський Ю.І. - 2000
Розділ III. МЕТАБОЛІЗМ ОСНОВНИХ КЛАСІВ БІОМОЛЕКУЛ
ГЛАВА 17. МЕТАБОЛІЗМ АМІНОКИСЛОТ I. ЗАГАЛЬНІ ШЛЯХИ ПЕРЕТВОРЕННЯ
У тілі дорослої людини міститься в середньому 12-15 кг білків, що виконують численні каталітичні, регуляторні, структурні функції. Приблизно половину цієї маси (6-7 кг) складають екстрацелюлярні білки опорних тканин, серед яких перше місце за кількістю займає колаген. Другу половину білків тіла складають інтрацелюлярні білки тканин та білки крові з високою швидкістю обміну. Завдяки обміну білків у катаболічних та анаболічних реакціях, тобто безперервному перебігу процесів протеолізу та білкового синтезу, в організмі існує постійний фонд (пул) вільних амінокислот, які підлягають різноманітним біохімічним перетворенням.
17.1. ШЛЯХИ ПЕРЕТВОРЕННЯ АМІНОКИСЛОТ У ТКАНИНАХ
Подібно до інших біомолекул, білки, які входять до складу живого організму, знаходяться в стаціонарному стані постійного оновлення відбуваються розщеплення їх тканинними протеазами та синтез нових поліпептидних молекул.
Загальний пул амінокислот у тілі людини складається з потоків, які забезпечують надходження вільних амінокислот та їх використання в різноманітних анаболічних та катаболічних процесах. Сумарна кількість амінокислот, що перетворюються за добу, складає в організмі дорослої здорової людини в стані азотистої рівноваги 300-500 г, а стаціонарна їх концентрація дорівнює близько 50-100 г на масу тіла.
Потік амінокислот, що входить до амінокислотного пулу, складається з таких джерел:
1. Амінокислот, які всмоктуються ентероцитами кишечника внаслідок гідролізу харчових білків у травному каналі (шлунку, тонкому кишечнику); біохімічні процеси протеолізу білків у травному каналі будуть розглянуті окремо. Кількісне значення цієї складової становить (залежно від характеру харчування) 60-100 г на добу. Додаткову компоненту в цей потік (від 35 до 200 г білка) вносить протеоліз ендогенних білків з епітелію ентероцитів, що злущується (I. Halkerston, 1988).
2. Амінокислот, які вивільняються в результаті розщеплення власних клітинних і позаклітинних білків. Середня тривалість напівжиття (Т1/2) в індивідуальних білків значно варіює, становлячи від декількох годин для певних ферментів гепатоцитів до декількох років для структурного білка колагену.
У здорової дорослої людини середнє добове оновлення тканинних білків складає 1-2 % від загальної маси білків тіла і відбувається переважно за рахунок деградації до амінокислот білків м’язів (30-40 г білків за добу). Розщеплення тканинних білків каталізується протеазами лізосом і значно збільшується за умов білкового та повного голодування, під час виснажливих хвороб (особливо інфекційних, онкологічних захворювань), що порушують процеси біосинтезу білків і спричиняють переважання катаболічних процесів над анаболічними.
3. Амінокислот, які синтезуються в організмі. Організм людини має обмежені можливості щодо утворення амінокислот de novo: його ферментні системи здатні синтезувати з інших інтермедіатів в кількості, достатній для синтезу власних білків, лише вісім «замінних» («ненеобхідних»,»несуттєвих» — nonessential, англ.) L-амінокислот. Амінокислоти, які в організмі людини не синтезуються, надходячи тільки з продуктами харчування, є «незамінними» («необхідними», «суттєвими» — essential, англ.).
До замінних амінокислот належать: аланін, аспарагінова кислота, аспарагін, глутамінова кислота, глутамін, пролін, гліцин, серин. При біосинтезі замінних амінокислот їх вуглецева частина утворюється з інтермедіатів окислення глюкози та цитратного циклу, а аміногрупа постачається з інших амінокислот у реакціях трансамінування. «Умовно замінними» є амінокислоти цистеїн та тирозин, які можуть синтезуватися із незамінних — метіоніну та фенілаланіну, відповідно; «частково замінні» амінокислоти (гістидин, аргінін) синтезуються в недостатній кількості.
Потік амінокислот, що виходить з амінокислотного пулу, включає анаболічні і катаболічні шляхи перетворення вільних амінокислот і складається з таких компонентів:
1. Використання амінокислот для синтезу білків організму. Цей потік у дорослих людей, що споживають збалансовану дієту, забезпечує покриття протеолізу власних білків — стан азотистої рівноваги. Для синтезу власних ферментних, структурних білків та фізіологічно активних сполук білкової і пептидної природи (на анаболічні потреби) використовується близько 75-80 % амінокислот, що вивільняються при розщепленні тканинних білків, та амінокислот, які надходять із кишечника.
2. Використання амінокислот, які не включені в анаболічні процеси, в катаболічних реакціях. При цьому молекули амінокислот розщеплюються з утворенням діоксиду вуглецю, води (через цикл лимонної кислоти) та кінцевих продуктів азотистого обміну (у людини — переважно сечовини). Певна частина безазотистого вуглецевого скелета амінокислот використовується для утворення глюкози (глюконеогенезу) та кетонових тіл (кетогенезу).
Розщепленню підлягають усі амінокислоти, що не використовуються для синтезу білків або фізіологічно активних сполук (ФАС) незалежно від джерела походження, оскільки резерви білків у тваринних організмах не утворюються (на відміну від вуглеводів та ліпідів). Разом з тим, біоенергетичне значення катаболізму амінокислот у здорової людини незначне, порівняно з вуглеводами та ліпідами (близько 10 % від загальних енергетичних потреб), суттєво збільшуючись лише за умов голодування.
Першим етапом катаболізму вільних L-амінокислот є відщеплення α-аміногрупи в реакціях трансамінування та дезамінування. Деякі амінокислоти використовуються в реакціях декарбоксилювання з утворенням амінів гормональної та нейромедіаторної дії, які в подальшому також розщеплюються шляхом дезамінування.
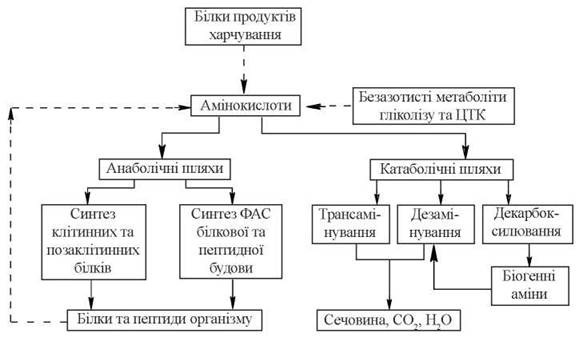
Рис. 17.1. Схема загальних шляхів перетворення амінокислот.
Суцільні стрілки — реакції використання амінокислот в анаболічних та катаболічних процесах; перервні стрілки — реакції надходження амінокислот в загальний амінокислотний пул.