СТРУКТУРА И СВОЙСТВА БИОМОЛЕКУЛ - А. Е. Земляков - 2017
12. УГЛЕВОДСОДЕРЖАЩИЕ КОМПЛЕКСЫ
Разнообразие структур моносахаридов и возможность образования нескольких типов гликозидных связей при образовании углеводных цепей позволяют кодировать с их помощью значительно больше информации по сравнению с пептидами или нуклеиновыми кислотами. Например, из одного элементарного звена (аминокислоты, нуклеотида) можно построить по одному дипептиду и динуклеотиду, а два одинаковых моносахарида могут образовать 42 дисахарида.
Было рассчитано, что 20 основных аминокислот могут образовать ~6,4 107 гексапептидов, набор из 4 основных нуклеотидов дает ~4,1 103 гексануклеотидов, тогда как 20 моносахаридов могут составить ~1,4 1015 гексасахаридов. В том числе и по этой причине именно углеводные цепи отвечают в природе за функции «отпечатков пальцев» - клетки каждого человека имеют индивидуальный набор углеводных структур или каждый штамм грамотрицательных бактерий имеет свой специфический липополисахарид.
Чаще всего углеводы свои функции реализуют не как чистые олиго- и полисахариды, в виде комплексов с другими биомолекулами.
❖ Классификация.
♦ Углевод-белковые комплексы. По соотношению белок-углевод углеводбелковые комплексы подразделяют на гликопротеины (основная часть белок) и протеогликаны (основная часть углевод). Реально нет четкой границы между двумя этими классами, например, муцины, содержащие несколько сот углеводных цепей, традиционно относят к гликопротеинам.
В группу углевод-белковых комплексов включают также пептидогликаны, в которых полисахаридные цепи сочетаются с короткими пептидными цепями, и гликопептиды, представляющие собой сочетание моно- и олигосахаридов с пептидами.
♦ Углевод-липидные комплексы. К ним относят гликолипиды и липополисахариды.
❖ Гликопротеины. В этих структурах обычно к белковой молекуле присоединено одна или несколько олигосахаридных цепей, например, в интерлейкине-2 содержится одна углеводная цепь, а в иммуноглобулине М - 10 цепей. Гликопротеины отличаются разнообразием функций: ферменты, гормоны, рецепторы клеточных мембран, белки иммунной системы, компоненты плазмы крови.
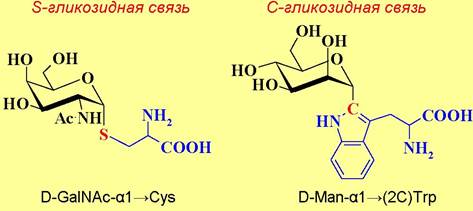
Присоединение углеводных цепей к полипептидам осуществляется посредством гликозидной связи. К настоящему времени выявлено несколько способов соединения моносахаридов с аминокислотами. Наиболее распространены два типа присоединения: N и О- гликозидная связь. Реже встречается соединение посредством S-гликозидной связи по остаткам цистеина и С-гликозидной связи между остатками D- маннозы и триптофана.
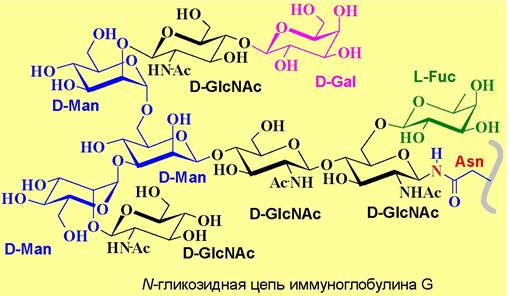
✵ N-Гликозидная связь - наиболее часто встречается соединение остатка N-ацетилглюкозамина β-гликозидной связью с атомом азота боковой цепи аспарагина. Такой тип связи обнаружен в иммунноглобулинах, y- интерфероне, антигенах тканевой совместимости. Реже встречаются другие варианты N-гликозидных связей, например, D-GalNAc-β1—> Asn, D-Glc- β1 —> Аsn, L-Rha-α1 —> Asn или D-Glc-β1 —> Arg.
Обычно к N-ацетилглюкозамину присоединен еще один аналогичный моносахарид и D-маннозный трисахаридный фрагмент, формируя стандартный
олигосахаридный блок (кор), от которого могут ответвляться олигосахаридные цепи. В зависимости от моносахаридного состава различают цепи сложного типа, обогащенные маннозой и смешанного типа.
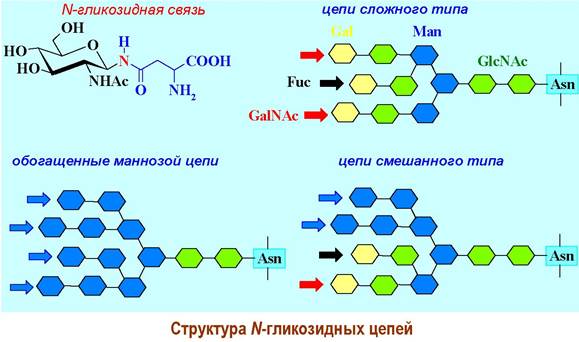
К первому типу, в частности, относятся олигосахаридные цепи иммуноглобулина G.
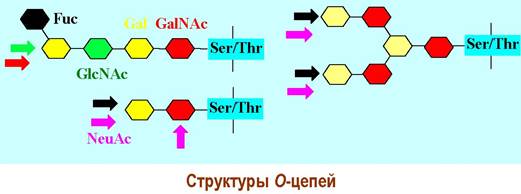
✵ О-Гликозидная связь - типичным является соединение остатка N ацетилгалактозамина α-гликозидной связью с атомом кислорода серина или треонина. Этот тип связи, в частности, характерен для групповых веществ крови. Гидроксильная группа этих аминокислот также может быть гликозилирована D-ксилозой (гепарин, хондроитинсульфат), β- N-ацетилглюкозамином (белки цитоплазмы и ядра), β-D-глюкозой, α-D- галактозой, α-D-маннозой, α-L-фукозой.
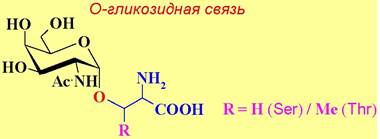
Еще реже встречаются конъюгаты β-N-ацетилглюкозамина, α-Э- галактозы или β-D-арабинозы с гидроксипролином, β-D-глюкозы, α- или β- D-галактозы с тирозином, β-D-галактозы с 5-гидроксилизином (коллаген).
Остаток N-ацетилгалактозамина в свою очередь гликозилирован D- галактозой, образуя стандартный дисахаридный кор. Дальнейшее усложнение углеводных цепей происходит путем присоединения к кору дисахаридных фрагментов N-ацетиллактозамина и концевых остатков L-фукозы или N- ацетилнейраминовой кислоты.
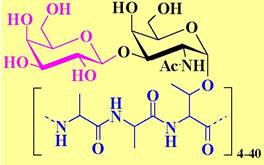
❖ Антифризные гликопротеины. В крови полярных рыб в концентрации до 25 мг/мл присутствуют несколько типов протеинов с молекулярными массами 3-16 кДа, а также гликопротеины с М 2,6-33кДа, обеспечивающие существование этих животных при температурах ниже 0 °С. Считается, что эти соединения препятствуют образованию кристаллов льда.
Антифризный гликопротеин представляет собой блок-полимер Аlа-Аlа-Тhr, гликозилированый дисахаридом β-Gal- (1 —> 3)-α-GlaNAс.
Позже такие соединения были обнаружены у некоторых насекомых, в растениях, грибах и даже бактериях.
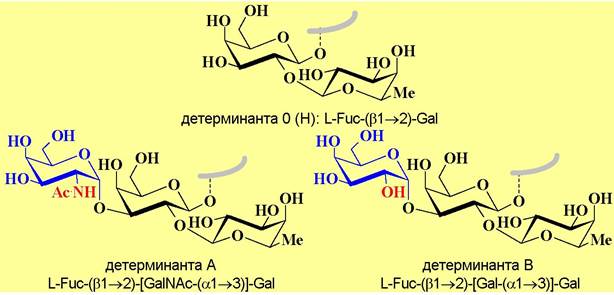
❖ Групповые вещества крови - иммуногенные структуры (углеводы, белки, гликопротеины и др.), находящиеся на поверхности эритроцитов и определяющие группу крови. Г лавной системой групп крови является система АВ0 (Н).
Еще в начале двадцатого века австрийский ученый К. Ландштейнер (Нобелевская премия по физиологии и медицине 1930 г.) предположил, что на поверхности красных клеток крови могут присутствовать или отсутствовать два типа структур - детерминант А и В, отвечающих за иммунологические процессы.

Отсутствие этих детерминант, присутствие только одной детерминанты или одновременно детерминант А и В объясняет наличие 4 групп крови (соответственно, группы крови I, II, III и IV или 0 (Н), А, В и АВ).
Таблица 8. Система групп крови АВ0
Группа крови |
Гены |
Детерминанты на эритроцитах |
Антитела в плазме крови |
I |
(0)(0) |
0 |
анти-А, анти-В |
II |
(А)(А) и (А)(0) |
А |
анти-В |
III |
(В)(В) и (В)(0) |
В |
анти-А |
IV |
(А)(В) |
А В |
- |
В плазме крови человека, соответственно, были выявлены два типа белковых молекул, способных соединяться с этими детерминантами, образуя прочный комплекс и, соответственно, слипание эритроцитов. Эти соединения назвали α- и β-агглютининами. Позже выяснилось, что они представляют собой антитела к этим детерминантам: анти-А и анти-В. Это объясняет невозможность переливания крови людям с разными группами крови. Даже I группа крови, которую ранее называли «универсальной» может содержать значительное количество антител, что препятствует её переливанию людям других групп крови.
Более поздние исследования показали, что углеводная детерминанта 0 (Н) также существует. Это дисахарид O-L-фукопиранозил-(β1 —> 2)-D- галактопираноза, а все различие в детерминантах А и В заключается в том, что в первом случае к детерминанте 0 по гидроксильной группе у С3 остатка галактозы дополнительно присоединен α-D-N-ацетилгалактозамин, а во втором - α-D-галактоза. Даже такие небольшие структурные отличия обеспечивают существенное различие в иммунологических реакциях.
На липидной мембране эритроцитов детерминантные цепи могут быть закреплены как в виде гликолипидов, так и посредством мембранных гликопротеинов. В первом случае в качестве липидного «якоря» выступает глюкоцереброзид. Между детерминантой и «якорем» расположено несколько повторяющихся звеньев [—>4)-β-GlcNAc-(1 —> 3)-β-Gal-(1—>].
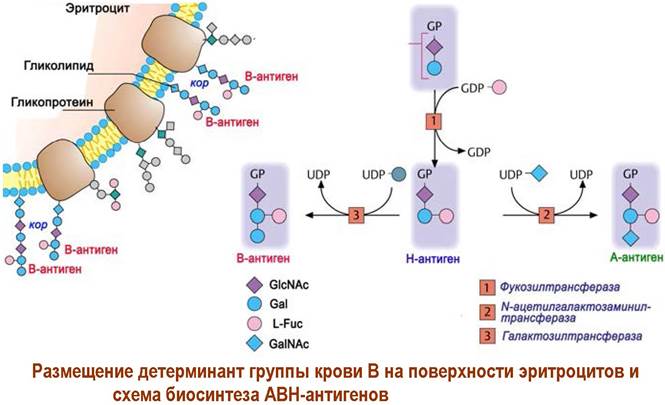
Интегральный гликопротеин имеет молекулярную массу ~43 кДа. Посредством О-гликозидной связи на нем закреплено соединительное трисахаридное звено с терминальной олигосахаридной группоспецифической детерминантой.
Биосинтез АВН-антигенов осуществляется с помощью специфических гликозилтрансфераз, возможность образования которых кодируется определенными генами в ДНК.
Детерминантные группы находятся не только на поверхности красных клеток крови. Подобные углеводные цепи содержатся в олигосахаридных фрагментах муцинов - гликопротеинов, секретируемых различными тканями организма (слюна, слизи) и выстилающих полости дыхательных и пищеварительных органов.
Наряду с групповыми веществами крови системы АВ0 (Н) выявлено более 45 систем групповые вещества (см. Табл. 9.), в которых в качестве антигенных детерминант выступают различные биополимеры. Их сочетание приводит к образованию уникальной антигенной системы на поверхности клеток каждого человека.
Таблица 9. Некоторые системы антигенов групп крови
Система |
Антигены |
Природа антигенов |
Резус-фактор |
D, С, Е, с, е |
протеин |
MNS |
М, N, S, s, U |
сиалогликопротеин |
P |
Р1, Р2, Рк |
гликолипид |
Келл |
К, к, Кра, Крb,Jsa, Jsb |
гликопротеин |
Даффи |
Fya, Fyb |
протеин |
Кидд |
Jka, Jkb |
протеин |
Льюис |
Lea, Leь, Lec, Led |
олигосахарид |
Ii |
I, i |
полисахарид |
✵ Резус-фактор - вторая по значимости система антигенов групп крови. Она формируется совокупностью протеинов на поверхности эритроцитов. Наиболее иммунологически важным является наличие антигена D (Кофактор). Отсутствие этого антигена часто обозначается символом d (Кофактор). Отрицательный резус-фактор наблюдается у ~15% европеоидов, у ~7% негроидов и только у ~0,5% монголоидов. Различие в резус-факторах учитывают при переливании крови.
У женщин с КО-фактором, формируемым гомозиготным геном dd, от резус-положительного отца с гетерозиготным геном Dd с 50% вероятностью, а при гомозиготном гене DD со 100%, ребенок будет иметь КО-фактор. Это может послужить причиной резус-конфликта (выработка в крови матери антител анти-Rh+), приводящего к развитию ряда патологий, в т. ч. гемолитической желтухи новорождённых.
Название фактора связано с использованием при его открытии в 1942 г. (Карл Ландштейнер совместно с американским иммунологом Александром Винером) сыворотки, полученной путём иммунизации кроликов с эритроцитами макаки-резуса.
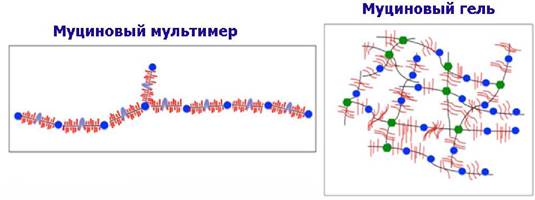
❖ Муцины. Эпителиальные клетки животных продуцируют гликопротеины муцины. Эти гликопротеины являются основными компонентами слизистых оболочек тканей. Муцины обеспечивают таким оболочкам влажность, эластичность, выполняют защитные функции тканей, например, предохраняют от протеолитического действия желудочного и кишечного сока, участвуют в процессах минерализации, способны связывать патогенны. Молекулярная масса муциновых комплексов достигает 20 МДа.
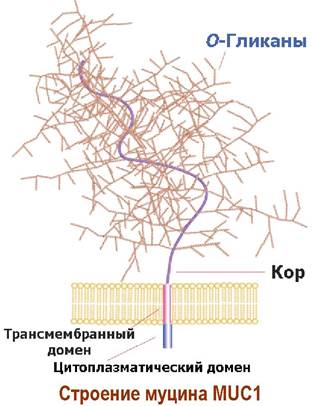
Структура муцинов очень разнообразна и гетерогенна по строению. Например, муцин МUС1 представляет собой внедренный в липидную мембрану О-гликозилированный протеин с высоким содержанием серина и треонина.
Молекула муцина МUС2 имеет более сложное строение. Основная часть молекулы представляет собой белок с повторяющимися блоками, содержащих треонин (серин) и пролин. Олиго- и полисахаридные цепи (до 20 моносахаридов, в т. ч. сиаловые кислоты) присоединены посредством О- гликозидных связей. В структуре муцина также выделяют обогащенные цистеином участки. N и С-концевые домены содержат относительно небольшое количество олигосахаридов с N-гликозидной связью.
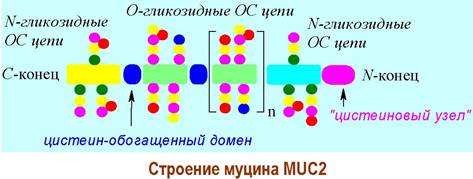
Находящийся на С-конце «цистеиновый узел» обеспечивает макромолекуле возможность ди- и олигомеризоваться за счет образования дисульфидных связей. Дисульфидные мостики, гидрофобные и ионные взаимодействия далее обеспечивают формирование трехмерной гелевой структуры муцинов.
❖ Протеогликан хряща представляет собой сложный ансамбль молекул пептидной и углеводной природы. К несущей молекуле полисахарида гиалуроновой кислоты посредством связывающих белков присоединено до 100 цепей биополимера аггрикана.
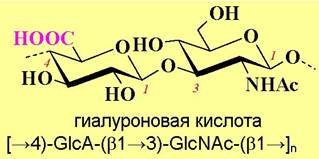
Гиалуроновая кислота (от греч. hyalos - глаз) - полимер, состоящий из повторяющихся дисахаридных блоков глюкуроновой кислоты и N- ацетилглюкозамина. Число дисахаридных остатков в цепи может достигать 25 000, а молекулярная масса - 107 Да. Благодаря полианионному строению полисахарид образует гидратную оболочку диаметром до 500 нм.
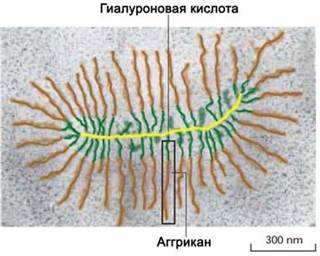
Аггрикан состоит из белковой молекулы-носителя (кора) с молекулярной массой около 250 кДа, несущего полисахаридные цепи кератансульфата и хондроитинсульфата.
Цепи хондроитинсульфата (от греч. chondros - хрящ) состоят из повторяющихся звеньев глюкуроновой кислоты и N-ацетилгалактозамина (n = 10100), нерегулярно сульфатированного по С4-и/или С6-гидроксильным группам остатков галактозамина. По остаткам серина в коре аггрикана О- гликозидными связями присоединено около 100 цепей этого полисахарида.
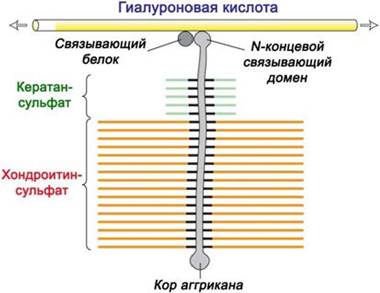
Также аггрикан содержит до 30 цепей кератансульфата (от греч. keras - рог) - блок-полимера галактозы и 6-О-сульфата-N-ацетилглюкозамина (n = 840), частично сульфатированного по Сб-гидроксильным группам остатков галактозы, и присоединенных посредством как О-, так и N-гликозидных связей.
Общая масса протеогликана превышает 2 108 Да.
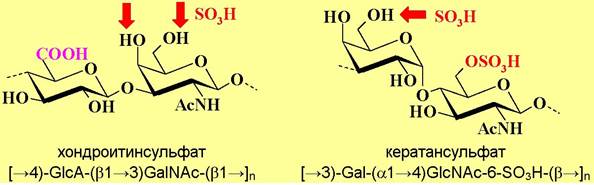
❖ Гепарин (от греч. hepar - печень) - полидисперсный полисахарид сложного сироения. Молекулярная масса может достигать 40 кДа, а для низкомолекулярной формы - 10-15 кДа. Имеет блочное строение. Выделяют два блока, в состав которых, соответственно, входят D-глюкуроновая и L- идуроновая кислоты. Сильнокислый характер гепарину придают большое количество О- и N-сульфатных остатков. Полисахаридная цепь присоединена к аминокислотной цепи через остаток D-ксилопиранозы, связанной β-O- гликозидной связью с остатком серина (Xylp-β1 —> Ser).
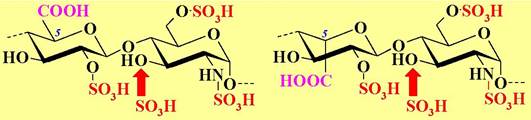
Главное биологическое свойство гепарина - антикоагулянтное (препятствующее сворачиванию крови) действие. Он широко применяется в качестве лекарственного препарата при лечение различных тромбозов, инфаркта миокарда и др. заболеваний.
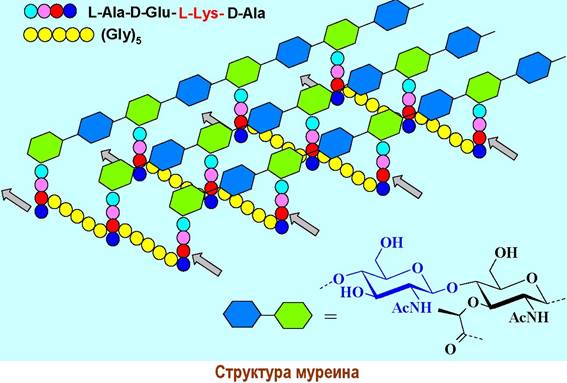
❖ Пептидогликан клеточных стенок бактерий (муреин) является структурой, обеспечивающую внешнюю защиту бактерий от окружающей среды. Главный компонент (50-80%) клеточных стенок грамположительных бактерий. Он представляет собой сшитый полимерный каркас, в котором полисахаридные цепи, состоящие из остатков N-ацетилглюкозамина и его производного - N-ацетилмурамовой кислоты, поперечно соединены короткими пептидными цепями.
Через карбоксильную группу мурамовая кислота сконденсирована с тетрапептидным фрагментом. В качестве соединительного звена между двумя полисахаридпептидными цепями выступает пентаглициновый мостик, с одной стороны присоединенный к боковой аминогруппе остатка лизина, а с другой - к карбоксильной группе концевого остатка D-аланина. В ряде бактерий вместо лизина встречаются другие диаминокарбоновые кислоты: гомолог лизина орнитин (Н2N(СН2)зСH(NН2)СООН) или мезо-диаминопимелиновая кислота.
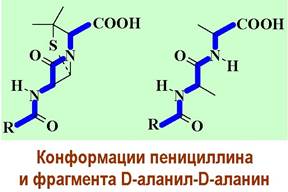
✵ β-Лактамные антибиотики. При биосинтезе муреина вначале формируются гликопептидные цепи с последовательностью D-аланил-D-аланин на С-конце. Конденсация цепей между собой осуществляется с помощью фермента транспептидазы и сопровождается отщеплением концевого остатка D-аланина.
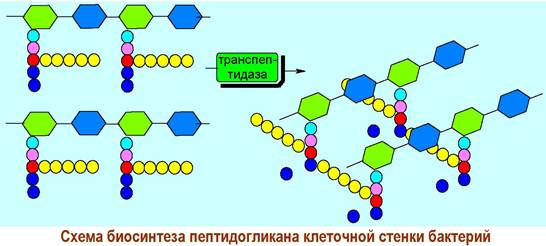
Биосинтез пептидогликана блокируется рядом β-лактамных антибиотиков, в т. ч. пенициллином, что и обеспечивает их антибактериальное действие. β-Лактамные антибиотики пространственно подобны фрагменту D- аланил-D-аланин и способны образовывать прочный комплекс с ферментом и, как следствие, ингибировать процесс биосинтеза.
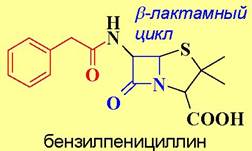
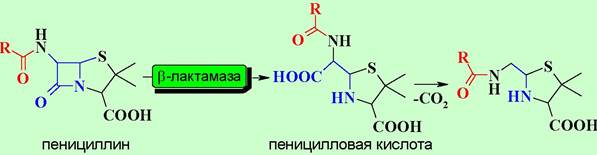
Широкое применение пенициллина в лечебной практике привело к возникновению устойчивых к этому антибиотику штаммов бактерий. Такая резистентность связана с выработкой этими бактериями фермента пенициллазы (β-лактамазы), которая расщепляет β-лактамный цикл с образованием неактивной пеницилловой кислоты с последующим декарбоксилированием.
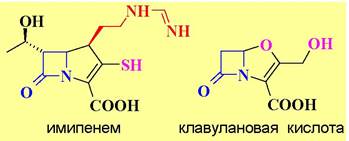
Для борьбы с такими резистентными микроорганизмами используют антибиотики устойчивые к действию β-лактамаз, например, имипенем, относящийся к группе карбопенемов, или применяют комбинацию традиционного антибиотика с ингибиторами β-лактамаз, например, клавулановой кислотой.
❖ Тейхоевые кислоты (от греч. teichos - стена) составляют до 50% от массы клеточных стенок грамположительных бактерий. В клеточных стенках грамотрицательных бактерий они встречаются очень редко.
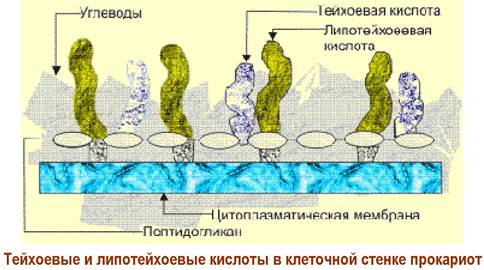
Молекулярная масса этих биополимеров достигает 2 млн. Да. Обычно тейхоевые кислоты соединены фосфодиэфирной связью с муреином через первичную гидроксильную группу остатков мурамовых кислот. Другие, так называемые липотейхоевые кислоты, соединены фосфодиэфирной связью с С6 атомом углеводного остатка гликолипидов. Посредством липидной части они закрепляются в мембране, а полиглицерофосфатная цепь располагается на ее внешней стороне или иногда пронизывает клеточную стенку и выходит на поверхность клетки.
Тейхоевые кислоты могут выполнять функции бактериального антигена, как полианионы они влияют на катионный обмен.
Существует два основных типа: глицеротейхоевые кислоты (на основе глицерина) и риботейхоевые кислоты, в основе которых лежит D-рибит.
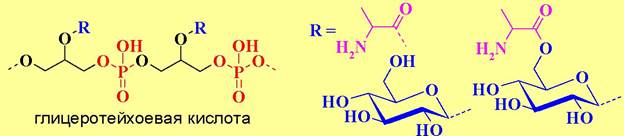
К гидроксильным группам этих полиолов могут быть присоединены остатки сахаров (обычно глюкоза и глюкозамин, реже галактоза, манноза, рамноза, галактозамин и их производные), аминокислот (D-аланин, L-лизин), или карбоновых кислот (уксусная и янтарная кислоты). В отдельных случаях выявлены смешанные тейхоевые кислоты, содержащие как глицеро-, так и рибофосфатные звенья.
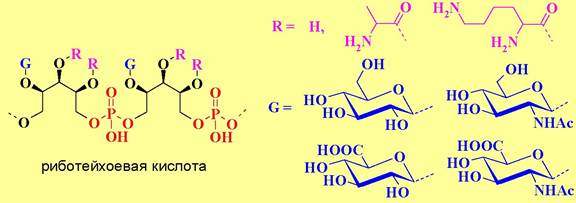
Для ряда бактерий остатки сахаров, гликозилирующих полиол, включены в главную цепь полимера или непосредственно соединены фосфодиэфирной связью. Примеры структур таких тейхоевых кислот приведены ниже.
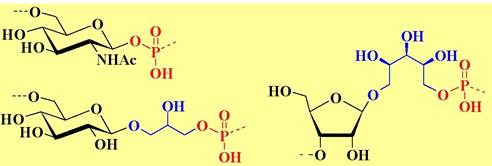
❖ Липополисахариды (LPS) являются специфическими компонентами внешней оболочки грамотрицательных бактерий. Принимают участие во взаимодействии бактерий с окружающей средой, определяют токсические и антигенные свойства. При инфицировании животных бактериями вырабатываются О-специфические антитела на липополисахарид.
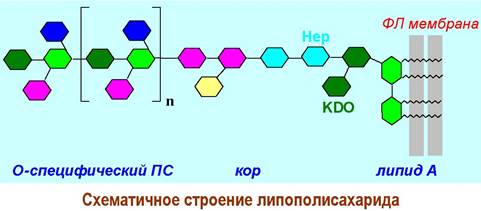
LPS состоит из трех основных компонентов: липида А, при помощи которого комплекс крепится к липидной мембране бактерий, промежуточного олигосахарида - кора, и О-специфического полисахарида, отвечающего за антигенную активность. Общая молекулярная масса доходит до 20 кДа.
✵ Липид А представляет собой дисахарид глюкозамина c β1 —> 6 связью, содержащий фосфатные группы по С1 и С4’ и ацилированный по амино- и гидроксильным группам у С3 и С3’. В качестве ацильных компонент наиболее часто встречаются тетрадекановая (миристиновая), 3- гидрокситетрадекановая и 3-тетрадеканоилокситетрадекановая (3- миристоилоксимиристиновая) кислоты.
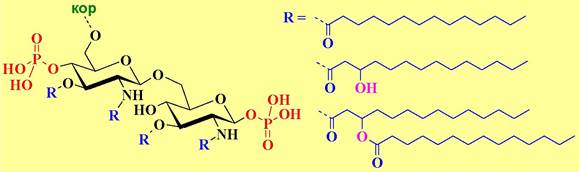
Липид А отвечает за токсические свойства LPS. Данное соединение является сильным иммуностимулятором. Удаление фосфатного остатка с гликозидного центра уменьшает токсичность при сохранении иммунной активности.
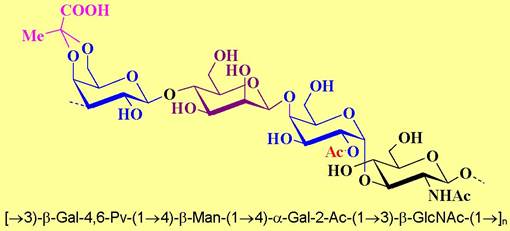
✵ О-Специфический полисахарид. Именно его структура определяет не только видовую, но и штаммовую принадлежность бактерии. Повторяющееся звено полисахарида обычно содержит от 2 до 6 моносахаридов, среди которых распространены редкие сахара, в том числе аминосахара, дезокси-производные, уроновые кислоты, их комбинации. Ряд из них содержит неуглеводные компоненты: остатки карбоновых и аминокислот, аминоспирты, остатки фосфорных кислот и т. п. Например, в состав повторяющегося звена О-специфического полисахарида Shigella disenteriae (серотип 9) входят остатки уксусной и пировиноградной кислот, причем последняя образует с остатком галактозы 4,6-О-кеталь.
❖ Диагностикумы на основе взаимодействий «антиген- антило». Знание структур О-специфических полисахаридов было использовано в создании диагностикумов для распознания инфекционных заболеваний. В частности, ученые использовали тот факт, что с точки зрения иммунной системы природный полимер-антиген и его синтетический аналог, представляющий собой конъюгат полимера-кора с синтетическими антигенными участками, очень близки. На них вырабатываются одинаковые антитела.
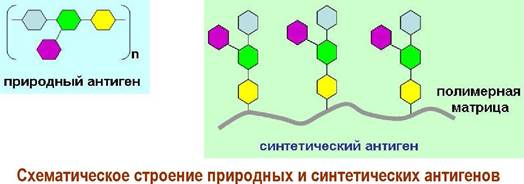
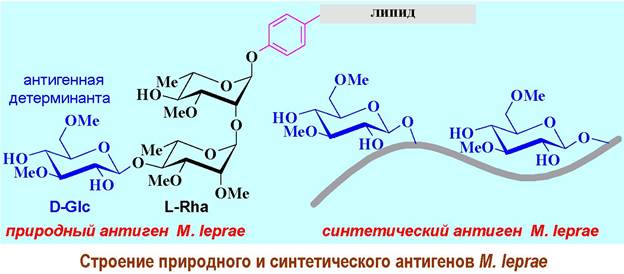
Более того в некоторых случаях наиболее сильный иммунный ответ связан только с частью антигенного участка - с антигенной детерминантой. Например, такие заболевания, вызываемые микобактериями, как туберкулез и лепра (проказа) на ранних стадиях имеют схожую картину. Природный антиген микобактерии лепры (Mycobacterium leprae) представляет собой гликозилированный трисахаридом липидофенол. Детерминантным антигеном является 3,6-ди-О-метиловый эфир D-глюкозы, на основе которого и был создан синтетический антиген.
При заражении организма в крови появляются антитела к антигенным участкам микроорганизмов. Именно их и обнаруживают с помощью диагностикумов. В лунки полистирольного планшета помещают синтетические антигены и прибавляют растворы плазмы крови пациента. Если в плазме крови есть специфические антитела, то они связываются с антигенными детерминанатами.
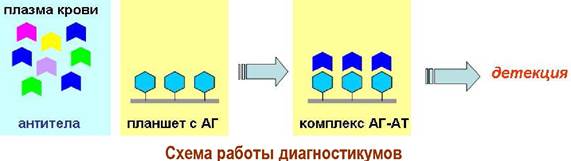
Далее такой комплекс «антиген-антитело» окрашивают специальными биохимическими реагентами и с помощью приборов мультисканов определяют оптическую плотность и затем рассчитывают концентрации антител.

Контрольные задания
Тест 4 (вариант)
1. Определите конфигурацию приведенных ниже моносахаридов:

2. Нарисуйте структуру β-L-маннопиранозы в проекции Хеуорса.
3. Данный моносахарид является:
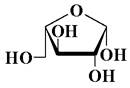
А) α-D-пиранозой; Б) β-D-пиранозой; В) α-L-пиранозой; Г) β-L-пиранозой; Д) α-D-фуранозой; Е) β-D-фуранозой; Ж) α-L-фуранозой; З) β-L-фуранозой.
4. Составьте смысловые пары:
А. муреин; Б. мурамовая кислота; В. липополисахарид; Г. О-специфический полисахарид; Д. липид-А.
I. моносахаридное производное глюкозамина; II. структура, отвечающая за антигенную активность ЛПС; III. липофильное дисахаридное производное глюкозамина; IV. специфический компонент внешней оболочки грамотрицательных бактерий; V. пептидогликан клеточных стенок бактерий.
5. Структура элементарного звена [—> 4)-α-D-GalA-(1 —>] соответствует:
А. целлюлозе; Б. гемицеллюлозе; В. агарозе; Г. амилозе; Д. амилопектину; Е. агаропектину; Ж. пектину; З. инулину; И. хитину; К. хитозану.
6. Определите к какой группе гликозидов относятся и в каком растении содержится рутин.
А. антоцианы; Б. глюкозинолаты; В. сапонины; Г. сердечные гликозиды; Д. флавоноиды; Е. цианогенные гликозиды.
I. георгина переменчивая; II. горчица черная; III. ландыш майский; IV. миндаль горький; V. солодка; VI. софора японская.
7. Выберите название представленных соединений
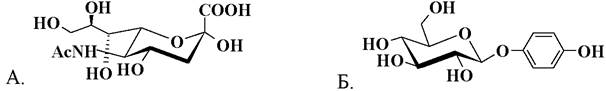
1. трегалоза; 2. сахароза; 3. лактоза; 4. мальтоза; 5. мелецитоза; 6. нейраминовая кислота; 7. индикан; 8. арбутин; 9. дурин; 10. синигрин; 11. кошениль; 12. сирингин