БІОНЕОРГАНІЧНА ТА БІООРГАНІЧНА ХІМІЯ - М.В. Яцков - 2014
II. ПРЕДМЕТ, ЗАВДАННЯ, МЕТОДИ ТА ОСНОВНІ НАПРЯМКИ ДОСЛІДЖЕНЬ БІООРГАНІЧНОЇ ХІМІЇ
2.2. Ліпіди
2.2.2. Складні ліпіди
Фосфатиди
Фосфатиди або фосфоліпіди - естери, молекули яких утворені залишками спиртів (гліцерину, інозиту, сфінгозину), ВЖК (насиченими і ненасиченими), ортофосфатної кислоти і нітрогенвмісних основ. Разом з білками складають хімічну основу біомембран клітин.
Молекула фосфадиту складається з гідрофільної (полярної) і гідрофобної (неполярної) частин (рис. 3).
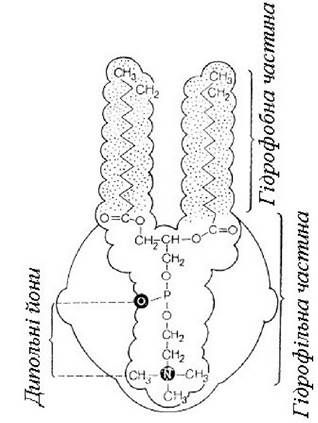
Рис. 3. Схема будови фосфатиду
Гідрофільна «голова» має негативний заряд фосфату і позитивний - Нітрогену, і є перманганатним диполем (цвітер-йоном). Гідрофобний «хвіст» складається з довгих ланцюгів залишків ВЖК. Це обумовлює поверхнево-активні властивості ліпіду, дає можливість формувати плівкові структури в моношарі на кордоні поділу фаз, взаємодіяти з різними (полярними і неполярними) сполуками, активно брати участь у багатьох реакціях ана- і катаболізму клітини. Фосфатидами багаті нервова тканина (26-30% сухої маси), печінка (до 16%) та інші органи.
Гліколіпіди
Гліколіпіди - складні ліпіди, молекули яких побудовані з ліпідного і вуглеводного фрагментів, що з’єднані між собою ковалентним зв’язком. Розрізняють такі групи гліколіпідів: 1) глікос- фінголіпіди; 2) глікозилдигліцериди; 3) глікозиди жирних гідроксикислот; 4) естери жирних кислот і цукрів; 5) фосфовмісні гліколіпіди - глікозиди фосфогліцеридів і фосфоефінголіпідів. Останні три групи знаходяться тільки у бактеріях, деякі з них дуже токсичні. Гліколіпіди - складові частини біомембран клітин, з окремими з них пов’язане явище імунітету, деякі - беруть участь у процесах міжклітинної адгезії тощо.
Сфінголіпіди
Другою важливою групою ліпідів мембранного походження є сфінгофосфоліпіди. Вони утворені на основі сфінгозину з 18 атомами Карбону або його насиченого аналога - сфінганіну:
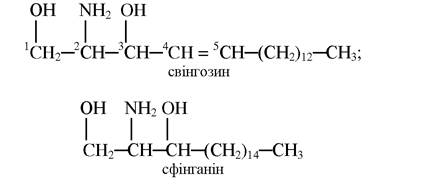
Сфінгофосфоліпіди є важливими компонентами клітинних мембран і беруть участь в обмінних реакціях.
Ліпіди характеризуються фізико-хімічними властивостями і аналітичними числами, такими як кислотне, йодне та число омилення.
Кислотне число (КЧ) - це число міліграмів КОН, необхідне для нейтралізації вільних жирних кислот, які містяться в 1 г жиру, і визначається:
![]()
де Q = 5,61 мг - кількість КОН еквівалентна 1 мг жиру; V1 - об’єм (КОН), який витрачається на титрування проби, мл; K - поправочний коефіцієнт до нормальності КОН; Сн - нормальність розчину КОН (0,1 н); а - наважка жиру, г.
Природні жири нейтральні, але в процесі гідролізу або окиснення утворюють вільні кислоти, які впливають на властивості жирів.
Йодне число - це число грамів йоду, яке може приєднатись в результаті реакції до подвійних зв’язків в розрахунку на 100 г жиру. Для визначення цього числа використовують розчини хлориду йоду або IBr. Йодне число є мірою ненасиченості кислот в жирах:
![]()
де Q = 12,69 мг - кількість І2 еквівалентна 1 мг Na2S2O3; V1 і V2 - об’єми Na2S2O3, витрачені на титрування контрольної та дослідної проби, мл; K - поправочний коефіцієнт до нормальності Na2S2O3; Сн - нормальність Na2S2O3 (0,5 н); а - наважка жиру, г.
Число омилення (ЧО) - це число мг КОН, яке витрачається на омилення 1 г жиру при кип’ятінні з надлишком спиртового розчину КОН:
![]()
де V1, V2 - об’єми НС1, які витрачені на титрування контрольної та дослідної проби, мл; K - поправочний коефіцієнт до нормальності НС1; Сн - нормальність НС1 (0,5 н); а - наважка жиру, г.
Високе число омилення вказує на присутність кислот з меншим числом С, а мале ЧО - на присутність високомолекулярних кислот.
Омилення жиру
Жири під впливом лугів гідролізуються з утворенням мила і гліцерилу:
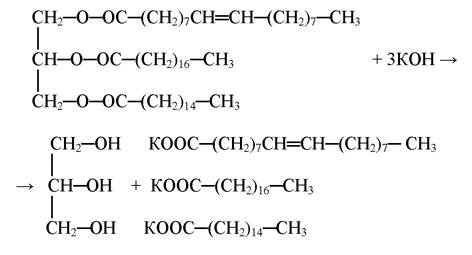
Утворення вільних жирних кислот
При добавлені до мила концентрованої хлоридної кислоти утворюються вільні жирні кислоти:
![]()
Визначення кислотного числа жиру
Кислотністю жиру або кислотним числом називається число міліграмів їдкого калію, необхідного для нейтралізації вільних жирних кислот, які містяться в 1 г жиру.
Кількість KOH, мг, або кількісне число (КЧ), яке пішло на титрування вільних жирних кислот в 1 г жиру, дорівнює:
![]()
де А - об’єм розчину KOH (0,1 моль/л), що витрачається на титрування досліджуваної проби; а - наважка жиру (г); f - коефіцієнт поправки на титр розчину KOH (0,1 моль/л); Q - кількість KOH (5,61 мг) еквівалентне 1 мл розчину KOH (0,1 моль/л).
Визначення йодного числа жиру
Йодним числом називають кількість г йоду, яке прореагувало зі 100 г жиру. Це число вказує на вміст жиру ненасичених жирних кислот.
Визначення йодного числа полягає на реакції приєднання йоду по місцю подвійного зв’язку за рівнянням:
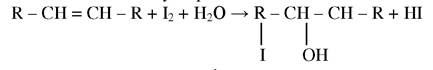
Йодне число розраховують за формулою:
![]()
де В - А - різниця результатів титрування контрольного і досліджуваного зразків розчином гіпосульфіту, мл; а - наважка досліджуваного жиру, г; f - коефіцієнт поправки на титр розчину Na2S2O3 ; Q - кількість І2 (12,69 мг) еквівалентне 1 мл розчину Na2S2O3 (0,05 моль/л).
Реакція утворення йодоформу при взаємодії ацетону з йодом
При додаванні розчину йоду і лугу до сечі, яка містить ацетон, розчин мутніє і випадає осад йодоформу, який має характерний запах. Реакція протікає наступним чином:
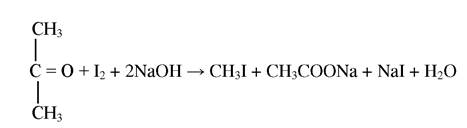
Ця реакція не є специфічною для ацетону, оскільки при взаємодії йоду з ацетальдегідом і етанолом також утворюється йодоформ.
Реакція на ацетон і ацетатну кислоту
При взаємодії ацетону і ацетоацетатної кислоти з нітропрусидом натрію в лужному середовищі утворюється комплексна сполука, забарвлена в оранжево-червоний колір:
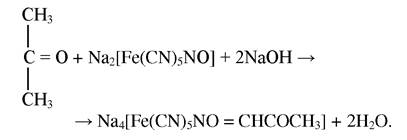
При добавлені до реакційної суміші концентрованої ацетатної кислоти утворюється сполука, забарвлена в темно-червоний колір:
![]()
Реакція не є специфічною дляацетону і ацетоацетатної кислоти, оскільки креатин сечі, також реагує з нітропрусидом і дає аналогічне забарвлення, але в цьому випадку при додаванні концентрованої ацетатної кислоти розчин не забарвлюється в темно-червоний колір.