БІОНЕОРГАНІЧНА ТА БІООРГАНІЧНА ХІМІЯ - М.В. Яцков - 2014
III.ПРИРОДНІ КАТАЛІЗАТОРИ, РЕГУЛЯТОРИ ТА СТИМУЛЯТОРИ БІОХІМІЧНИХ ПРОЦЕСІВ
3.1. Ферменти
Ферменти (або ензими) - речовини білкової природи, що виконують функції каталізатора біохімічних реакцій.
Такі реакції відбуваються в процесах росту, розмноження, травлення, рухів м’язів, енергозабезпечення, побудови структурних елементів, згортання крові тощо. Ферменти мають велику каталітичну силу - вони прискорюють реакції в мільйони разів. Навіть така проста реакція СО2 + Н2О ↔ Н2СО3 каталізується ферментом карбоангідраза зі швидкістю 105молекул СО2 за 1с.
У наш час відомо понад 3000 ферментів з молекулярною масою від кількох тисяч до мільйонів дальтон.
За хімічною будовою ферменти - це прості або здебільшого складні білкові речовини. До ферментів простої білкової природи належать відомі папаїн, пепсин, лізоцим, уреаза, рибонуклеаза, фосфаза тощо. Більшість ферментів побудовані з білкової та небілкової частини. Такі ферменти називаються голоферментами.
Небілкові складові називають кофакторами, а білкову складову - апоферментом.
За типом взаємодії апоферменту з кофактором ферменти поділяють на коферменти і простетичні групи (кофактори).
Коферменти у складі ферменту взаємодіють своїм активним центром з відповідним субстратом, переносячи при цьому електрони, атоми або групи атомів. При цьому утворюється фермент - субстратний комплекс, який після хімічних перетворень відщеплюється від ферменту.
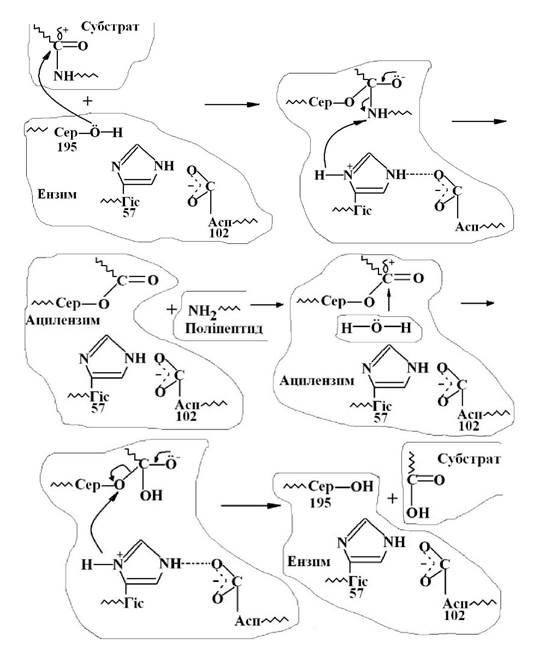
Хімізм такого процесу можна прослідкувати на прикладі дії ферменту αа-хімотрепсину. Так, у молекулі хімотрепсину формується активний центр у вигляді гідрофобної порожнини з залишків амінокислот з алкільними та арильними групами. Розмір порожнини складає 1,0 · 0,5 · 0,4 нм. На першій стадії взаємодії в результаті ацилювання серину утворюється фермент - субстративний комплекс.
При подальшій перебудові хімічних зв’язків утворюється ацилензим і вільний поліпептид з кінцевою NH2-групою. На другій стадії відбувається деацилювання за участю молекули води і розщеплення зв’язку ланки серину із субстратом, що приводить до вивільнення субстрату від ферменту.
Йони металів пов’язані з апоферментом або входять до складу небілкової простетичної групи - найчастіше порфірінового кільця гемінових ферментів (цитохромів, пероксидаз, каталази). Ферменти, які міцно пов’язані з йонами металів і не втрачають цього зв’язку за умов виділення та фракціонування ферменту, називаються металоферментами.
У деяких випадках йони металів не входять до складу ферментів як інтегральні структурні компоненти, а виконують лише функцію їх активаторів.
Дія інгібіторів ферментів протилежна активаторам. Це речовини, які перешкоджають утворенню фермент-субстратного комплексу, тобто викликають гальмування ферментативних процесів.
На швидкість ферментативної реакції значною мірою впливає співвідношення концентрацій ферменту і субстрату.
Кількість молекул субстрату, які підлягають перетворенню однією молекулою ферменту на продукт у ході реакції за одиницю часу за повного насичення ферменту субстратом, прийнято називати числом обертів ферменту або молярною активністю.
Активність ферментів виражають у міжнародних одиницях активності. Кількість ферменту, яка каталізує перетворення одного мікромоля субстрату на продукт реакції за 1 хв у стандартних умовах з розрахунку на 1 г тканини, називається міжнародною одиницею (МО). Питома активність - це число одиниць ферментативної активності на 1 мг білка.
Міжнародним біохімічним союзом запропоновано використовувати як одиницю активності катал (кат). Активність в 1 кат - це така кількість ферменту, яка каталізує перетворення одного моля субстрату на продукт реакції за 1 с. Отже, 1 кат = 60 ' 106 МО.
Рекомендовано також використовувати одиницю - нанокатал (нкат), яка дорівнює 10-9 кат.
Швидкість каталітичної реакції в присутності ферментів залежить також від присутності модуляторів ферментів-активаторів або інгібіторів процесу. До активаторів належать неорганічні йони K+, Ca2+', Na+, Zn2+, Mg2+, Mn2+, Cu2+, Fe3+, Co3+, Ni2+, Fe2+, Cu+.
Класифікація ферментів
Феременти поділяються на 8 класів:
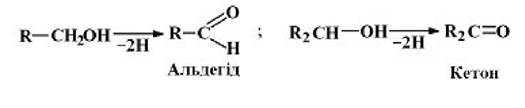
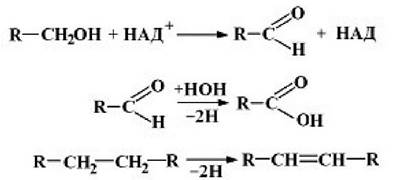
1 клас - оксидоредуктази. їх відомо понад 500 видів. Вони поділяються на 17 підкласів.
Оксидоредуктази окиснююті![]() групи до альдегідів, кетонів, кислот, ненасичених груп -СП=СП-:
групи до альдегідів, кетонів, кислот, ненасичених груп -СП=СП-:
2 клас - трансферази. Вони мають 8 підкласів. Всього їх відомо біля 200 ферментів.
Трансферази переносять різні хімічні групи, вільні радикали, атоми від одної молекули (донора) до іншої (акцептора):
![]()
3 клас - гідролази. Існує понад 450 ферментів цього класу. Вони поділяються на 11 підкласів.
Гідролази являють собою білкові речовини з молекулярною масою від 10-15 тисяч до 250-320 тисяч дальтон. Вони каталізують реакції гідролітичного розщеплення за схемою:
![]()
![]()
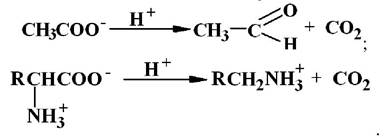
4 клас - ліази. Відомо шість основних підкласів ліаз.
Цей клас ферментів каталізує відщеплення від субстратів негідролітичним шляхом групи з утворенням подвійного зв’язку або, навіть, групи, що приєднуються до місця розриву подвійного зв’язку. В результаті таких реакцій часто утворюються такі прості продукти як СО2, H2S, NH3, Н2О тощо. Наприклад:
5 клас - ізомерази. Вони поділяють на 5 основних підкласів.
Ізомерази каталізують реакції ізомеризації у межах однієї молекули. Наприклад, іпемерази і рацемази сприяють інверсії хіральних центрів з утворенням енантіомерів:
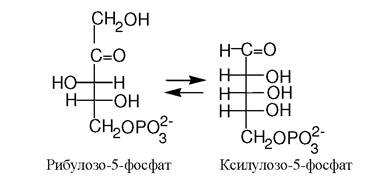
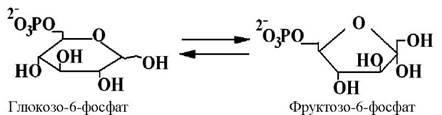
6 клас - лігази (синтетази). Відомо приблизно 80 ферментів лігаз, які поділяються на 5 підкласів.
Лігази сприяють сполученню двох субстратів з утворенням нового зв’язку при одночасному розриві пірофосфатних зв’язків в молекулі АТФ або ГТФ. Наприклад, кожна аміноацил-тРНК- синтетаза володіє спорідненістю до певної амінокислоти, а також до одної або декількох тРНК. Записуючи тРНК у вигляді тРНК-ОН рівняння реакції, що каталізується аміноацил-тРНК-синтетазою можна записати у вигляді:
![]()