Общая биотехнология: Курс лекций Часть II - Блинов В.А. 2004
Биотехнология в пищевой промышленности
♦ Общие представления о технологии пищи.
♦ Промышленные процессы с использованием ферментов. Подсластители как заменители сахара.
♦ Биотехнологические процессы в молочной промышленности.
♦ Биотехнологические процессы в мясной промышленности.
Общие представлении о технологии пищи. Производство продовольствия - наиболее древняя сфера деятельности человека. Долгое время для пищевых целей использовались главным образом энергетические фракции, а самая ценная часть пищи - белки, как правило, удалялась вместе с отходами. В результате этого нередко отходы по биологической ценности превосходили целевой продукт. Примерами могут служить пахта и молочная сыворотка как побочные продукты производства сливочного масла, творога и сыра. Показано, что около половины производимого животного белка не используется для литания. Значительное количество отходов высокой пищевой ценности дает переработка зерновых и масличных культур, клубнеплодов. Все они возвращаются в сферу производства пищи путем скармливания сельскохозяйственным животным, т.е. с огромными потерями.
Чтобы обеспечить человечество традиционной нищей производство зерна нужно увеличить на 65-70 млн т в год. Это нереально, так как постоянно происходит сокращение площади продуктивных угодий и снижение их продуктивности. Кроме того, традиционные производства недостаточны для получения наиболее ценных для питания и дефицитных белков животного происхождения. Для получения белка используются длинные пищевые (трофические) цепи с несколькими уровнями потребления, а, следовательно, потеря энергии оказывается очень большой: лучистая энергия солнца → зеленые растения; растительная биомасса → гетеротрофные организмы; сельскохозяйственные животные → человек. Подсчитано, что при производстве продукции животноводства теряется не менее 60 % белка кормов, а для наиболее дорогой продукции бифштексов из говядины потери достигают 95 %.
Известно, что традиционному способу производства пищи присуши некоторые особенности и противоречия. Это еще больше сдерживает повышение его эффективности. Имеется несоответствие между периодическим (сезонным) характером производства и непрерывным характером потребления; между нестандартным качеством сырья и стандартными условиями производства; переработкой и сбытом продукции; между планированием или объективными потребностями и неустойчивыми объемами производства и т.д.
Повышение эффективности производства пищи достигается за счет селекции культур и использования усовершенствованных агрономических приемов. Так, в 50 80-е годы XX века удалось в три раза увеличить их объемы производства («зеленая революция» 70-х годов). Сейчас основной упор делается на производство бобовых, которые из-за большого количества полноценных белков успешно конкурируют с производством мяса и молока. Другое направление интенсификации производства пищи связано с получением продуктов повышенной биологической ценности. Для этого в продукты, дефинитные по белку, вводят дополнительно полноценные белки или аминокислоты.
Используя эти способы, были созданы предпосылки для развития новой пищевой технологии. Ее суть заключается в комплексной переработке сырья и использовании всех его компонентов. Ресурсы сырья для новой пищевой технологии можно разделить на три основные группы. Во-первых, это продукция традиционной технологии, ее отходы и побочные продукты. Во-вторых, первичная продукция фотосинтеза - растительная биомасса, которая традиционно в пищу не используется (трава, солома и др.). В-третьих, это микробная биомасса и другие продукты биосинтетической деятельности микроорганизмов. Стратегически последняя группа считается наиболее перспективной.
Промышленные процессы с использованием ферментов. В промышленности применяется около 20 ферментов, в медицине - 22 и в аналитических исследованиях около 19. Промышленное производство ферментов постоянно расширяется. В настоящее время около 80 % мирового рынка ферментов, составляет производство 15 ферментов, в т.ч. в иммобилизованной форме применяется 8.
Производимые в промышленности ферменты включают амилазу, глюкоамилазу, протеазу, пектиназу, инвертазу, каталазу, пенициллиназу, стредтокиназу, целлюлазу, дектриназу и др. Амилазы и протеазы используются в текстильной, хлебопекарной, кожевенной промышленности. Пектиназа используется для получения соков и в виноделии. Пектолитические ферменты применяются для мацерации тканей при переработке и для облагораживания растительного сырья (например, льноволокна). Щелочные протеазы эффективно работают в составе моющих средств. Реннин микробиологического происхождения используется в сыродельной промышленности.
Все увеличивается роль микробных ферментов в медицине. Здесь применяют урокиназу, стрептокиназу, аспарагиназу, трипсин и др. Декстриназа наряду с литическими ферментами используется в качестве компонента зубных паст для профилактики кариеса зубов и может найти применение в сахарной промышленности. Широко используются ферменты для определения в крови различных метаболитов.
Для получения пищевых продуктов, а также фармацевтических препаратов в основном используются иммобилизованные ферменты и клетки. В настоящее время иммобилизованные ферменты (ИФ) используются в нескольких крупномасштабных производствах.
Получение фруктозной патоки. Фруктоза содержится в яблоках, томатах, меде. Она на 60-70 % слаще сахара, следовательно, потребление ее, а значит, и калорийность пищи будет меньше. Превращение фруктозы не связано с инсулином, поэтому ее рекомендуют больным сахарным диабетом. Фруктоза реже вызывает заболевания зубов, а в смеси с глюкозой не кристаллизуется, что позволяет такую смесь использовать для получения мороженого и кондитерских изделий.
Производство фруктозной патоки состоит из двух этапов: первый - получение глюкозной патоки из крахмала (обычно кукурузного), второй - изомеризация глюкозы. Для получения глюкозной патоки крахмальную суспензию смешивают с а-амилазой и, интенсивно перемешивая, выдерживают в реакторе примерно 30 мин. Крахмал распадается на фрагменты - декстрины и мальтозу. Чаще используют бактериальную а-амилазу, чем грибную, так как она термостабильнее. Концентрация фермента 0,04-0,1 %. Далее мальтоза и декстрины расщепляются до глюкозы при помощи глюкоамилазы. Если процесс протекает в периодическом режиме со свободным ферментом, то реакция при 55-60 °С длится 3-4 суток. Затем фермент инактивируют термически, адсорбируют на угле или в ионообменных колонках для повторного использования.
Последний этап производства фруктозной патоки изомеризация глюкозы в иммобилизованной системе с глюкозоизомеразой. В качестве носителя может быть ДЭАЭ-целлюлоза или ПААГ. Раствор глюкозы пропускают через слой ИФ, а из реактора вытекает смесь фруктозы и глюкозы. Продукт после изомеризации обрабатывают углем для деколоризации, освобождают от примесей в ионообменных колонках, затем упаривают до 71 % содержания сухих веществ. Фруктозная патока содержит 50 % глюкозы и 42 % фруктозы.
Суточная производительность предприятий по производству фруктозной патоки достигает 400 т. Из одной тонны ИФ за 100 суток работы получают 4000 т фруктозы. Период полуинактивации фермента 20-50 суток. Следовательно, фермент в системе необходимо менять через 2-3 месяца. Применение иммобилизованной глюкозоизомеразы позволило сократить расход фермента в 10 раз, а затраты труда в 3 раза.
Обычно в периодическом процессе из глюкозы удается получить фруктозный сироп, содержащий 42 % фруктозы. Затем был разработан непрерывный процесс, который позволил производить патоку с концентрацией фруктозы 42 и 55 %. Однако для получения сиропа, содержащего 55 % фруктозы, необходимо хроматографическое отделение части глюкозы. Это удорожает продукт на 15-25 %, но он становится пригодным для производства напитков типа кока-колы. Производство фруктозной патоки практикуют на комбинатах по комплексной переработке кукурузы.
Получение L-аминокислот. Синтез восьми незаменимых аминокислот (лизин, лейцин, изолейцин, треонин, ватин, триптофан, фенилаланин, метионин) имеет важное практическое значение - для корректировки рационов питания, а также лечебных и профилактических целей. Это крупномасштабная отрасль химической промышленности.
Однако с помощью химических методов можно получить смесь D и L-аминокислот. Для рационов людей и животных нужны лишь L-аминокислоты, Разделение этой рацемической смеси осуществляют с помощью иммобилизованной аминоацилазы. Этот фермент гидролизует лишь один ацил — L- изомер, отщепляя от него объемную ацильную группу. При этом растворимость L-аминокислот, но сравнению с ацил D- изомера, резко увеличивается. Благодаря этому удается отделить L-изомeр. Оставшаяся D-аминокислота при нагревании рацемизуется. т.е. вновь образуется смесь L- и D-аминокислот. Процесс повторяют, добиваясь практически полного перехода рацемата в L-аминокислоту.
При работе с ИФ применяют биореакторы различных типов, в т.ч. с механическими мешалками, одно- и многоступенчатые, тубулярные колонны, с фиксированным слоем биокатализатора и биореакторы «кипящего слоя». Для отделения от потока субстрата взвешенных частиц с ферментом применяют фильтры, центрифуги и др.
Приведем один пример. В Японии для получения L- метионина из химически синтезированного рацемата ацетил D,L-метионина использована иммобилизованная аминоацилаза из Aspergillus orysae. Фермент иммобилизован на ДЭАЭ- сефадексе А25 и фиксирован в колонном биореакторе. Раствор рацемата прокачивается через колонну и концентрируется в вакуум-аппарате, L-метионин затем кристаллизуется и отделяется от жидкой фракции. Оставшийся ацетил-D-метионин направляется в реактор для рацемизации при помощи кислоты и затем его добавляют к рацемату, полученному путем химического синтеза.
Такая колонна проработала 90 суток и было получено 15,39 кг L-метионина. Выход составил 90 %. Периодический процесс культивирования с использованием нативного фермента позволил получить за это время всего 1,48 кг L- метионина. При использовании ИФ расходы на получение L- аминокислоты были на 40 % ниже.
Многотоннажным является производство L-аспарагиновой кислоты. Эта аминокислота широко применяется в пищевой промышленности. Она вместе с глицином придает кондитерским изделиям и напиткам оттенки кислого и сладкого вкуса Процесс получения L-аспарагиновой кислоты из фумаровой кислоты и аммиака в одну стадию реализован с помощью иммобилизованных клеток Е. coli или Pseudomonas aeruginosa, обладающих аспартазной активностью. Аспартаза, как известно, катализирует реакцию присоединения аммиака к фумаровой кислоте. Аспартаза, иммобилизованная в геле, полуинактивировалась за 1 месяц, а при иммобилизации клеток - за 4 месяца.
Технология биотрансформации фумаровой кислоты представляется в следующей последовательности:
♦ выращивание клеток методом глубинной ферментации и их выделение центрифугированием;
♦ иммобилизация клеток биокатализатора в геле в виде гранул размером 2-3 мм;
♦ биотрансформация фумарата аммония в колонке с катализатором в поточном режиме и получение раствора Z-аспарагиновой кислоты;
♦ кристаллизация, центрифугирование и промывка кристаллов.
Производительность системы биотрансформации L-аспарагиновой кислоты с 1 м3 биореактора составляет 1700 кг.
Периодические ферментации используют для получения других L-аминокислот: глутаминовой, фенилаланина, лизина, триптофана и др. При культивировании используют мутантные штаммы, метаболизм которых по целевому продукту изучен достаточно хорошо. Так. фенилаланин, служащий сырьем для пищевого подсластителя аспартама, получают при помощи тирозин- и метиониндефицитного мутанта Brevibacterium lactofermentum. В периодическом процессе ферментации удалось концентрацию продукта повысить до 24,8 г/л.
Производство L-яблочной кислоты. Она хороший заменитель лимонной кислоты в пищевых продуктах и фармацевтических препаратах. В результате химического синтеза образуется рацемическая смесь D,L-яблочной кислоты. Исходя их этого L-изомер яблочной кислоты стали получать из фумаровой кислоты при помощи иммобилизованной фумаразы. Фермент катализирует присоединение к фумаровой кислоте по двойной связи молекулы виды с образованием L-яблочной кислоты. Если время полуинактивации нативного фермента составляло 6 суток, то после иммобилизации в ПААГ - 55 суток, а в геле каррагинана — 160 суток.
Получение безлактозного молока. Значительная часть населения не может употреблять цельное молоко из-за высокой толерантности к молочному сахару. В кишечнике у таких людей лактоза не гидролизуется, а сбраживается, что приводит к метеоризму, сильным болям и диарее. Лактоза имеет небольшую сладость, низкую растворимость в воде, она образует мелкие кристаллы в мороженом и кондитерских изделиях, ухудшая их качество. Исходя из этого, важной задачей пищевой промышленности является производство безлактозного молока. Для этого используют иммобилизованную лактазу (β-галактозидазу), она стабильна и даже через 50 суток работы сохраняет 80 % первоначальной активности. В Италии (Милан) производится до 10 т безлактозного молока в сутки.
Получение 6-аминопенициллановой кислоты (6-АПК). Это соединение является ключевым при синтезе многих антибиотиков. 6-АГЖ получают обычно из бензилпенициллина, для чего его химически ацилируют. Однако это весьма сложная процедура. Сейчас для превращения бензилпенициллина в 6-АПК используют Bacillus megatherium, которая экстрацеллюлярно продуцирует пснициллинамидазу, или Е. coli, которая продуцирует фермент интрацеллюлярно.
Иммобилизованная на бентоните пенициллинамидаза теряет 50 % активности в течение 15 циклов. Конверсия бензилпенициллина в 6-АПК осуществляется при концентрации субстрата 100-300 мМ с коэффициентом конверсии 0,95-0,99. Оптимальный pH - 7,8-8,0, а температура — 35-40 °С. Реакцию биотрансформации в большей степени ингибирует продукт, чем субстрат. Фермент можно иммобилизовать также в волокна триацетата целлюлозы.
Подсластители как заменители сахара. Избыток углеводов вреден для организма. Известно два пути уменьшения излишней калорийности пищи без снижения потребности человека в сладостях:
♦употребление вместо сахарозы более сладких сахаров, например, фруктозы;
♦ использование искусственных подсластителей.
Существует несколько подходов для решения первого пути: получение сладких фруктозных сиропов из крахмала, гидролиз сахарозы на глюкозу и фруктозу, инверсия сахарозы под влиянием дрожжевой инвертазы.
Инверсия осуществляется иммобилизованным ферментом при температуре 70 °С. При этом получается 70-75 %-й раствор инверта. Для получения глюкозы и фруктозы из сахарозы используются также иммобилизованные дрожжи, обладающие инвергазной активностью. В этом случае носителем является гелеобразный субстрат, сохраняющий твердую консистенцию при температуре 75 °С. Концентрация сахарозы в исходном субстрате составляет 70 %, концентрация биокатализатора - 100 г/л, температура инверсии - 75 °С, а ее продолжительность - 3 ч. Инверт широко используется в пищевой промышленности. Биообъектом в инверсии служат S. cerevisiae и S. kluyveromyces.
В качестве подсластителей (второй путь) биотехнология рекомендует использовать ряд эффективных продуктов. Так. из цветочного растения дамелии (Судан) в Е. coli был трансплантирован ген, детерминирующий синтез сверхсладкого белка тауматина. Из южноамериканского растения ребадианы в Е. coli трансплантирован ген сладкого белка стевозида. В настоящее время с помощью генной инженерии или путем совмещения микробного синтеза с химической трансформацией микробных метаболитов получены многие подслатигели как заменители сахара.
Сладость по сравнению с сахарозой:
сорбит |
- 0,5 |
ацесульфат К |
-150,0 |
маннит |
- 0,7 |
стевозид |
- 150,0 |
ксилит |
- 1,0 |
аспартам |
- 200,0 |
цикламат |
- 50,0 |
сахарин |
- 300,0 |
глицерин |
- 100,0 |
тауматин |
- 3000,0 |
Больные сахарным диабетом широко применяют в пищу сладкий дипептид аспартам. Молекула его состоит из двух аминокислот: фенилаланина и аспарагиновой кислоты. Эти аминокислоты получают микробиологическим путем, а аспартам из них с помощью ферментов.
Новый класс подсластителей создан на основе фруктозы. Они получили название фруктозилоглигосахаридов и состоят из 2,5-фруктозилостатков. Они не разрушаются в организме, безвредные и имеют сладкий вкус. Фруктозилоглигосахариды продуцируют микроорганизмы родов Aspergillus, Fusarium, Aureobasidium. Если клетки Aureobasidium pullulans иммобилизовать в геле атьгината кальция (2 %-го), то такая биотехнологическая система стабильно работает в течение 60 суток при температуре 50 °С, pH 5,5 и скорости протока 0,05 ч-1. Содержание сахарозы в среде равно 77 %, а выход фруктозилоглигосахаридов - 55 %. Нередко используют полунепрерывный процесс конверсии сахарозы с заменой субстрата через каждые 20 ч.
Биотехнологические процессы в молочной промышленности, Молоко - это высокопитательный пищевой продукт. Оно содержит около 600 различных хорошо усвояемых соединений. Важным компонентом молока являются ферменты, их выделено более 20. Одни из ферментов синтезируются непосредственно в секреторных клетках молочной железы (лактосинтаза, щелочная фосфатаза, ксантиноксидаза, лизоцим), другие поступают в молоко из крови животного (каталаза, протеиназа, рибонуклеаза, альдолаза). Кроме этих ферментов в молоке находятся энзимы, синтезированные микрофлорой молока и бактериальных заквасок. Наконец, некоторые ферментные препараты специально вносят в молоко при изготовлении различных молочных продуктов (сычужный фермент, пепсин, ß-галактозидаза).
Ферменты молока и молочных продуктов имеют важное практическое значение. Так, ферменты классов гидролаз, оксидоредуктаз, трансфераз используются в производстве кисломолочных продуктов и сыров, В то же время многие липолитические и протеолитические ферменты вызывают порчу и снижение пищевой ценности молочных продуктов при их выработке и храпении. По активности некоторых ферментов судят о санитарно-гигиеническом состоянии молока и эффективности его пастеризации.
Особую пищевую значимость имеют кисломолочные продукты. Каждый народ имеет хотя бы одно блюдо, приготовленное путем брожения. В Армении это мацони, в Болгарии - кефир, во Франции - сыры типа Рокфор, в России - ржаной хлеб и простокваша.
Брожение - основа приготовления ряда молочных продуктов. В то же время процесс брожения молочного сахара - причина порчи молочных продуктов: излишняя кислотность,
вспучивание творога, сметаны, сыра и др. Известно несколько типов брожения, все они до образования пировиноградной кислоты идут по одному пути. Конечными продуктами брожения могут быть молочная, пропионовая, уксусная, масляная кислоты, спирт и другие соединения.
Молочнокислое брожение, вызываемое лактобактериями, является основным процессом при изготовлении заквасок, сыра и кисломолочных продуктов. Оно протекает по следующей схеме:
![]()
Установлено, что гомоферментативные молочнокислые бактерии образуют, главным образом, молочную кислоту (более 90 %). Гетероферментативные бактерии около 50 % глюкозы превращают в молочную кислоту, а остальное количество - в этанол, ацетат и диоксид углерода. Для расщепления глюкозы они используют пентозофосфатный путь, так как у них отсутствует альдолаза, расщепляющая фруктозо-1,6-дифосфат на две молекулы триозы.
У дрожжей и некоторых плесневых грибов в анаэробных условиях протекает спиртовое брожение:

В незначительном количестве дрожжи образуют другие спирты: изобутиловый, пропиловый, глицерин, а также уксусную, пропионовую, янтарную кислоты, ацетоин и диацетил. Спиртовое брожение имеет место при выработке кефира, кумыса, курунги и других кисломолочных продуктов.
Пропионовокислое брожение вызывается пропионовокислыми бактериями. Эти бактерии превращают глюкозу в пропионовую и уксусную кислоты:
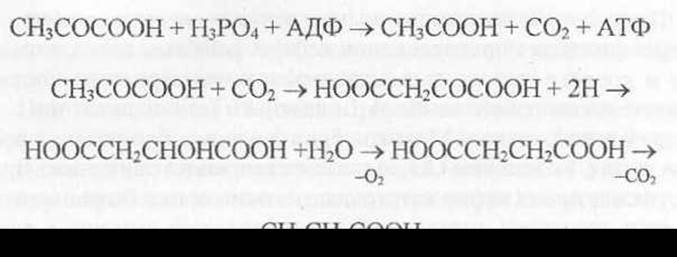
Пропионовокислое брожение играет важную роль в процессе созревания твердых сыров.
В маслянокислом брожении конечными продуктами являются масляная, уксусная кислоты, СО2 и водород:
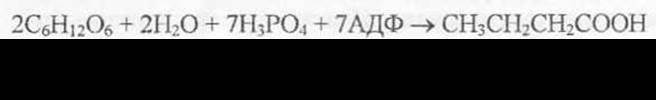
Этот вид брожения нежелателен, ибо он способствует появлению неприятного вкуса, запаха кисломолочных продуктов, вызывает вспучивание сыров.
Кисломолочные продукты за счет молочнокислых бактерий Lactobacillus acidophilus нормализуют деятельность кишечной микрофлоры и предотвращают развитие чужеродных микробов.
Известно много разных технологий изготовления кисломолочных продуктов. Так, в технологии приготовления ацидофилина используют чистые культуры L. acidophilus. Молоко стерилизуют 15 мин при 120 °С или 30 мин при 110 °С, добавляют чистую посевную культуру и выдерживают 20-48 ч при температуре 35-37 °С до получения продукта требуемой кислотности. Количество живых бактерий в 1 мл ацидофилина должно быть не менее 200 млп, а содержание молочной кислоты должно составлять 0,65 0,75 %. Во время брожения ацидофильные бактерии синтезируют органические кислоты, ассимилируя глюкозу, галактозу, лактозу и другие сахараю.
Популярным кисломолочным продуктом является кефир. В древности для приготовления кефира кобылье, козье, овечье и коровье молоко засевали «кефирными зернами». Они представляли собой симбиоз L. casei, S. kefir и некоторых видов стрептококков. Молоко сбраживалось в бурдюках, а в результате выделения СО2 напиток становился шипучим. В настоящее время кефир изготовляют в основном из коровьего молока.
В йогурте микрофлора смешанная, но доминирует болгарская палочка L. bulgaricus, сбраживающая глюкозу, галактозу и лактозу. Кумыс получают из кобыльего молока с помощью L. casei, стрептококков и дрожжей, сбраживающих лактозу.
По характеру брожения лактозы кисломолочные продукты разделяют на две группы. Первая - это простокваша, ацидофилин, йогурт, творог, сметана. В основе их изготовления лежит молочнокислое брожение. Вторая группа - это продукты со смешанным молочнокислым и спиртовым брожением (кефир, кумыс, курунга). Технология кисломолочных продуктов различается температурой изготовления, способом свертывания молока, интенсивностью протеолиза. Протеолиз более активно протекает при выработке кефира, кумыса и курунги.
Основными процессами при выработке кисломолочных продуктов являются: молочнокислое и спиртовое брожение, коагуляция казеина и гелеобразование. В результате указанных процессов формируются консистенция, вкус и запах продуктов. Коагуляция казеина происходит под влиянием молочной кислоты (кислотное свертывание белков молока), а при изготовлении творога под действием лактата и сычужного фермента. Механизм кислотной коагуляции белков молока заключается в следующем:
♦ лактат снижает отрицательный заряд мицелл казеина, что приводит к снижению pH до 4,6-4,7. В изоэлектрической точке (рІ) макромолекулы белка теряют растворимость, устойчивость и агрегируют;
♦лактат нарушает структуру казеинаткальцийфосфатного комплекса (кальций и фосфат кальция переходят в плазму молока) и мицеллы казеина диспергируют.
При постепенном понижении pH молока частицы казеина образуют нерастворимые в воде агрегаты и нити. Затем формируется единая пространственная сетка молочного сгустка, в петли которой захватывается дисперсионная среда с шариками жира и другими составными частями молока. Наступает гелеобразование - обратимое превращение золя в гель. Свойства белковых сгустков (вязкость, прочность, эластичность, упругость, хрупкость, способность отделять сыворотку) зависят от свойств молока и бактериальных заквасок, режимов тепловой и механической обработки, способа и продолжительности коагуляции белков молока и т.д.
Установлено, что формирование качества кисломолочных продуктов зависит от степени накопления лактата, этанола, СО2, ароматических веществ, растворимых форм азота, витаминов, антибиотиков и других соединений. Например, в простокваше, ацидофилине, йогурте нет спирта, а в кумысе из кобыльего молока его может быть до 2 %. К ароматическим веществам кисломолочных продуктов относят летучие кислоты, ацетальдегид, диацетил, ацетони и др.
Приготовление сыра. Сыр изготавливают из творога, полученного после свертывания казеина цельного или обезжиренного молока. Коагуляция казеина происходит под влиянием ферментов микробов, молочной кислоты или сычужного фермента. Коагуляцию вызывают St. lactis, St. cremoris, St. diacetilactis и др. В зависимости от технологии сыроварения, сыворотку полностью или частично отделяют от творога на пресс-фильтре. Творог засевают культурами в соответствии с сортом получаемого сыра. При созревании химический состав и физические свойства творога существенно изменяются. Так, острый привкус сыра рокфор связан с действием липазы, которая расщепляет жиры молока с образованием жирных кислот: капроновой, каприловой, каприновой и др.
Созревание сыра длится от нескольких недель до нескольких месяцев (сыр чеддер созревает 8 мес.). Первые недели созревания число микроорганизмов в массе сыра увеличивается и достигает нескольких сотен млн на 1 г массы сыра. Затем число живых бактерий и дрожжей снижается. Сыр должен созревать при пониженной температуре, для сыра рокфор, например, она не может быть выше 9 °С.
В настоящее время более 500 сортов изготавливают с применением сычужного фермента (реннин, химозин). Он эффективно осаждает казеин и расщепляет молочные белки до водорастворимых компонентов. Сычужный фермент можно получить не только из сычуга телят, но и из микроорганизмов рода Mucor pusilus и Mucor miechei, однако протеолитическая активность фермента оказывается весьма высокой, что ухудшает качество сыра. Сейчас примерно 10 % используемого реннина имеет микробное происхождение.
Молочный сахар. При производстве 1 т сыра образуется 9 т сыворотки и пахты. В каждой тонне сыворотки содержится около 5 кг высококачественного белка, витамины группы В, аминокислоты, все важнейшие минеральные элементы. Особая ценность сыворотки связана с лактозой. В 1 т молочной, творожной или подсырной сыворотки содержится около 50 кг молочного сахара - ценнейшего сырья для пищевой и микробиологической промышленности.
Биотехнологические приемы переработки молочной сыворотки основаны либо на брожении лактозы, либо на ее окислении. Брожение лактозы позволяет получить несколько продуктов:
♦ лактат. Он используется в качестве подкислителя при производстве джемов, желе, кондитерских изделий, наливок, экстрактов при консервировании овощей. Лактат применяют для регулирования pH пивного сусла в кожевенной, текстильной промышленности, медицине, для приготовления моющих средств, отделки натуральных тканей. Для сбраживания лактозы молочной сыворотки в качестве продуцентов используют L. bulgaricus, L. acidophilus, L. casei, St. lactis;
♦ глюкоза и галактоза получаются в результате биогидролиза лактозы с помощью иммобилизованной лактазы (ß-галактозидазы). Степень конверсии молочного сахара составляет 80 %;
♦ сывороточные белки и небольшое количество бактериальных клеток. Это ценный белковый концентрат, который используется в качестве корма;
♦ этиловый спирт. Образование этанола при сбраживании углеводов, в т.ч. лактозы известно давно. Этанол широко применяется в качестве горючего, растворителя красок, смол, эфирных масел, жиров, восков, для повседневных нужд в медицине, ветеринарии, химических лабораториях и т.д.
Второй путь использования лактозы - окисление, которое применяют в основном для получения биомассы дрожжей и молочнокислых бактерий. Биомасса затем используется в качестве кормов, кормовых продуктов «Промикс», «Провилакт», для получения сухого заменителя цельного молока, витаминов, ферментов, органических кислот, микробного жира и др.
Переработка молочной сыворотки на основе биотехнологии преследует следующие цели:
♦ повышение номинальной стоимости сыворотки на счет превращения ее в более ценные продукты;
♦ максимальное использование всех составных компонентов молока. Если отбрасывать сыворотку, то теряется до 50 % сухих веществ молока;
♦ охрана окружающей среды на основе создания безотходных технологий или резкого снижения БПК в сточных водах молокоперерабатывающих предприятий.
Биотехнологические процессы в мясной промышленности. Здесь можно выделить несколько направлений.
1. Применение пищевых добавок. Их разделяют на следующие группы:
♦ улучшающие вкус и аромат мясных продуктов (глутаминовая кислота и глутаминат натрия);
♦ вещества, повышающие интенсивность и стабильность окраски (аскорбиновая кислота, изоаскорбиновая кислота, аскорбинат натрия и изоаскорбинат натрия);
♦ вещества, повышающие влагоудерживающую способность фарша: усилители гидратации мышечных белков (натриевые соли фосфорных кислот), связывание и удерживание влаги в продукте (мука и крахмал);
♦ частичные заменители мяса (обрат, казеин, казеинат, сыр, кровь, шкурка, губы, жилки).
Некоторые из этих пищевых добавок получают биотехнологическим путем или используют биотехнологические процессы для их получения. Например, казеин и казеинат, представляющие собой влажный обезжиренный белок, получают из обезжиренного молока (обрата) путем осаждения молочнокислыми стрептококками.
2. Переработка непищевых отходов мясных производств:
♦ производство сухих животных кормов и технических жиров. Это мясокостная, мясная, кровяная и костная мука. Они представляют собой концентрированный белковый корм, весьма устойчивы при хранении и легко транспортируются;
♦ кератинсодержащее сырье (рога, копыта, щетина, перо и др.). При различных видах его гидролиза получают аминокислоты, кормовой полуфабрикат для телят, кератиновой клей, органоминеральные удобрения, а также связующий материал для литейных стержней и форм.
3. Производство препаратов ферментативного действия. Из поджелудочной железы получают дезоксирибонуклеазу, химотрипсин, трипсин, рибонуклеазу, панкреатин.
Приведем технологическую схему получения панкреатина. Поджелудочную железу, дефростируют, измельчают, заливают двухкратным объемом ацетона и выдерживают 24 ч при периодическом помешивании. Так повторяют 3-4 раза, затем фарш отжимают, раскладывают на противни или рамы и сушат при температуре 35—40 °С в течение 6-8 ч. Сухой продукт измельчают на шаровых мельницах до тонкого порошка, просеивают и определяют активность. После этого порошок смешивают с наполнителем - сахарной пудрой или лактозой. 11о- лученный препарат - тонкий порошок серовато-желтого цвета, активным началом которого являются ферменты поджелудочной железы. Панкреатин мало растворим в воде и не растворим в спирте, содержание влаги в нем при использовании сахарной пудры 4,5 %, а лактозы - 7 %. Содержание жира не должно быть более 2 %. Препарат сохраняют в хорошо закупоренных банках, в сухом прохладном месте. Срок годности 2 года.
Из слизистой оболочки сычугов крупного рогатого скота, молочных телят и ягнят, свиных желудков получают: пепсин пищевой, пепсин медицинский, ацидин-пепсин, желудочный сок, сычужный фермент;
Из семенников быков получают ферментные препараты: ронидазу, лидазу и др., которые находят широкое применение в медицине и ветеринария.