Биотехнология - Ю.О. Сазыкин 2006
Общая биотехнология
Геномика и протеомика
Геном человека - Конформационные болезни
Обобщающее название «конформационные болезни» появилось в научной печати в самое последнее время. Оно может охватывать множество еще не описанных, принципиально новых по своей природе заболеваний. Непосредственной причиной его появления в литературе стали наблюдения над необычными инфекционными заболеваниями как у животных, так и у людей. Возбудитель передается от животных человеку. Болезнь приводит к неминуемому смертельному исходу. Гистопатологическая картина демонстрирует губкообразное состояние серого и/или белого вещества головного мозга («трансмиссивная губкообразная энцефалопатия»), ввиду отсутствия лекарственных препаратов, а также мер борьбы с болезнью, названной «коровье бешенство», правительства разных стран ограничиваются запрещением вывоза мясных продуктов из определенного региона и уничтожением зараженных животных. Случаи заболевания человека относительно редки, но частота появления их сильно варьирует в разных странах и местностях.
Особый интерес вызывает не только степень опасности болезни, но и принципиальная новизна относящихся к ней молекулярно-биологических данных. Исследования последнего времени показали, что открыт новый «мир» неизвестных ранее инфекций, которые назвали «конформационные болезни». Причем рядом авторов подчеркивается: все, что известно о конформационных болезнях к настоящему времени, может быть лишь «надводной частью айсберга».
Вначале это заболевание отнесли к вирусным инфекциям, однако вскоре выяснилось, что причиной болезни «скрепи» (scrapie) у овец, которые были завезены из Германии в Исландию для развития каракулеводства, является инфекционный агент, не содержащий нуклеиновых кислот, что полностью ломало привычные представления биологов и медиков. Сходное заболевание под названием «куру», при котором инфекционный агент также не содержит нуклеиновых кислот, было обнаружено у живущих в труднодоступных местностях Новой Гвинеи племен аборигенов, не потерявших обычаев каннибализма.
К настоящему времени известны четыре разновидности болезни со столь необычным инфекционным агентом у людей (в частности, болезнь Крейцтфельдта — Якоба, куру) и несколько разновидностей у диких, сельскохозяйственных и домашних животных. Обнаружена корреляция между распространением болезни у людей и употреблением в пищу мяса сельскохозяйственных животных, молодняк которых откармливался с использованием мясокостной муки и других субпродуктов убоя овец, в частности овечьих голов. Щадящая технология обработки субпродуктов (для повышения их питательной ценности) усиливает опасность возникновения эпидемии.
Инфекционный агент был выделен и оказался низкомолекулярным белком (27 — 30 кДа). Он получил название «инфекционный прионный белок». В качестве инфекционной единицы предложено название «прион». Это слово образовано из анаграммы английских слов Proteinaceous infectious (particle), т.е. подчеркивается, что этот белок обладает самоинфицирующей способностью. Размножение приона происходит за счет не синтеза «de novo», а изменения конформации предшественника нормального белка. Обнаруживается такой нормальный белок, в основном в нервной ткани, где экспрессия его гена в 50 раз выше, чем в других тканях. Этот белок регулирует циркадные — суточные ритмы активности и участвует в передаче нервных импульсов. Изменение прионом конформации нормального белка ведет к тому, что сам измененный белок превращается в прион. В результате содержание в клетке нормального белка падает, а содержание приона, соответственно, увеличивается, что приводит к ее гибели. Схематично данный процесс выглядит следующим образом:
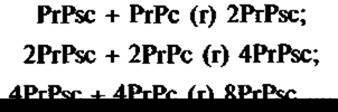
где PrPsc — прион (sc — scrapie), PrPc — нормальный белок клетки (с — cell).
Некоторыми авторами высказывается предположение, что гибель нейронов при губкообразной энцефалопатии происходит путем апоптоза.
Попытки профилактики и лечения губкообразных энцефалопатий самыми разнообразными соединениями делались неоднократно. Для этого использовались стероиды, арахисовое масло, амфотерицин В, декстран-сульфат, некоторые из антрациклинов и т.д. Однако эти попытки ни к чему серьезному не привели, кроме некоторого замедления развития клинических симптомов заболевания за счет удлинения инкубационного периода, что не свидетельствует об избирательном действии на прион. Отметим: РrРс и PrPsc — изоформы одного белка; антитела на прионы не образуются, что существенно затрудняет лабораторную диагностику, иммунопрофилактику и иммунотерапию прионных болезней.
Согласно официальному мнению экспертов ВОЗ создание высокоэффективных избирательных средств лечения прионных болезней должно исходить из использования данных о трехмерной структуре прионов. Подвергающийся изменению нормальный белок (РrРс) содержит четыре а-спиральных домена, соединенных дисульфидными мостиками. В молекуле же приона (PrPsc), являющейся инфекционной изоформой, только два домена остаются а-спиральными, а два других становятся ß-спиральными. Возможно, что это происходит в результате точечных мутаций в гене, кодирующем белок РrРс. Например, было установлено, что некоторые конститутивные белки могут изменяться по форме и превращаться в смертельно опасные прионы.
В борьбе с прионными болезнями предлагается использовать антисмысловые олигонуклеотиды для подавления экспрессии соответствующих генов. Другой потенциально возможный путь создание своего рода молекулярного «клея», который, проникая через гематоэнцефалический барьер, связывал бы гидрофобную «сердцевину» РrРс, т.е. стабилизировал бы а-спирали и предотвращал переход РrРс в PrPsc. Как альтернативный вариант предполагается создание «клея», который взаимодействовал бы с прионом (PrPsc), «окутывая» его, и предотвращал взаимодействие с РrРс. Эти предложения пока еще достаточно абстрактны, но демонстрируют современные подходы к лечению недавно открытых и необычных заболеваний.
Контрольные вопросы
1. В чем отличие таргетного скрининга от традиционного при поиске и отборе новых лекарственных средств?
2. В чем отличие метода исследования в геномике от метода исследования в протеомике?
3. Как можно сопоставить геномику и протеомику в части поиска и создания новых лекарственных средств?
4. Как классифицируется геномика согласно поставленным в этой области задачам?
5. Что означает термин «обратная генетика»?
6. Каково в настоящее время практическое значение достижений в области геномики для фармации?
7. Что означает понятие «существенности» гена?
8. В чем отличие генотерапии ex vivo от in vivo?
9. Что такое антисмысловые олигонуклеотиды?
10. В чем необычность конформационных болезней?