Биотехнология - Ю.О. Сазыкин 2006
Частная биотехнология
Лекарственные препараты, получаемые в фармацевтической промышленности биотехнологическими методами
Стероиды
К фармацевтическим препаратам, в производстве которых используется биотехнология, принадлежат стероидные гормоны, к основным представителям которых относятся кортикостероиды, прогестогены, эстрогены и андрогены. Они не только участвуют практически во всех жизненно важных функциях организма, но и как лекарственные средства высоко избирательны, имеют большую широту спектра действия. В медицинской практике стероидные гормоны применяются в качестве противовоспалительных, диуретических, анаболических, контрацептивных, противораковых лекарств. При сравнении структуры наиболее ценных кортикостероидов, прогестогенов, эстрогенов и андрогенов можно обнаружить, что все они содержат в положении С-3 кетогруппу, кроме эстрогенов, у которых кольцо А — ароматическое. Кортикостероиды содержат при С-17 гидроксизамещенную ацетильную группу. Их отличительной особенностью является наличие кислородной группы у 11-го углеродного атома. Андрогены и эстрогены в положении С-17 имеют карбонильную или гидроксильную группы, а их модифицированные аналоги - алкильную или этинильную группу. К стеринам (стеролам) относятся стероиды, имеющие в положении С-3 гидроксильную группу.
В основе истории синтеза стероидных гормонов лежат методы биотрансформации (биоконверсии), результатом применения которых является превращение метаболитов в структурно родственные соединения под влиянием микроорганизмов или микробных клеток. В этом процессе весьма существенно, что микроорганизмы могут влиять только на отдельные (единичные) стадии довольно сложных и длительных процессов химического синтеза.
Общей чертой всех процессов микробиологической трансформации является изменение именно молекулярной структуры трансформируемого вещества, а не синтез молекулы de novo. Основные процессы микробиологической трансформации — это окисление, восстановление, декарбоксилирование, дезаминирование, гидролиз, метилирование, конденсация, изомеризация и т.д.
Реакции биотрансформации в большинстве строго специфические, осуществляются индуцибельными ферментами в строго определенном порядке. Так, например, процесс гидроксилиро- вания относится к дыхательным системам (гидроксилаты содержат ионы железа или цинка), а в дегидрировании участвуют ферменты флавиновой природы, содержащие рибофлавин и витамин В12.
С позиций физиологии биотрансформация стероидных соединений как источников углеродного питания (стерины расщепляются до СО2 и Н2О) связана с метаболизмом микроорганизмов, в процессе которого происходит детоксикация субстрата (например, 11а-оксисоединения обладают меньшим отрицательным влиянием на рост и дыхание клеток).
Использование биотрансформации при получении тех или иных продуктов известно с древних времен. В качестве примера можно привести методику получения уксуса еще во времена Древнего Вавилона (около 5 000 лет до н. э.), когда этиловый спирт с помощью микроорганизма Gluconobacter suboxidans превращали в уксусную кислоту (естественно, что все подобные методы носили чисто эмпирический характер и не имели никакой научной подоплеки).
В настоящее время возможности и достоинства использования биотрансформации проявились наиболее ярко в области превращений стероидных соединений. Дело в том, что сложность и громоздкость молекул стероидов затрудняет даже незначительные их модификации химическим путем. Микроорганизмы могут осуществлять уникальные реакции в синтезе лекарственных препаратов стероидной природы, например 1,2-дегидрирование и 11а- и ß-гидроксилирование. Промышленный синтез таких важнейших лекарств, как гидрокортизон, преднизолон, дексаметазон стал возможен только после разработки микробиологических способов их получения.
Первые сообщения о микробиологической трансформации стероидов появились задолго до установления их химической структуры. Так, еще в XIX в. было известно, что бактериальная флора кишечника млекопитающих превращает холестерин в капростерин, а холевую кислоту в дезоксихолевую. В 1913 г. было открыто полное расщепление холестерина микобактериями, но только в 1930 гг., после установления структуры основных стероидных гормонов, стали пытаться применить биотрансформацию как метод получения этих соединений.
В те годы ученые Базельского университета впервые получили из надпочечников кортизон. Однако лишь десять лет спустя было установлено, что кортизон эффективен при лечении ревматоидного артрита.
На примере промышленного получения кортизона можно показать, каких успехов можно достичь при использовании методов биотрансформации.
Первоначальный химический синтез кортизона насчитывал 37 стадий, и стоимость 1 г вещества составляла 200 долл. США. В 1952г. было обнаружено, что штамм Rhizopus nigricans способен гидроксилировать прогестерон (промежуточный продукт синтеза кортизона).
В результате синтез кортизона сократился до 11 стадий, а стоимость гормона упала до 6 долл, за 1 г. Кроме того, в случае применения биотрансформации брожение происходило при 37 °С и атмосферном давлении (105 Па) в водной среде, тогда как химический синтез требовал экстремальных температур и давлений, осложняя и удорожая технологию производства. Дальнейшее совершенствование биотехнологического производства (использование мутантных штаммов) позволило к 2002 г. снизить цену кортизона в США до 0,3 долл, за 1 г, т.е. в 600 с лишним раз меньше по сравнению с ценой в 1930 г.
Внедрение биотрансформации в процессы получения стероидных гормональных препаратов вызвало буквально переворот в фармацевтической промышленности, позволив многократно удешевить и сделать эти ценные лекарственные препараты доступными для большинства нуждающихся людей.
Для синтеза указанных гормонов используют природные соединения, содержащие стероидную структуру, которую необходимо химически модифицировать перед введением функциональных заместителей того или иного гормона.
В качестве исходного сырья для производства этих препаратов используются стерины растений (класс фитостеринов). Прежде всего, это — эргостерин, обнаруженный у многочисленных представителей растительного мира, а также у грибов и микроорганизмов.
Особенно много эргостерина в дрожжевых микроорганизмах (для его промышленного получения используют пекарские дрожжи).
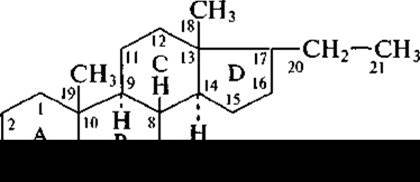
Следующий представитель фитостеринов — стигмастерин, который в значительных количествах присутствует в соевом масле и сахарном тростнике. Весьма близок к нему по структуре ß-ситостерин, отличаясь лишь отсутствием двойной связи в боковой цепи (в формуле показано стрелкой):
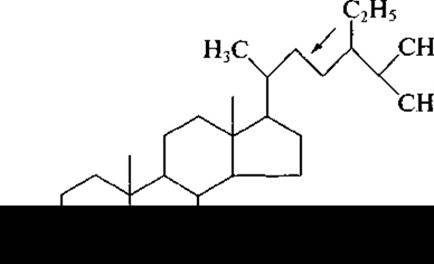
Ситостерины присутствуют в больших количествах в хлопковом масле, в зародышах пшеницы, в натуральном каучуке, в сахарном тростнике. Получают ситостерин и при переработке древесины в целлюлозно-бумажном производстве.
В условиях промышленного производства из ситостерина получают андростендион (АД) путем окисления боковой цепи стерина с образованием 17-кетоандростана с помощью мутантных штаммов Mycobacterium vacca (штаммы, у которых блокированы системы, ответственные за полный распад стероидного скелета). В этой комплексной технологии помимо химических стадий используются методы микробиологической трансформации для введения гидроксильной группы в 1,1 -положение стероидной структуры и двойной связи в 1,2-положение. Для этих групп известны альтернативные химические варианты, но они уступают по эффективности биотрансформации из-за многостадийности, более низкого выхода и по экологическим показателям. О высокой региоселективности микробиологического отщепления боковой цепи ситостерина (без затрагивания стероидного скелета) свидетельствует высокий выход (70—80%) продукта трансформации.
Кроме выхода целевого продукта важным показателем, определяющим экономичность процесса микробиологической трансформации стероидного субстрата, является концентрация стероида в культуральной жидкости. В данном процессе концентрация ситостерина составляет 10— 15 г/л, при этом стерин вносится в культуральную жидкость в микронизированном виде. Поскольку стероиды трудно растворимы в воде, то и целевой продукт трансформации — АД на 99 % выделяется в виде кристаллов.
Это свойство стероида определяет метод его извлечения. Сначала методом фильтрации культуральную жидкость отделяют от биомассы и кристаллов АД. Затем последние растворяют в ацетоне и еще раз фильтруют для отделения от биомассы. Концентрированием ацетонового раствора выделяют АД, который на конечной стадии перекристаллизовывают. Аналитический контроль реакции трансформации ведут отбором проб через определенные временные интервалы и анализом их методом тонкослойной хроматографии на силуфоле в присутствии «свидетелей» — исходного стероида, целевого продукта трансформации и некоторых промежуточных и побочных продуктов, которые участвуют в данном процессе. Дальнейшей химической модификацией АД получают такие препараты, как тестостерон, метилтестостерон, оксипрогестерона капронат, спиронолактон и др.
Биотрансформация стероидов — аэробный процесс глубинной ферментации, для проведения которой используется оборудование, отвечающее высокой степени массообмена. Трансформация может осуществляться как растущей на среде культурой, так и отмытыми от питательной среды клетками микроорганизма. Последний вариант предпочтительнее, поскольку облегчает выделение и очистку целевого продукта. Но, как показала производственная практика, не все микроорганизмы переносят промышленное сепарирование без потери активности; так, представители мукорових грибов очень чувствительны к сепарированию, тогда как представители несовершенных грибов теряют свою активность незначительно.
Способность трансформировать стероиды обнаружена в самых разных группах микроорганизмов. Используются, как правило, естественные штаммы, выделенные из почвы или из других объектов. Условно можно сказать, что процессы гидроксилирования наиболее распространены среди грибов. Так, процесс 11а-гидроксилирования способны осуществлять представители 300 видов микроорганизмов, причем 50 % из них — несовершенные грибы и 20% — фикомицеты. Бактериальным культурам больше присущи процессы окисления гидроксильных групп до кетонов, восстановление кетонов до оксигрупп, введение в кольцо стероидной молекулы двойных связей.
Наиболее известные 11а-гидроксилирующие культуры относятся к родам Absidia, Beanveria, Curvularia, Cunninghamella. Для дегидрирования в положении 1,2 в основном применяют Соrуnеbacterium simplex. Для изомеризации с одновременным окислением 3-оксигруппы в 3-кетогруппу широко используются штаммы Corynebacterium mediolanum (sin. Flavobacterium dehydrogenans). Отметим важность этой реакции, поскольку источники сырья (диосгенин, соласодин) содержат 3β-оксигруппу, тогда как активные стероидные препараты должны иметь 3-кетогруппу.
Специфическая особенность процесса биотрансформаций — использование чистых культур микроорганизмов. Поэтому все операции по подготовке и выращиванию трансформирующих культур проводят в стерильных условиях. Используют культурутрансформатор в стадии замедления роста, когда питательные компоненты среды в значительной степени израсходованы, а сильно разросшаяся культура подавляет рост посторонней микрофлоры. Что касается микробиологического контроля, то он осуществляется только на стадии выращивания трансформирующей культуры.
Стероиды — малорастворимые в воде соединения: их растворимость колеблется от 0,3 г/л (гидрокортизон) до 0,01 г/л (ацетонид фторкортексолона). Важным аспектом эффективности процессов трансформации является выбор оптимальной концентрации субстрата, зависящий от биологической доступности последнего, поэтому трансформационные процессы осуществляют обычно при концентрации субстрата в пределах 1 — 10 г/л, что предполагает нахождение основной массы стероида в твердой фазе. В этом случае необходимым условием является высокая степень предварительного измельчения стероидного субстрата (поступает в среду в микронизированном виде) с использованием ультразвуковых или механических измельчителей.
В случае, когда растворимость стероидного субстрата слишком мала для проявления присущей микроорганизму ферментативной активности, задействуют методы, повышающие водорастворимость стероидов.
Первый — подача стероида в растворителе, смешивающемся с водой (ацетоне, метаноле, этаноле, диметилформамиде, диметилсульфоксиде и др.). Ограничением для применения этого метода является токсичность определенных концентраций растворителей.
Второй — использование водорастворимых форм стероидов в виде натриевых солей 2,1-гемисукцинатов или фосфатов. Осложняющим моментом для широкого использования таких модификаций является высокая степень избирательности по отношению к ним со стороны микроорганизмов, например для дегидрирующего микроорганизма Corynebacterium simplex эти формы стероидов оказались недоступны.
Третий метод — заключение стероидов в растворимый комплекс с циклодекстрином. Использование комплекса стероидов с циклодекстрином не имеет ограничений предыдущих методов.
Микробиологическое гидроксилирование — наиболее часто применяемый метод получения стероидных препаратов, так как присутствие гидроксильных групп в 3,11,16,17-положениях молекулы стероида обусловливает, как правило, физиологическую активность для большинства гормональных стероидных препаратов.
Широко используется в промышленности микробиологический синтез одного из основных кортикостероидов — гидрокортизона (кортизола) и его синтетических аналогов: преднизолона и дексаметазона. В этом случае исходным продуктом для 11ß-гидроксилирования может служить вещество Рейхштейна (кортексолон), которое для краткости принято называть «вещество S»:
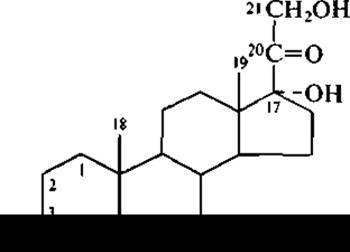
Само по себе «вещество S» является модифицированным продуктом биотрансформации (с помощью культуры Corynebacterium mediolanum) моноацетата «вещества R»:
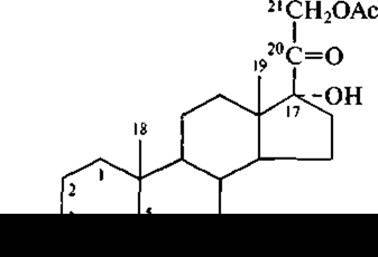
Процесс ферментативного превращения моноацетата «вещества R» в «вещество S» с помощью вышеуказанной культуры состоит из гидролиза 21-ацетогруппы и окисления 3 ß-гидроксигруппы в 3-кетогруппу с одновременной миграцией двойной связи.
Отметим, что данная трансформация имеет принципиальное значение в производстве кортикостероидов, так как практически определяет количественный выход «вещества S», что в свою очередь в значительной степени влияет на конечный выход продуктов следующих трансформаций.
Применение в качестве субстрата не «вещества S», а моноацетата «вещества R» позволило увеличить выход гидрокортизона с 50 до 70-73%.
Вместе с тем было установлено, что использование в производстве гидрокортизона промышленного штамма грибковой культуры Curvalaria lunata имеет преимущество по выходу целевого продукта и по наименьшему количеству примесей перед другими микроорганизмами, например, Absidia ovchidis. Гидроксилирование в 11ß-положении сопряжено с образованием 11a-, 14a- и 6ß-гидроксипроизводных в качестве нежелательных, побочных продуктов данной реакции.
Широкую субстратную специфичность гидролаз демонстрируют многие микроорганизмы. Например, штамм Cunninghamella blakesleeana вводит оксигруппу в 11ß-положение большого набора стероидов — производных эстрана, тестостерона, кортексолона, прогестерона и т.д.
Главным препятствием, стоящим на пути развития промышленного микробиологического гидроксилирования стероидов является низкая производительность ферментаций, несмотря на высокий процентный выход по субстрату. Причины этого, с одной стороны, практическая нерастворимость стероидных субстратов в воде, а с другой — токсичность применяемых растворителей и, следовательно, невозможность использования достаточно высоких концентраций субстрата.
Микробиологическое дегидрирование стероидов также имеет большое значение, поскольку введение 1,2-двойной связи способствует повышению физиологической активности. Например, преднизалон:
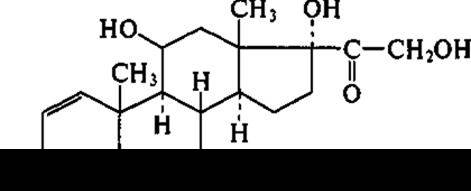
являясь 1,2-дегидроаналогом гидрокортизона, превосходит последний по противовоспалительной и антиаллергической активности, проявляя при этом значительно меньше побочных эффектов. В реакции 1,2-дегидрирования принимает участие внутриклеточный фермент 3-оксистероид-1,2-дегидрогеназа, локализованный на внешней стороне цитоплазматической мембраны. В процессе реакции электроны с фермента переносятся на кислород через дыхательную цепь; потребление кислорода происходит стехиометрически. Биотрансформация гидрокортизона в преднизолон осуществляется штаммами Mycobacterium globiforme, дегидрогеназы которых обладают широкой субстратной специфичностью, что позволяет получать целевые продукты с высоким количественным выходом — до 85 %. Поэтому данный процесс экономически выгоден и в целом обеспечивает рентабельность производства.
Возможны случаи, когда для биотрансформации требуются смешанные культуры или последовательное добавление микробных штаммов или видов, каждый из которых строго индивидуален в осуществлении каждой специфической стадии. Значительный эффект биотрансформации связан с использованием иммобилизованных клеток (более стабильных, чем ферменты или клеточные культуры). В пользу данного метода свидетельствует тот факт, что участвующие в этом процессе ферменты — дегидрогеназы представлены довольно лабильными белками, выделение и очистка которых является трудоемкой и дорогой процедурой. Кроме того, интактные клетки микроорганизмов обладают более совершенными защитными механизмами и возможностью регенерировать кофакторы, необходимые для ферментативных реакций.
Также этот метод позволяет положительно решать проблемы, связанные с нерастворимостью стероидных субстратов. Наконец, данный метод дает возможность многократного использования иммобилизованных клеток с применением последующей автоматизации процесса, что в конечном итоге приводит к значительному уменьшению затрат на выделение и очистку продуктов реакции.
К методам применяемой иммобилизации относятся адсорбция, ковалентное связывание, микрокапсулирование, а также включение в разные полимеры. Например, включение в альгинатные гели относится к мягким методам иммобилизации, т.е. клетки после иммобилизации остаются жизнеспособными и могут осуществлять полиферментные процессы. Положительным качеством геля является возможность размножения в нем клеток, а также его способность к растворению при изменении pH и температуры, что позволяет выделять жизнеспособные клетки.
В заключение отметим, что в промышленном производстве стероидных препаратов биотехнологические методы имеют конкретные преимущества перед методами химического синтеза:
✵ возможность реакций, недоступных для химического синтеза;
✵ превращение субстрата в биологически активную форму соединения в течение одной стадии процесса (в отличие от многостадийного и весьма затратного химического синтеза);
✵ удобство, экономичность и экологичность производства.