Практическая химия белка - А. Дарбре 1989
Аффинная хроматография белков
Примеры
Очистка рецепторов гормонов
Рецепторы гормонов являются минорными компонентами плазматической мембраны клетки, и в связи с этим для их выделения необходимо располагать высокоспецифическим методом. Применение аффинной хроматографии в этом случае более предпочтительно, так как метод основан на использовании функциональных, а не общих физико-химических свойств рецепторов. Однако для успешного применения аффинной хроматографии следует принимать во внимание следующие рекомендации:
1) необходимо исключить неспецифическое взаимодействие рецепторов и других белковых компонентов с пространственной группой или материалом- носителем, затрудняющее биоспецифическую десорбцию свободным лигандом и снижающее степень очистки рецептора;
2) иммобилизованный лиганд должен узнавать специфический участок рецептора и связываться с ним. Этот критерий приобретает особое значение при использовании низкомолекулярных лигандов (стероидов, холинэргических и адренэргических наркотиков), так как возможно взаимодействие групп лиганда, участвующих в связывании с рецептором, с пространственной группой носителя. Такое взаимодействие может значительно изменить химические, физические и пространственные характеристики лиганда и таким образом существенно снизить специфическое связывание;
3) элюирование рецептора с аффинного сорбента проводят в мягких условиях, причем константа связывания (ассоциации) должна быть выше 109—1010 М/л. Обработка в жестких условиях приводит в большинстве случаев к потере биологической активности (часто это единственный параметр, по которому определяют содержание рецептора);
4) для количественного определения рецептора необходимо использовать простую методику, легко воспроизводимую в различных условиях.
Далее приводится анализ синтеза различных аффинных сорбентов для очистки рецептора катехоламина из плазматических мембран эритроцитов индюка. Этот рецептор находится в тесном взаимодействии с аденилатциклазной системой. Агонистами являтся эпинефрин или изопреналин (изопротеринол), антагонистами — альпренолол или пропранолол. В обоих случаях происходит быстрое и обратимое связывание.
Первые попытки получить эффективный сорбент были осуществлены путем прямого присоединения норэпинефрина к агарозе или через аминогруппу агониста к пространственной группе агарозы [6]. Однако очистка на таких сорбентах невозможна вследствие блокирования аминогруппы, которая играет основную роль в фармакологической активности агониста.
По другому варианту катехоламины присоединяют с помощью ароматического кольца к диазотированным пространственным группам кремнезема (макропористого стекла). Иммобилизованный гормон активизирует аденилатциклазную систему в тканях, клетках и плазматических мембранах [10]. Однако дополнительные исследования показали, что участки связывания [3Н]порэпинефрина не идентичны участкам связывания β-адренэргического рецептора [11]. Биологическая активность, приписываемая гранулам кремнезема, связана с присутствием свободного лиганда в препарате кремнезема, которое можно объяснить, в частности, как результат гидролиза связи лиганд — носитель в присутствии веществ, содержащих аминогруппы, например трис-НСl или альбумина.
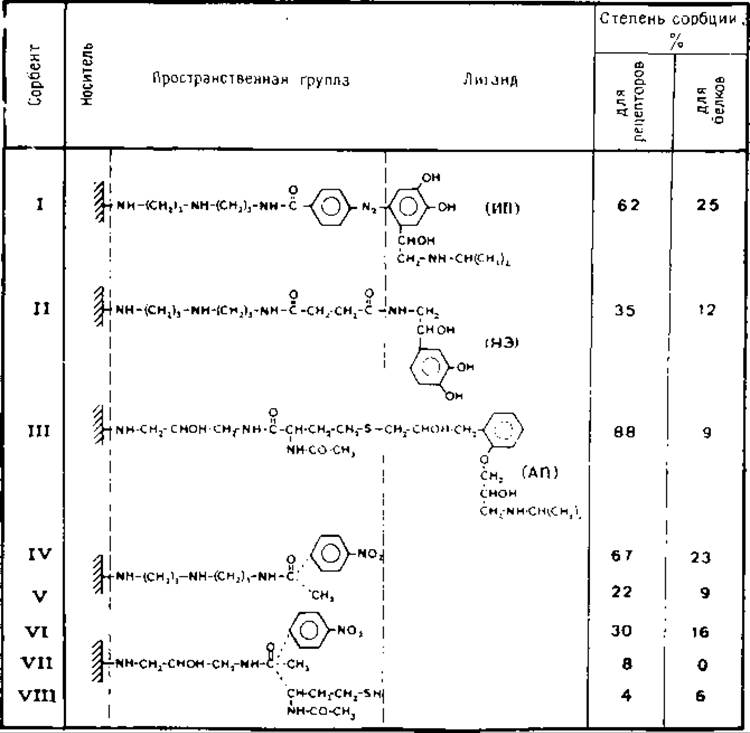
Описан синтез трех классов аффинных сорбентов и исследованы их следующие свойства: высвобождение свободного лиганда из гранул сорбента, эффективность сорбции рецепторов и степень неспецифической сорбции [9] (табл. 5.1):
1) агонист изопротеренол присоединен через ароматическое кольцо к диазотированным пространственным группам агарозы (сорбент I);
2) агонист норэпинефрин присоединен через боковые группы этаноламина с помощью амидной связи (сорбент II);
3) антагонист альпренолол обрабатывают N-бромосукцинимидом и полученный бромогидрин конденсируют с тиолгруппами пространственных групп агарозы (сорбент III). Адсорбционные характеристики указанных сорбентов приведены в табл. 5.1.
Сорбент I удерживает 62% рецепторов н 25% солюбилизированных белков. Соответствующий конъюгат пространственная группа — агароза (сорбент IV) удерживает 67% рецепторов и 23% белков. Таким образом, наблюдаемый процесс связывания рецепторов в большей степени обусловлен структурой пространственной группы, чем свойствами иммобилизованного лиганда. Аналогичное явление наблюдается при сравнении сорбентов, содержащих иммобилизованный с помощью аминогрупп норэпинефрин (сорбент ІІ). Сорбент II и соответствующий конъюгат пространственная группа — агароза удерживают 35% и 22% рецепторов и 12% и 9% белков. Анализ адсорбционных свойств различных конъюгатов пространственная группа — агароза показал, что пространственная группа, содержащая ароматическое кольцо и диаминодипропиламиногруппу (сорбент IV), сорбирует наибольшее количество (—)-[3Н]дигидроальпренололсвязывающих участков и белка. Такое специфическое связывание значительно снижается при замене ароматической группы па метильную (сорбент V) и увеличении гидрофильности алифатического компонента пространственной группы (т. е. путем замены диаминодипропиламиногруппы на N-ацетилдиаминопропан-2-олгруппу, сорбент VI). Ацетамидное и N-ацетилцистамидное производные диаминопропан-2-олагарозы (сорбенты VII и VIII) являются практически инертными. Эти данные свидетельствуют о том, что присутствие ароматического кольца или гидрофобных участков в пространственной группе приводит к увеличению неспецифического связывания ß-рецепторов и белков. Сорбент III связывает 88% рецепторов, а соответствующая пространственная группа (сорбент VIII) удерживает лишь 4%. Оба сорбента связывают 9% и 6% белка.
Из трех классов аффинных сорбентов только конъюгат альпренолол-агароза (сорбент III) обладает необходимыми адсорбционными свойствами: удерживает наибольшее количество рецепторов и незначительное количество белка. Процесс адсорбции на этом сорбенте биоспецифичен, т. е. обусловлен взаимодействием с иммобилизованным альпренололом, а не с пространственной группой. С использованием радиоактивно меченых пространственной группы или антагониста установлено, что па стадии инкубации с рецептором не происходит отщепления свободного или связанного с пространственной группой лиганда: фракции, полученные при обработке сорбентов буфером или дигитониновым экстрактом, не ингибируют связывание (—)-[3Н]дигидроальпренолола со свежевыделенными мембранами.
Сорбент III был использован для выбора оптимальных условий очистки рецептора катехоламина из мембран эритроцитов индюка в статических условиях, на колонке или сочетанием обоих методов: сорбцию проводят в статических условиях с последующей промывкой и элюированием на колонке. Показано, что использование смешанного метода анализа полученных фракций является предпочтительным, так как значительно упрощает процесс промывки и позволяет также стандартизировать процесс элюции. Далее приводится детальное описание этой методики.
Табл. 5.1. Сорбция солюбилизированных ß-рецепторов и белков агонистами, антагонистами катехоламинов и пространственными группами, иммобилизованными на агарозе. Дигитониновый экстракт эритроцитарных мембран (0,9 мл) инкубируют с 100 мг каждого сорбента при 30 °С в течение 10 мин. В супернатантных фракциях, полученных после центрифугирования, определяют (—)-[3Н]дигидроальпренололсвязывающую активность и содержание белка. Степень сорбции определяют как разность между активностью и содержанием белка в исходном дигитониновом экстракте и в полученных супернатантных фракциях.
(ИП) — изопротеренол, НЭ — норэпинефрин и АП — альпренолол. Немодифицированная агароза сорбирует <2% солюбилизированных рецепторов и белков [9].
Очищенный препарат солюбилизированных дигитонином мембран, содержащий 1,5 мг белка или 4 пкмоля рецептора в 1 мл, наносят на 0,5 мл аффинного сорбента, помещенного в колонку, которую промывают 3 мл 0,01 М трис-HCl буфера, содержащего 0,09 М NaCl. Процесс нанесения и сорбции проводят в термостатированных условиях (30 °С), а затем промывают 2 мл буфера, содержащего 1 М NaCl. Элюирование проводят 5 мл концентрированного раствора [3Н]дигидроальпренолола, содержащего или 1 М NaCl, или, согласно более поздним работам, 0,05% дигитонина. Рецепторную активность определяют либо методом осаждения полиэтиленгликолем на стекловолоконных фильтрах [9], либо методом гель-фильтрации на сефадексе G-150, на котором происходит отделение радиоактивной метки от несвязанного лиганда.
Использование сорбента III позволяет осуществить 20 000-кратную очистку рецепторов плазматической мембраны эритроцитов за один хроматографический цикл. Выход составляет 25—30%. Метод был также успешно применен для очистки ß-рецептора эритроцитов лягушки [3].