Практическая химия белка - А. Дарбре 1989
Аналитические методы
Серусодержащие аминокислоты
Методы определения
8.9.1.1. Цистеин и цистин. По методике, описанной в работе [262] определяется сумма остатков цистеина и цистина в виде цистеиновой кислоты и метионин в виде сульфона. Можно проводить анализ углеводсодержащих образцов, некоторые аминокислоты (His, Тrр и Туr) при этом разрушаются [162].
Реагенты. Надмуравьиная кислота. К 9 мл 88%-ной муравьиной кислоты добавляют 1 мл 30%-ного Н2O2. Смесь оставляют на 1 ч при комнатной температуре, затем охлаждают до 0°С.
Раствор стандартов. Растворяют 20 мг цистина, 30 мг метионина и 20 мг аланина в 2 мл 1 М NaOH и доводят объем до 10 мл. Для анализа используют 10 мкл раствора.
Методика. К белку (содержащему около 0,1 мг цистина) в пробирке из пирекса приливают 2 мл раствора надмуравьиной кислоты и оставляют при 0 °С на 4 ч (для растворимого белка) или па ночь (для нерастворимого). Затем добавляют 0,3 мл 48%-ного НВr при встряхивании пробирки. Смесь испаряют досуха при 40 °С на роторном испарителе. Гидролизуют образец белка в 3 мл 6 М НСl в вакууме при 110 °С 18 ч; высушивают и анализируют с помощью ионообменной хроматографии. Выход метионинсульфона 100±2%, цистеиновой кислоты 94±2%. Число остатков полуцистин+цистеин, а также метионина лучше вычислять по отношению к молярным количествам стабильных в этих условиях аминокислот (Ala, Leu, Asp и Glu).
8.9.1.2. Определение сульфгидрильных групп и остатков полуцистинов. В основе метода определения как свободных сульфгидрильных групп, так и остатков полуцистинов в белке [343] лежит реакция, схематически изображенная с помощью уравнения (8.1).
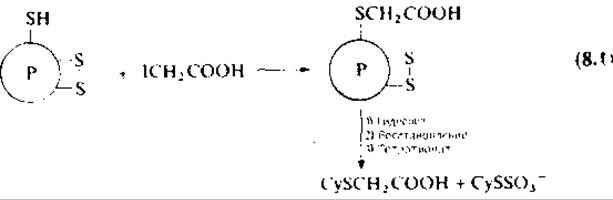
Определение свободных SH-групп. Растворяют белок (0,3 мкмоль) в 0,1 М трис — HCl-буфере, (pH 8,3), содержащем 1 мМ ЭДТА, при 4 °С в отсутствие или присутствии 6 М гуанидин∙HCl и ДТТ (0,1 мл, 10 мкмоль) и добавляют 10-кратный мольный избыток перекристализованной нодоуксусной кислоты (ІСН2СООН). Может быть использован калийфосфатный буфер (pН G,7). Гидролизуют 4 М метансульфокислотой (разд. 8.7.2). Определяют карбоксиметилцистеин на аминокислотном анализаторе.
Определение остатков полуцистина. Охлаждают 1 мл раствора гидролизата белка и добавляют к нему 0,3 мл пиридина (перегнанного над инигидрином), 0,9 мл 4 М NaOH (до pH 0,8) и затем ДТТ (4 мкл в 1 мл воды). Продувают азотом, закрывают пленкой парафильм и инкубируют при 37 °С 1 ч. По окончании восстановления добавляют твердый тетратионат натрия (00 мг, 200 мкмоль) и оставляют при 25° не менее чем па 5 ч для превращения всех остатков цистеина в 5-сульфоцистеины. Реакционную смесь упаривают на роторном испарителе в вакууме при 30 °С. Осадок после упаривания растворяют в 0,5 мл воды и вновь сушат досуха (для удаления пиридина). Растворяют остаток в буфере с pH 2,2, фильтруют и определяют S-сульфоцистеин па аминокислотном анализаторе.
8.9.1.3. Определение дисульфидных связей. Описываемая ниже методика [365] более удобна, чем предыдущие, и позволяет проводить анализ с более высокой чувствительностью (10-8 моль дисульфида) и скоростью. Ошибка определения составляет ±3%.
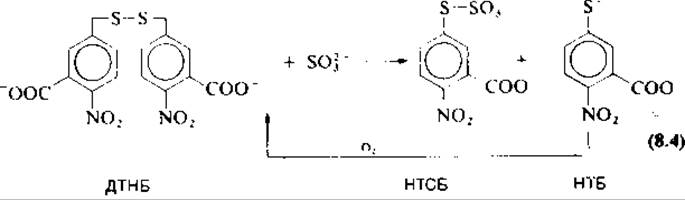
Дисульфидная связь расщепляется избытком сульфита натрия [уравнение (8.2)]. Образовавшиеся тиоловые группы вступают в реакцию с 2-нитро- 5-тиосульфобензойной кислотой (НТСБ) [уравнение (8.3)] и переводятся в сульфопроизводные; эквимолярное количество выделившейся 2-нитро-5-тиобензойной кислоты (МТБ) измеряется спектрофотометрически (ε412 нм = 13 600).
R—S—S—R+SО32- ⇄ R—S—SО3- + R'S- — (8.2)
![]()
Приготовление реагента. Исходный реагент НТСБ получают в виде 0,5 мМ раствора по уравнению (8.4). Растворяют 0,1 г (2,5∙10-4 моль) 5,5'-дитиобис(2-нитробензойной кислоты) (ДТНБ) (реагент Эллмана; фирма Aldrich) в 10,0 мл 1 М Na2SO3 (1∙10-2 моль) при 38 °С и доводят pH до 7,5. Продувают через раствор кислород, контролируя ход реакции по увеличению содержания НТБ измерением поглощения при 412 нм (концетрация НТБ достигает максимума — 99% — через ∼45 мин). Раствор НТСБ хранят при —20 °С, он стабилен в течение 6 месяцев; используется без очистки.
Раствор НТСБ для анализа. Исходный реагент НТСБ разбавляют в 100 раз раствором, содержащим 0,2 М трис (основание), свежеприготовленный 0,1 М Na2S2O3, 3 мМ ЭДТА и 2—З М гуанидинтиоцианата (фирма Eastman); доводят pH смеси до 9,5 с помощью НСl. Раствор стабилен в течение двух недель при комнатной температуре.
Анализ дисульфидов. К 3 мл раствора НТСБ для анализа добавляют по каплям из пипетки 0,01—0,20 мл раствора пептида или белка (с концентрацией S —S-связей 0,5—2 мМ). Смесь инкубируют в темноте в течение 5 мин (пептид) и 25 мин (белок). Измеряют поглощение при 412 им против холостого опыта (3 мл раствора НТСБ для анализа в соответствующем объеме воды).
Замечание. Гуанидин применяют для денатурации белка, приводящей к большей доступности дисульфидных связей. Мочевину нельзя использовать для этих целей, поскольку присутствующий в ней цианат аммония реагирует с тиольными группами. Последовательные операции по расщеплению дисульфидных связей и титрованию тиольных групп проводят в одном и том же реакционном сосуде, поэтому нет необходимости в удалении растворенного кислорода. Метод можно применять в пептидном картировании для селективной идентификации цистиновых и цистеиновых остатков с последующим их выделением. НТБ-анион претерпевает фотохимическое превращение, продукт которого уже не поглощает при 412 им [88], поэтому инкубирование должно проводиться в темноте.
Реагент Эллмана был предложен для прямого титрования свободных тиольных групп в белках [105]; позднее эта реакция была изучена более подробно [312].
8.9.1.4. Определение S-сульфиноаланина и цистеиновой кислоты методом ВЭЖХ [171]. S-Сульфиноаланин (сульфиновая кислота L-цистеина (Csa) и цистеиновая кислота (Суа) (как и О-фосфосерин) элюируются совместно в диапазоне нескольких минут на катионообменной колонке; однако они хорошо разделяются на сильноосновной анионообменной смоле (ISA-07/S2504. (фирма Schimadsu) при элюировании 0,05 М КН2РО4. Времена удерживания: Csa 22 мин, Суа 35 мин, Ser(P) 41 мин.
Для идентификации этих аминокислот можно использовать обработку (после их выхода с колонки) реагентом ОФА + меркаптоэтанол (разд. 8.16.3,1), для образующихся производных существует линейная зависимость площади пика флуоресценции от выхода: для Csa в интервале 20 пмоль — 5 нмоль и для Суа в интервале 10 пмоль — 5 нмоль.
8.9.1.5. Определение сульфгидрильных групп с n-хлоромеркурибензоатом. Органические ртутьсодержащие соединения, впервые предложенные в 1937 г [152J, до сих пор остаются наиболее специфичными и чувствительными реагентами па сульфгидрильные группы в интактных белках. Ниже описывается метод Бойера [37].
Реагент
п-Хлоромеркурибензоат. Для очистки реагент растворяют в 1 М NaOH и, если необходимо, центрифугируют. Добавляют 1 М НСl до выпадения осадка, повторяют переосаждение дважды. Осадок промывают 3 раза дистиллированной водой. Сушат в топком слое в вакууме над Р2О5. Растворяют в разбавленном ацетатном или фосфатном буфере (pH 7—8).
Методика. Раствор белка подкисляют до pH 4,6 и добавляют реагент (10-кратный молярный избыток на каждую SH-группу) в разбавленном нейтральном или слегка щелочном растворе при комнатной температуре. Строят график зависимости увеличения поглощения при 232 им от времени. Находят суммарное увеличение поглощения.
Замечание. Растворы n-хлоромеркурибензоата при храпении в течение нескольких дней частично разлагаются. Контролируют растворы (если необходимо после центрифугирования) путем измерения поглощения при 232 им, pH 7 (εМ = 1,69∙104) или 234 нм, pH 4,6 (εМ = 1,74∙104). В присутствии ЭДТА получают завышенные результаты.
8.9.1.6. Определение метионина и метионинсульфоксида. В процессе расщепления периодатом углеводной цепи в гликопротеинах [69, 95] и дисульфидных связей в белках, а также окисления остатков цистеина надмуравьиной кислотой [162] метионин превращается в метионинсульфоксид [411] и метионинсульфон. Образование метионинсульфооксида происходит в значительной степени даже при использовании низкой концетрации (5 ммоль/л) перйодата; при кислотном гидролизе из пего вновь образуется метионин, метилсульфонневая соль метионина, гомоцистеин и гомоцистеиновая кислота [112]. Метионинсульфон стабилен в условиях кислотного гидролиза и может быть количественно определен па аминокислотном анализаторе [116, 251]. Для анализа метионинсульфоксида используют щелочной гидролиз или его количество находят непрямым путем — в виде метионинсульфона [275].