Практическая химия белка - А. Дарбре 1989
Методы твердофазного анализа аминокислотной последовательности
Отщепление на твердофазном секвенаторе
Перегруппировка анилинотиазолинона в ФТГ
12.5.7.1. Условия проведения процесса. Отщепленные анилинотиазолиновый (АТЗ) превращают в ФТГ аминокислот в водных растворах кислотою в безводном растворе хлороводорода. Используют следующие среды и условия превращения:
1) 1 М соляная кислота, 10—15 мин, 80 °С [14];
2) 20%-ная ТФУ, 10 мин, 80 °С [27];
3) 20%-ная ТФУ, 20—30 мин, 55 °С [72];
4) 30—40%-ная ТФУ, 45—65 мин, 49—50°С [52];
Таблица 12.2. Модификация секвенатора (модель 4020, фирма LKB) для работы по методике ДАБИТЦ — ФИТЦ
Твердофазный стандартный секвенатор (модель 4020) модифицирован для работы на микроуровне [52]. Программа работы прибора показана на рис. 12.5. Модификация включала следующие изменения конструкции прибора:
1) введена линия продувки азотом (см. рис. 12.6) для высушивания колонки прибора на стадиях карбамоилирования, отщепления, промывки растворителями;
2) стандартная колонка фирмы LKB заменена тефлоновой микроколонкой (см. рис. 12.4), погруженной в стеклянный термостат, прогретый до 50 °С;
3) колонка № 2 используется в качестве конвертора (30%-ная ТФУ, 65 мин, 50 °С; превращение в автоматическом режиме). Вместо стандартной колонки применяется тефлоновая спираль (1,5X400 мм), в которую с колонки № 1 поступает раствор тиазолинона в ТФУ. Одновременно в ту же линию подается вода, смешивающаяся с раствором тиазолинона [4];
4) все соединительные линии уменьшены в диаметре и укорочены по мере возможности.
5) 1 М хлороводород в метаноле (полученный добавлением 1—2 М хлороацетила к метанолу при охлаждении на льду), 5—10 мин при 55°С [23, 58].
6) 2,4 М метиламин в изопропаноле (или газообразный метиламин) предложены для превращения в метиламиды фенилтиокарбамоиламинокислоты [1].
Оптимальные условия количественного превращения тиазолинонов отдельных аминокислот в ФТГ сильно отличаются друг от друга, Gly и Lys превращаются с наименьшими скоростями, тогда как Ser и Thr не только быстро переходят в ФТГ этих же аминокислот, но и претерпевают частичную деструкцию. Поэтому в общем случае методика реакции превращения АТЗ в ФТГ должна компромиссно учитывать эти крайние условия с присущими им недостатками. При анализе дорогостоящих пептидов желательна специальная обработка отщепленных производных в каждом цикле. Превращение в соляной кислоте предпочтительнее обработки ТФУ в случае Ser и Thr. При работе с ФТГ-производными Gln и Asn лучше использовать водную ТФУ, так как в этом случае возможно быстрое упаривание разбавленного раствора после завершения реакции, что уменьшает до минимума дезамидирования ФТГ этих аминокислот. В то же время применение разбавленной соляной кислоты ведет к почти полному дезамидированию Gln и Asn, что не позволяет надежно определять присутствие амидов.
Проведение реакции в безводном хлороводороде имеет некоторые преимущества перед водными средами (более мягкие условия, большая летучесть реагента). Недостаток методики связан с тем, что могут этерифицироваться боковые цепи Asp и Glu. При неполной этерификации после проведения конверсии в реакционной среде присутствуют два вида производных (ФТГ-Asp и ФТГ-СН3О-Asp). Аналогичная картина наблюдается в случае ФТГ-производного Glu. Полнота протекания реакции зависит от устойчивости раствора хлороводорода в метаноле, которая низка при высоких температурах; поэтому всегда следует использовать свежеприготовленные растворы.
12.5.7.2. Ручная конверсия. В твердофазных секвенаторах отщепленные тиазолиноны аминокислот элюируются в пробирки коллектора фракций в растворе, содержащем 1,5 мл ТФУ и 3 мл метанола. При ручном превращении АТЗ хранят в этой смеси в течение ночи при комнатной температуре. Однако АТЗ чувствительны к кислороду, поэтому происходит частичное разрушение производных некоторых аминокислот (например, Ser, Thr, Arg, His). Кроме того, если после обработки ТФУ колонка промывается метанолом, то Asp и Glu частично превращаются в соответствующие метиловые эфиры. Для предотвращения этого рекомендуется после проведения реакции колонку промывать сначала 1,2-дихлороэтаном или ДМФА. Для увеличения выхода ФТГ-производных Ser и Thr раствор АТЗ разбавляют водой, как указано ниже.
Перед началом анализа в каждую пробирку коллектора фракций наливают 3—7 мл воды, на следующий день содержимое пробирок упаривают на роторном испарителе или на вакуумном концентраторе и проводят конверсию.
Методика превращения. В потоке азота добавляют 0,3 мл 20%-ной водной ТФУ, выдерживают 30 мин при 55 °С. Упаривают раствор в вакууме. Для удаления летучих побочных продуктов остаток выдерживают в вакууме (масляный насос, до 5 ч). Растворяют содержимое пробирки в метаноле и идентифицируют ФТГ-производные аминокислоты методами ГЖХ, ТСХ, ВЭЖХ. Для упрощения методики предложено использовать обогреваемый эксикатор как для упаривания растворителей, так и для проведения конверсии.
12.5.7.3. Автоматическая конверсия. Описаны устройства, позволяющие проводить в атмосфере азота быстрое превращение АТЗ неустойчивых аминокислот в их относительно устойчивые ФТГ-производные. При этом налицо следующие преимущества: меньшая степень разрушения ФТГ, т. е. незначительное содержание побочных продуктов, меньшее (в зависимости от использованной среды) деамидирование Asn и Gln, повышение выходов ФТГ-Ser и ФТГ-Thr, сокращение времени процесса. Первый конвертор был выполнен в виде термостатированного при 55 °С стеклянного сосуда (колбы) с двойными стенками; кислый раствор упаривался в токе азота [66, 75]. Описан конвертор в виде реактора с рубашкой [7]. В другом устройстве используется реакционная спираль, через которую проходит поток раствора с секвенатора; в поток добавляется необходимое количество воды; конверсия проводится при 80 °С [4]. В этом случае образующиеся ФТГ-производные аминокислот хранят в кислом растворе. Коммерчески доступен автоматический конвертор, схожий с конвертором-колбой (Sequemat P-6 Auto Convertor; подробное описание см, в работе [23]). Этот конвертор можно присоединить и к жидкофазному, и к твердофазному секвенатору, причем сообщалось, что при его использовании количественно образуются метиловые эфиры Asp и Glu кислот, отсутствуют свободные кислоты, не наблюдается деамидирования Asn и Gln. Однако при использовании обычного коммерческого конвертора в указанных условиях превращения образуется неединственное производное и затруднен количественный анализ. Недавно стал доступен недорогой и несложный вариант модификации секвенатора фирмы LKB (в качестве конвертора служит вторая колонка прибора [52]). В общем случае конверсия проводится по методике, описанной в работе [4], с использованием 30%-ной водной ТФУ при 50 °С продолжается — 60 мин по программе, разработанной для микроанализа с ДАБИТЦ—ФИТЦ (рис. 12.6 и табл. 12.2).
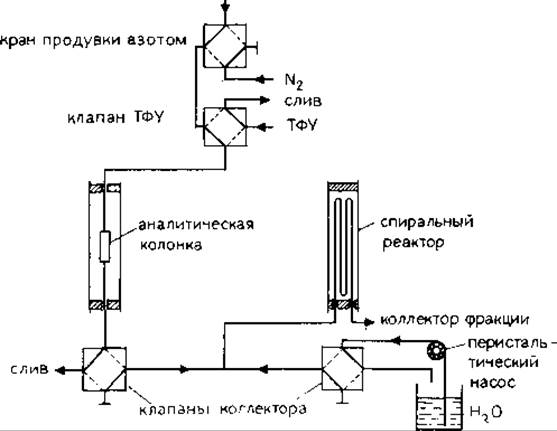
РИС. 12.6. Схема модифицированного секвенатора для твердофазного анализа фирмы LKB (модель 4020), имеющего продувку колонки азотом и автоматический конвертор [52].
12.5.7.4. Идентификация с использованием ВЭЖХ в режиме прямой стыковки секвенатора с хроматографом (*on line»). В идеале автоматический анализ аминокислотной последовательности полипептидов требует и автоматического превращения АТЗ; это обстоятельство становится необходимым предварительным условием анализа исчезающе малых количеств пептидов. Разработки ближайшего времени будут включать в себя автоматическую регистрацию результатов определения путем идентификации отщепленных ФТГ-производных аминокислот в режиме непрерывной работы с секвенатором, например при помощи ВЭЖХ. Первый вариант такой непрерывной системы («on line») был предложен применительно к твердофазному секвенатору [38, 39]. Эта система была разработана для секвенатора, в который отщепленные ФТГ-производные растворены в смеси органического растворителя, ТФУ, воды. Сначала удаляли кислоту, затем образец дозировали в колонку жидкостного хроматографа.
При использовании конверторов (например, конвертор Wittmann-Liebold [75]), обеспечивающих удаление кислоты, монтаж системы автоматической идентификации методом ВЭЖХ прост: проба раствора, содержащего тиогидантоин, при помощи автоматического клапана дозируется на колонку ВЭЖХ [69]. Использовали изократическую хроматографию тиогидантоинов на колонке RP8 (диаметр зерна сорбента 3 мкм, размер колонки 4x250 мм) при 61 °С. Элюирование проводилось в системе: 19,5%-ный изопропанол +1 %-ный ТГФ+1,5% 10 мМ ацетата натрия (pH 5,3) в режиме рецикла. На колонку дозировалось 25—50% объема образца [70]. Остаток образца высушивался в коллекторе фракций и использовался для дополнительной идентификации в градиентной системе ВЭЖХ. Изократическое элюирование в системе «on line» проще, чем градиентное. Оно позволяет контролировать ход отщепления и состояние прибора. При этом достигается полное разделение всех производных аминокислот. Наш опыт показывает, что при автоматической идентификации в режиме «on line» хранение части полученных ФТГ-производных аминокислот необходимо как мера предосторожности на случай поломки хроматографа или для последующей идентификации модифицированных аминокислот.