Практическая химия белка - А. Дарбре 1989
Определение С-концевой последовательности аминокислот
Выделение и идентификация С-концевых пептидов
Двумерное пептидное картирование
До настоящего времени предложено несколько методов пептидного картирования. С-концевой пептид у-цепи фетального гемоглобина идентифицировали, сравнивая электрофореграммы триптических гидролизатов после повторного разделения (pH 6,5) в направлении, перпендикулярном первому, до и после удаления С-концевых остатков Arg или Lys при помощи карбоксипептидазы В прямо на листе бумаги [63]. Теоретически после обработки карбоксипептидазой на диагонали должен быть только С-концевой пептид. Однако в случае 7-цепи гемоглобина человека на диагонали оказались 3 пятна, а именно свободный Lys, дипептид Val-Lys (так как дипептиды очень медленно расщепляются карбоксипептидазой [46]) и ожидаемый С-концевой пептид Tyr-His. Этот метод удобен для белков, у которых С-концевой аминокислотой является любой остаток, кроме Arg и Lys, а также для тех белков, триптические пептиды которых легко расщепляются карбоксипептидазой В.
Для обнаружения С-концевой области А-белка бактериальной триптофансинтетазы сравнивали карты трипсинолиза белка до и после обработки его смесью карбоксипептидаз А и В [15]. C-Концевая последовательность этого белка имеет состав А1а- Ala-Thr-Arg-Ser, и при частичном триптическом гидролизе на пептидной карте обнаруживаются три пятна, соответствующие Ala-Ala-Thr-Arg-Ser, Ala-Ala-Thr-Arg и свободному Ser. После обработки карбоксипептидазами исчезает только пятно Ala-Ala-Thr-Arg, потому что второй пептид и свободный Ser мигрируют на хроматограмме, сливаясь с другими пятнами. Успешное использование этого метода сильно зависит от полноты разделения пептидов на хроматограмме. Чем крупнее молекула белка, тем больше вероятность того, что будет потерян С-концевой пептид.
Из всех использованных методов пептидного картирования наиболее элегантным является метод диагонального электрофореза (ЭФ), основанный на отсутствии свободной карбоксильной группы в амидированных белках. Перед ферментативным расщеплением амидируют карбоксильные группы боковых цепей и С-концевой аминокислоты. После гидролиза С-концевой фрагмент оказывается единственным, не имеющим свободного карбоксила. Его можно селективно идентифицировать, так как его ионный заряд, а следовательно, и электрофоретическая подвижность почти одинаковы при изменении pH в любую сторону от pH 3,5 (рК а-карбоксилыюй группы). Подвижности пептидов, содержащих свободную карбоксильную группу, увеличатся при подкислении раствора (рН<3,5). После двумерного ЭФ на диагонали электрофореграммы обнаруживается только С-концевой пептид.
В оригинальной методике [27] белок амидировали метиламином при помощи n-толуолсульфоната N-циклогексил-N'-2~ (4-β-морфолинил)этилкарбодиимида; проводили ферментативное расщепление, гидролизат подвергали высоковольтному ЭФ при pH 6,5 в первом направлении и pH 1,8 — во .втором. При этих условиях не обнаруживаются С-концевые пептиды, содержащие His, так как они сходят с диагонали. В модифицированной методике эта проблема снимается проведением ЭФ в первом направлении при pH 4,4; поэтому при проведении разделения в перпендикулярном направлении при pH 1,8 карбоксильные группы оказываются единственными, изменившими свой заряд [22]. Для амидирования белка использовали эта- ноламин, так как он легко растворим в воде, улучшает растворимость модифицированного белка и получаемых пептидов; он отсутствует в обычных белках и поддается количественному определению на аминокислотном анализаторе. В работе [22] при определении точного положения веществ, располагающихся на диагонали независимо от небольших изменений абсолютной подвижности или влияний электроосмоса, использовали в качестве маркеров амид Ala или таурин.
18.2.3.1. Выделение С-концевых пептидов. Ниже приведена методика выделения карбоксилсодержащих концевых пептидов а- и ß-цепей гемоглобина человека [22]. Количество белка, необходимое для анализа, зависит от чувствительности метода обнаружения.
Амидирование. Белок (1,6 мкмоль, 50 мг) растворяют в 3 мл воды, содержащей несколько капель соляной кислоты. Добавляют 2,6 г мочевины, перемешивают 30 мин. Добавляют 0,3 г хлорида калия и 0,2 мл этаноламина, pH немедленно доводят до 4,75 при помощи соляной кислоты. Прибавляют 125 мг ЭДК, поддерживают pH 4,75. Перемешивают при комнатной температуре 4—6 ч, затем добавляют 1 мл 4 М ацетата натрия (pH 4,75). Раствор диализуют, несколько раз меняя воду.
По другой методике амидирование можно проводить в насыщенном растворе солянокислого гуанидина (1 мл), содержащем этаноламин (20 мкл, 300 мкмоль), при pH 4,7 (с помощью микрошприца добавляют 1 М соляную кислоту) [21]. При перемешивании добавляют карбодиимид (ЭДК, 15 мг, 80 мкмоль), поддерживают pH 4,7 в течение 6 ч.
Ферментативное расщепление. Термолитическое расщепление проводят в 1%-ном водном бикарбонате аммония при 37 °С в течение 8 ч при соотношении фермент : субстрат = 1 : 35 (по массе). Для прерывания расщепления реакционную смесь лиофилизуют.
Выделение пептидов путем электрофореза. Смесь пептидов растворяют в буфере пиридин — уксусная кислота — вода (6:10:1200, pH 4,4), наносят полосой в 330 мм на хроматографическую бумагу ватман 3 ММ вместе с маркерами (амид Ala и таурин, 5 нмоль/мм) и подвергают электрофорезу при pH 4,4 в течение 60 мин при напряжении 6 В/мм; бумагу высушивают. Для проведения аналитического опыта вырезают полосу, содержащую пептиды, пришивают ее к целому листу бумаги ватман 3 ММ и проводят ЭФ при pH 2,1 (муравьиная кислота — уксусная кислота — вода, 1:4:45) в течение 40 мин при 6 В/мм. Элeктрофореграмму окрашивают Cd-нингидриновым раствором (разд. 8.14.2). На элeктрофореграмме, приведенной на рис. 18.2, видно, что на диагонали, ограниченной маркерами, находятся два пептида. (В препаративном опыте после проведения ЭФ при pH 4,4 можно вырезать область на диагонали, содержащую два пептида, и привести ЭФ при pH 2,1.) Пептиды, движущиеся медленнее других и соответствующие двум «диагональным» пептидам, вырезают и при необходимости дополнительно очищают ЭФ при pH 2,1 или 6,5.
Эту методику недавно использовали для определения положения расщепления молекулы гемагглютинина вируса гриппа протеолитическим ферментом бромелаином при ферментативном отщеплении белка от поверхности вируса [21].
Предполагается, что этот метод должен стать широко распространенным [22]. Все пептиды, полученные из С-концевой области белка, располагаются на диагонали независимо от их аминокислотной последовательности. При гидролизе можно использовать любой фермент при условии, что в гидролизате окажутся пептиды достаточной длины, а определение последовательности выделенного пептида можно проводить с помощью известных (стандартных) методов.
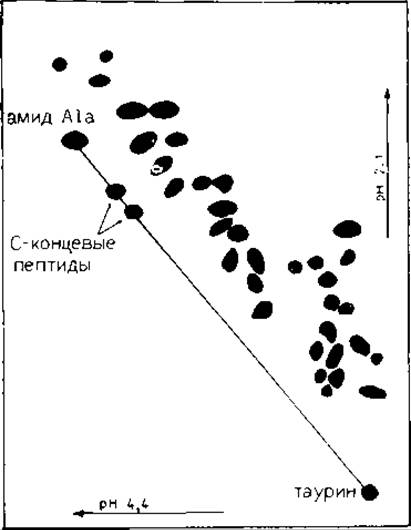
РИС. 18.2. Избирательное выделение С-концевых пептидов термолитическою гидролизата а- и ß-цепей гемоглобина человека. Гидролизат разделяли электрофорезом при pH 4,4 в первом направлении и при pH 2,1 — во втором [21].
Наличие этаноламина на карбоксильном конце выделенного пептида гарантирует принадлежность этого пептида карбоксильному концу белка. Возможные невысокие выходы присоединения этаноламина к белку не являются серьезным ограничением метода, так как любой неамидированный пептид после ЭФ оказывается смещенным с диагонали и поэтому не мешает определению искомого фрагмента. Наконец, метод должен оказаться применимым к белкам, имеющим природную амидированную С-концевую аминокислоту, так как подобные белки содержат блокирующую группу того же типа, что и при искусственном амидировании.