Практическая химия белка - А. Дарбре 1989
Применение масс-спектрометрии электронного удара для определения аминокислотной последовательности пептидов и белков
Интерпретация масс-спектров
Пути фрагментации пептидов
1. Фрагментация перметилированных ацетил пептидов при электронном ударе обусловлена в основном разрывом амидных связей, т. е. связей С—N (рис. 19.3). Образующиеся в результате разрыва этих связей ионы как раз и характеризуют аминокислотную последовательность пептида. Разность масс таких ионов отвечает величинам, характеризующим массы аминокислотных остатков. Сначала находят в масс-спектре ион, характеризующий остаток N-концевой аминокислоты, массовое число m/z которого обычно лежит в интервале 114—257, а затем прибавляют к этому массовому числу массовые числа аминокислотных остатков, которые могут входить в состав пептида, и находят в спектре ионы больших массовых чисел, которые определяют аминокислотную последовательность исследуемого образца. В качестве примера рассмотрим пептид A-B-C-D, где А, В, С и D — остатки модифицированных аминокислот. При электронном ударе этот пептид образует ионы А+, AB+, АВС+ и ABCD+. Возможные массовые числа N-концевых ионов, которые обычно образуются при фрагментации пептидов, приведены в табл. 19.1. Следует помнить, что при масс-спектрометрическом определении первичной структуры пептидов не удается различать между собой остатки лейцина и изолейцина.
Таблица 19.1. Массы N-концевых ионов и их аминокислотных остатков в пептидной цепи в масс-спектрах электронного удара ацетилированных перметилпептидов
|
Аминокислота |
Масса N-концевого иона |
Масса аминокислотного остатка |
Аминокислота |
Масса N-концевого иона |
Масса аминокислотного остатка |
|
Gly Ala Pro Val Ser Leu Thr Cys Asp |
114 128 140 156 158 170 172 174 186 |
71 85 97 113 115 127 129 131 143 |
Met Asn Glu Phe His Gln Orn Tyr Lys Trp |
188 199 200 204 208 213 227 234 241 257 |
145 156 157 161 165 170 184 191 198 214 |
2. Остатки аминокислот, боковая цепь которых в общем виде может быть представлена как СН2Х, где заместитель X может содержать сопряженные связи, склонны к разрыву связей С—N, сопровождающемуся миграцией атома водорода (рис. 19.4). Такой распад характерен для пептидов, построенных из остатков аспарагиновой кислоты, аспарагина, фенилаланина, гистидина, тирозина и триптофана. Заметим, что при такой фрагментации образуются новые пептиды, аминокислотная последовательность которых начинается с остатка той кислоты, которая подверглась разрыву связей С—N, и пики ионов, характеризующих их аминокислотную последовательность, будут присутствовать в масс-спектре. Массы N-концевых ионов пептидов, образующихся в результате разрыва связей С—N, приведены в табл. 19.2.
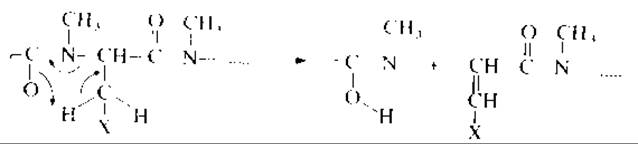
РИС. 19.4. N—C-Разрыв пептидных связей в перметилироваyных пептидах с перегруппировкой атомов водорода.
Таблица 19.2. Массы N-концевых ионов, образующихся в результате разрыва связей С—N
|
Ион |
Масса |
Ион |
Масса |
|
...Asp |
113 |
...His |
135 |
|
...Asn |
126 |
...Туr |
161 |
|
...Phe |
131 |
...Тrр |
184 |
3. Остатки глутаминовой кислоты и глутамина, независимо от положения в цепи, обычно частично циклизуются, образуя ионы N-концевой пирролидонкарбоновой кислоты. Такая циклизация приводит к появлению в спектре иона 1 с m/z 98, а соответствующий ему N-концевой ион 2 с m/z 126 характеризуется пиком малой интенсивности или вовсе отсутствует.

4. Распад боковых цепей некоторых аминокислотных остатков часто облегчает интерпретацию масс-спектров пептидов. Таковы, например, остатки серина и треонина, боковые цепи которых склонны к элиминированию молекул метанола. Кроме того, для остатка треонина характерен отрыв всей боковой цепи в результате разрыва С—С-связи с миграцией Н или без таковой. Аналогично ведет себя метионин, остаток которого теряет молекулу CH3SH (М 48) и/илн всю боковую цепь.