Практическая химия белка - А. Дарбре 1989
Рентгеновская кристаллография и электронная микроскопия
Дифракция рентгеновских лучей
Кристаллография белков
Любое кристаллографическое исследование в конечном итоге имеет целью получить экспериментальные данные о распределении электронной плотности р (x,y,z), которую можно выразить с помощью функции Фурье:
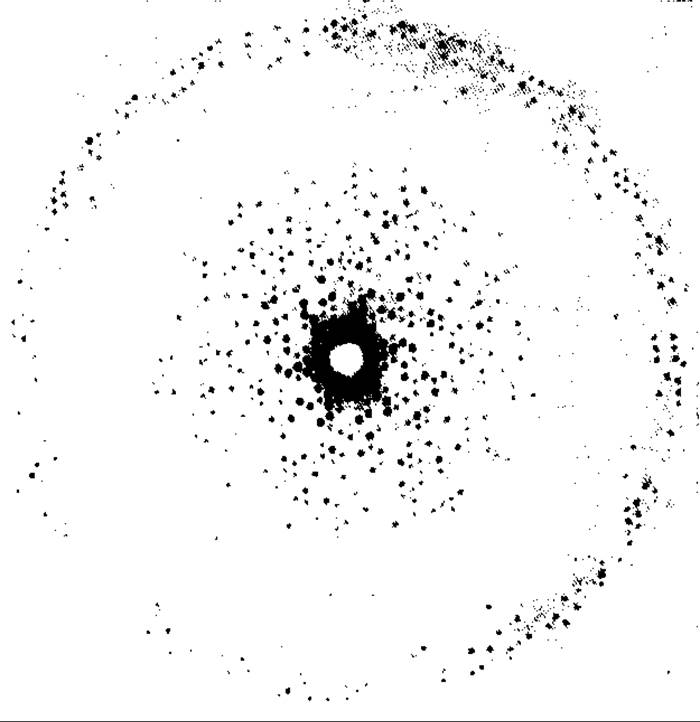
РИС. 20.4. Дифракционная картина, полученная с помощью прецессионной камеры, от кристалла С-фикоцианина (имеется информация об амплитудах, но не фазах дифракционных максимумов).
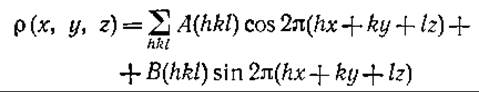
Коэффициенты А и В связаны с интенсивностями F2(hkl) дифракционных пиков и их фазами φ:
A(hkl) = F2(hkl) ∙ cos φ
B(hkl) = F2(hkl) ∙ sin φ
Основное отличие белковой кристаллографии от кристаллографии малых молекул состоит в методах определения фаз. В случае малых молекул информация о фазах может быть получена на основе статистического анализа данных по интенсивностям дифракционных пиков, полученных от кристалла. При изучении белков необходимо измерить интенсивности дифракционных пиков белкового кристалла, а также двух или большего числа кристаллов производных этого белка. Такие производные получают путем присоединения к белку атомов тяжелых металлов до или после кристаллизации. Кристалл производного должен отличаться от исходного кристалла только наличием тяжелых атомов, тогда как сам белок должен находиться в той же конформации, ориентации и упаковке, как и в нативном кристалле. В этом случае производное называют изоморфным.
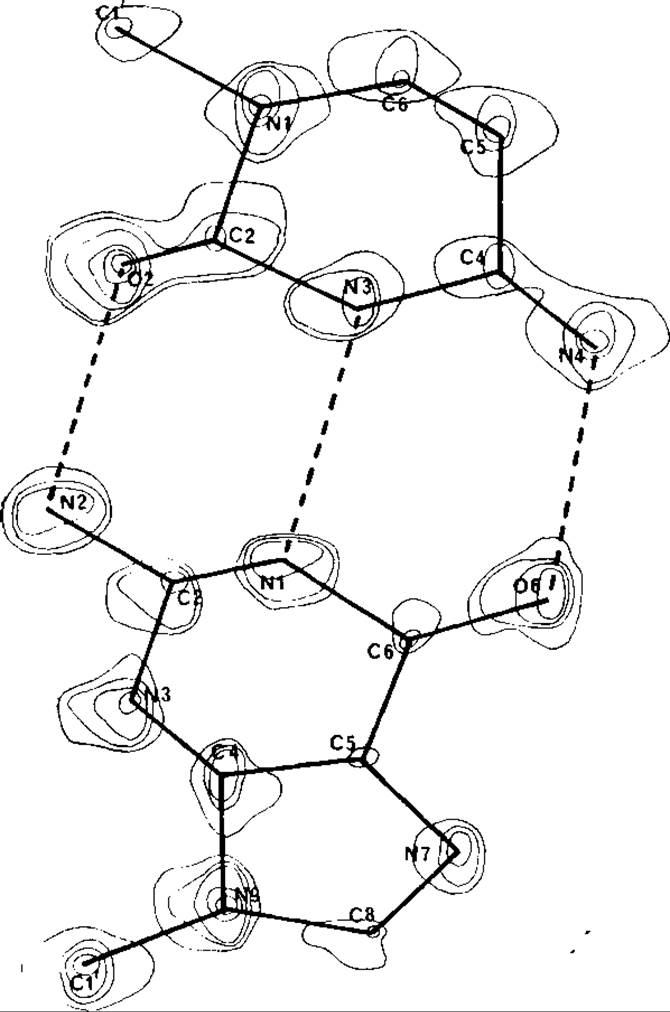
РИС. 20.5. Карта электронной плотности с наложенной на нее схемой структуры небольшой молекулы. Атомы на карте видны как дискретные максимумы электронной плотности.

РИС. 20.6. Участок карты электронной плотности преальбумина. Отчетливо виден участок полипептидной цепи, образующий плоский ß-лист, тогда как отдельные атомы не разрешаются.
Если получены нативный кристалл и подходящее число его изоморфных производных, то следующим этапом исследования является сбор данных об интенсивностях дифракционных пиков для всех этих кристаллов. Собранная информация об интенсивностях может быть обработана таким образом, чтобы определить положение тяжелых атомов в кристаллах производных. А это в свою очередь позволяет определить фазы для всех рефлексов нативного кристалла [1].
20.1.4.1. Стадии структурного анализа. Процесс определения структуры белка можно разделить на несколько стадий (рис. 20.8); на некоторых из них могут встретиться серьезные затруднения, и тогда надо вернуться вновь к более ранним этапам работы (в соответствии с тем, как показано на рисунке стрелками). На рисунке не отражен также этап работы, связанный с выделением и очисткой белка, где главная роль отводится специалисту-биохимику.
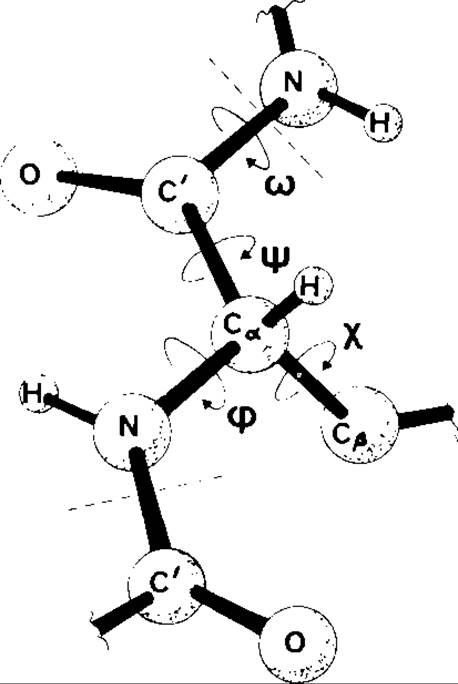
РИС. 207. Объемная схема участка полипептидного остова молекулы в виде цепи с фиксированной конформацией, которая была получена вращением отдельных звеньев вокруг химических связей фиксированной длины.
20.1.4.2. Получение кристаллов. Для получения рентгеновской дифракционной картины необходимы кристаллы, минимальный размер которых составляет несколько десятых долей миллиметра, т. е. значительно более крупные, чем образующиеся обычно при кристаллизации. Однако предварительная информация о том, что белок может быть получен в микрокристаллическом состоянии, чрезвычайно полезна для поиска условий и метода выращивания крупных кристаллов, пригодных для структурного исследования. Известно несколько методик выращивания кристаллов, но ни одна из них не универсальна. Поэтому, если исходный материал имеется в достаточном количестве, целесообразно поставить несколько параллельных экспериментов, используя различные методики. При этом приходится подбирать условия, а с учетом того, что кристаллизация белков — это медленный процесс, получение кристаллов белков очень кропотливое дело, требующее от экспериментатора огромного терпения. Все существующие методики кристаллизации основаны на получении пересыщенных растворов белка и образовании в них зародышей кристаллов. Например, для получения пересыщенного белкового раствора можно добавлять насыщенный раствор сульфата аммония (высаливание). В противоположность этому простому способу можно использовать так называемое градиентное пересыщение раствора, которое обусловлено изменением температуры раствора, диффузией соли через диализную мембрану или испарением воды (диффузия через газовую фазу). Кроме того, переход раствора в пересыщенное состояние может происходить и при добавлении к раствору белка органических растворителей, например при их диффузии через газовую фазу в результате испарения [1, 9, 10]. Качество получаемых кристаллов обычно улучшается, если белок тщательно очищен от примесей, например путем изоэлектрического фокусирования [2].
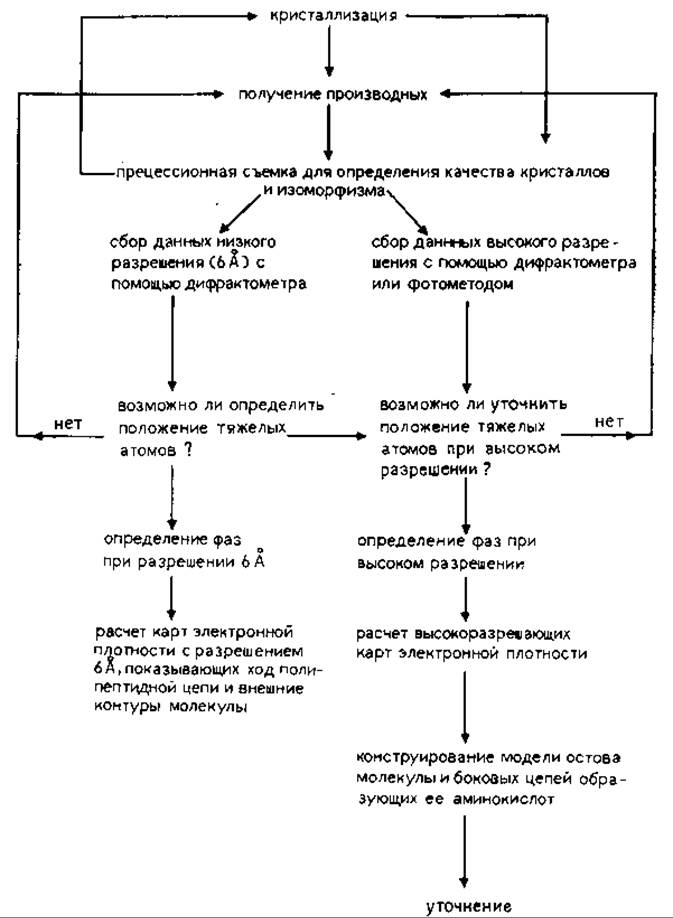
РИС. 20.8. Кристаллографическое исследование белков. Указаны и те этапы исследования, на которых необходимо тщательно проанализировать полученные результаты, прежде чем продолжить работу.
Выбор конкретной методики получения кристаллов часто зависит от того, какое количество белка имеется в распоряжении экспериментатора. Для белков, хорошо растворимых в воде, обычно используют растворы с концентрацией ~20 мг/мл. При кристаллизации в каплях объем одной пробы составляет ~10 мкл. При использовании микродиализа или микрообъемного метода работают с такими же порциями раствора. Поэтому 1 мл раствора (или 200 мг белка) может хватить па ~100 проб. При бережном обращении с белковым раствором и хорошем выходе кристаллов 20 мг белка может оказаться достаточным для обеспечения всего структурного исследования кристаллами или по крайней мере для выяснения возможностей дальнейшей работы.
Получение кристаллов достаточно большого размера еще не гарантирует, что структурное исследование будет успешным. Во-первых, необходимо убедиться с помощью рентгеновской съемки, например с использованием прецессионной камеры, что кристаллы в достаточной степени совершенны и, следовательно, дифракционные данные могут быть собраны вплоть до высокого разрешения. Во-вторых, кристаллы должны быть подходящего типа, так как слишком сложная (или слишком простая) упаковка молекул в элементарной ячейке может сделать выяснение структуры невозможным. В-третьих, кристаллы должны быть устойчивы к действию рентгеновского излучения, так чтобы с одного кристалла можно было получить несколько снимков высокого разрешения. В-четвертых, методика получения кристаллов должна хорошо воспроизводиться, чтобы полное структурное исследование было обеспечено идентичными кристаллами, поскольку полный набор дифракционных данных обычно не удается получить с одного кристалла.
20.1.4.3. Получение тяжелоатомных производных. Вообще говоря нельзя исключить, что введение в растворе в белковую молекулу тяжелого атома не повлияет на ее кристаллическую структуру и модифицированный белок будет кристаллизоваться так же, как и нативный. Однако в большинстве случаев производные, содержащие тяжелые атомы, получают при выдерживании кристаллов белка в растворах солей подходящих металлов. Это вызвано тем, что для структурного исследования необходимо, чтобы кристаллы нативного и модифицированного белка имели абсолютно одинаковую молекулярную упаковку и отличались только наличием нескольких атомов тяжелого металла в расчете на одну белковую молекулу. Поэтому целесообразно попытаться модифицировать белковые молекулы, исходно упакованные требуемым образом. Не исключено, однако, что молекулы в кристалле будут упакованы так, что соответствующие центры связывания окажутся недоступными.
Трудности в получении производных вызваны невозможностью надежного предсказания свойств белковых молекул. Поэтому приходится применять метод проб и ошибок. В случае металлсодержащих белков (металлопротеинов) (т. е. для весьма ограниченных случаев) атомы металлов могут быть замещены на другие атомы, что делает возможным получение целого ряда производных. Кроме того, к специфическому присоединению тяжелых атомов может привести химическая модификация белка, а также добавление кофакторов или ингибиторов. Однако, как правило, места присоединения тяжелых атомов удается выяснить только после расшифровки структуры; связывание этих тяжелых атомов определяется особенностями трехмерной организации боковых цепей аминокислот в кристалле. Поскольку пространственная организация экспонированных боковых цепей может зависеть от pH и ионной силы, то именно эти параметры и являются переменными при поиске условий получения производных. Особое внимание следует уделять оптимизации условий получения производных так, чтобы они приводили к воспроизводимым продуктам, а число металлических атомов, присоединившихся к каждой молекуле, было невелико. Возможно также, что выдерживание кристаллов в течение разного времени и/или в растворах с разной концентрацией одной и той же соли тяжелого металла будет иметь своим результатом два продукта с различным содержанием тяжелого атома (в одном производном этот атом присоединен по одному положению, а другом — по двум).
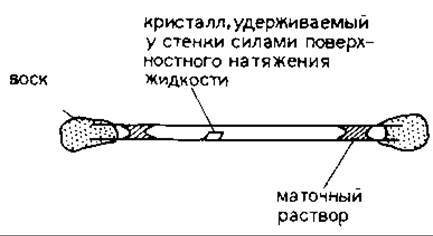
РИС. 20.9. Размещение белкового кристалла и капель маточного раствора в тонкостенном капилляре для рентгеновской съемки.
Число положений, по которым произошло замещение, определяется в ходе кристаллографического исследования; этот параметр характеризует вероятность присутствия тяжелого металла в любой из молекул, образующих кристалл. Важно, чтобы условия получения производных воспроизводимо обеспечивали возможность получения кристаллов с высокой степенью заполнения мест связывания [1, 9].
20.1.4.4. Подготовка рентгеновской съемки кристаллов нативного белка или его производных. Закрепление кристаллов в капиллярах. После того как кристаллы и их производные получены, необходимо исследовать их с помощью рентгеновской дифракции, чтобы определить пригодность для дальнейшей работы. Существуют два первичных критерия: разрешение и изоморфизм. Для того чтобы можно было провести рентгеновские съемки, кристалл должен быть помещен в тонкостенный капилляр (рис. 20.9). С помощью тонкой пастеровской пипетки кристалл вместе с каплей маточного раствора переносят из кристаллизационной ячейки в капилляр. Для предотвращения изменения ионной силы во время съемки (например, в результате высыхания) в один из концов капилляра помещают дополнительную каплю маточного раствора и открытый конец капилляра герметично заклеивают зубным воском. Для удаления избытка жидкости вблизи кристалла пользуются тонкими полосками фильтровальной бумаги. Удаление избытка жидкости снижает фоновое рассеивание рентгеновских лучей, и кристалл лучше удерживается в неком фиксированном положении силами поверхностного натяжения следовых количеств жидкости вокруг него. В оставшийся открытым конец капилляра вводят еще одну каплю маточного раствора и закрывают его воском (рис. 20.9). Обычно начинают с того, что концы тонкостенного капилляра (длиной 30—40 мм) заранее покрывают воском так, чтобы после внесения кристалла и маточного раствора его можно было закупорить быстро и герметично.
20.1.4.5. Проверка качества кристаллов. Первоначальное тестирование кристаллов проводят с помощью съемки в прецессионной камере; в результате получают дифракционную картину, подобную той, которая представлена на рис. 20.4. Такая съемка дает общую характеристику качества кристалла. Дифракционная картина должна состоять из дискретных пятен, расположенных в узлах регулярной решетки, которая в удачных случаях достигает края изображения на фотопластинке. Разрешение определяется тем, как далеко от центра фотопластинки еще наблюдаются дифракционные пятна. Необходимо однако учитывать особенности геометрии прецессионной камеры. Так, например, при выборе слишком большого угла прецессии, позволяющего получать рефлексы до разрешения 0,1 нм, может оказаться, что реальное разрешение на снимках не превышает 0,6 нм. В то же время не исключено, что уменьшение угла прецессии до величины, ограничивающей разрешение, скажем до 0,3 нм, может привести к появлению на снимках рефлексов, соответствующих этому разрешению.
Другое важное свойство кристалла, которое требуется проверить, — его радиационная устойчивость. Для этого проводят серию дифракционных снимков в стандартных условиях через определенные промежутки времени. О радиационном повреждении кристалла судят по ухудшению разрешения. Кристаллы, пригодные для работы, должны выдерживать по крайней мере одну дневную экспозицию в рентгеновском пучке без каких- либо видимых изменений на прецессионном снимке.
Об изоморфизме производных говорят при сохранении постоянства параметров кристаллической решетки, которые рассчитываются с помощью параметров обратной решетки, отображенной на снимках. При наложении таких снимков с нативного и производного кристаллов дифракционные пятна должны совмещаться. Информация о расположении тяжелых атомов в элементарной ячейке и соответственно фазах дифракционных максимумов содержится в изменениях их интенсивностей. Эти изменения должны быть заметными, но не слишком большими, так как в этом случае они могут быть обусловлены конформационными изменениями белковых молекул. Если же изменения в интенсивностях пятен не выявляются, следует использовать другое производное. Для определения положения тяжелых атомов применяются специальные методы белковой кристаллографии. Однако решить эту задачу удается не всегда, так как при связывании металлов из-за конформационных или ориентационных изменений молекул может нарушаться изоморфизм. Другой причиной может быть множественность присоединения тяжелых атомов, что приводит к невозможности расшифровать дифракционные картины.
20.1.4.6. Некоторые особенности кристаллографии больших молекул. В белковой кристаллографии структура молекул определяется на основе расчета распределения электронной плотности во всем объеме элементарной ячейки нативного кристалла. Для этого необходимо выяснить положение тяжелых атомов в производных, что и позволит рассчитать фазы всех дифракционных максимумов нативного кристалла. В ходе этой работы часто возникают серьезные затруднения, обусловленные большим размером исследуемых молекул. В отличие от кристаллографии малых молекул здесь необходимо измерять интенсивности огромного количества дифракционных максимумов, работать с большими по размеру картами электронной плотности и конструировать модели молекул, состоящих из большого числа атомов.
20.1.4.7. Сбор экспериментальных данных. В ходе развития методов белковой кристаллографии были созданы дифрактометры, измеряющие с помощью счетчика интенсивности рассеянного излучения. Такой дифрактометр автоматически помещает счетчик в область нахождения дифракционного максимума и соответствующим образом ориентирует кристалл в пучке рентгеновских лучей. Разработаны также устройства, позволяющие учитывать существование дефектов кристаллической решетки и фонового рассеянного излучения. Автоматические дифрактометры позволяют проводить измерения целых наборов данных по интенсивностям дифракционных максимумов и записывать их на перфокартах, бумажных лентах или любым другим способом, позволяющим ввести данные в ЭВМ. Кроме того, дифрактометр может быть непосредственно связан с ЭВМ, что облегчает работу экспериментатора и позволяет проводить измерения с большей точностью и надежностью. В настоящее время эти приборы широко используются для структурных исследований при низком разрешении (до 0,6 нм), где число анализируемых рефлексов относительно невелико. Однако следует признать, что эффективность применения таких приборов все же недостаточно высока. Из-за большого размера элементарной ячейки белковые кристаллы отражают рентгеновское излучение в широком диапазоне углов, тогда как обычный счетчик может в данный момент времени работать только с одним из отражений. Поэтому время, необходимое для сбора полного набора данных, часто превышает время жизни кристалла в рентгеновском эксперименте. А это в свою очередь делает необходимым объединение данных, полученных на разных кристаллах.
Для работы при низком разрешении или с белками малой молекулярной массы ограниченное время жизни кристаллов не вызывает серьезных проблем. Однако с увеличением молекулярной массы исследуемой молекулы или при повышении разрешения возникает необходимость в увеличении эффективности методов сбора данных. Один из путей увеличения эффективности состоит в применении двумерного детектора, представляющего собой периодическую решетку из счетчиков, улавливающих каждый фотон, рассеянный кристаллом. Конструкции таких приборов, работающих под контролем ЭВМ, активно разрабатываются в настоящее время.
Проблему увеличения эффективности сбора данных удалось частично решить с помощью фотометода. При использовании прецессионных фотографий наиболее сложная часть работы связана с индексированием рефлексов, т. е. с приписыванием каждому из рефлексов соответствующих индексов Миллера h, k и l. Вместе с тем при получении таких фотографий используются металлические экраны, перекрывающие рефлексы от всех слоев сферы отражения, кроме исследуемого. При этом часть информации теряется. По-видимому, более эффективна безэкранная съемка. Индексирование фотографий, полученных таким методом и являющихся суперпозицией многих слоев сферы отражения, проводят с помощью ЭВМ. Поэтому одним из этапов обработки экспериментальных данных является преобразование дифракционной картины в двумерную карту распределения оптической плотности с помощью автоматических денситометров.