Практическая химия белка - А. Дарбре 1989
Фрагментация полипептидов химическими методами
Расщепление по остатку триптофана
Расщепление по остатку триптофана в системе ДМСО - галогеноводородные кислоты
Триптофансодержащие белки и пептиды можно расщепить избирательно смесью ДМСО и бромоводородной кислоты в уксусной кислоте. По выходу продуктов реакции этот метод сопоставим с расщеплением BNPS-скатолом, однако превосходит его по доступности реагентов и простоте реализации [51, 163]. Механизм реакции заключается в окислительном галогенировании индольного ядра триптофана. Фактически при взаимодействии сульфоксида и галогеноводородной кислоты имеют место несколько равновесных реакций [уравнение (2.15)] с образованием в качестве главного промежуточного продукта галогеносульфониевого иона R1R2SX+ [14]. Галогенирование индольного ядра триптофана могут осуществлять все три промежуточные соединения: дигалогенид сульфида, галогенид галогеносульфония и свободный галоген.
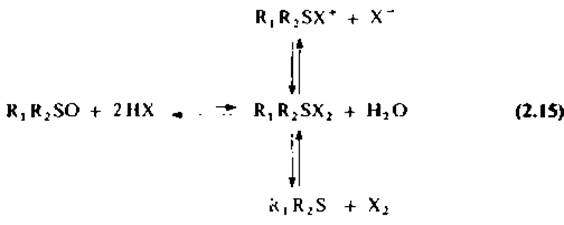
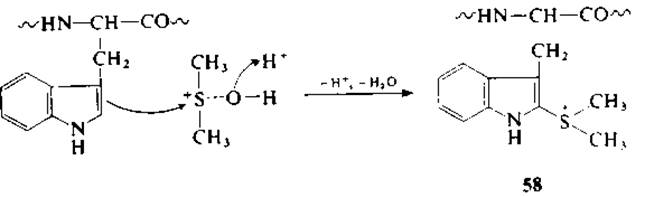
В то время как в смеси ДМСО — НСl однозначно идет превращение триптофана в оксоиндолилаланин [162, 164], в ДМСО — НВr триптофан окисляется до диоксоиндолилаланина с одновременным образованием спиролактона [51]. Триптофансодержащие пептиды также окисляются смесью ДМСО — НВr до диоксоиндолилаланина, и только в этом случае окисление сопровождается расщеплением пептидной связи. Показано также, что оксоиндолилаланинпептиды, полученные при обработке смесью ДМСО—НСl, могут быть расщеплены при последующей обработке смесью ДМСО—НВr. Этот факт свидетельствует об образовании в качестве промежуточного продукта реакции оксоиндола [162—164]. Для достижения оптимального выхода продуктов реакции рекомендуется проводить последовательную обработку белков смесями ДМСО — НСl, а затем ДМСО — НВr in situ. Непосредственное взаимодействие триптофансодержащих пептидов с ДМСО — НВr приводит к образованию в качестве промежуточного продукта 2-диметилсульфоиийтриптофана (58). По-видимому, образование такого соединения происходит в результате электрофильного замещения в положении 2 индольного ядра триптофана протонированным ДМСО по аналогии с реакцией, наблюдающейся в ряду фенолов и их эфиров [63].
Реакция расщепления под действием смеси ДМСО — галогеноводородная кислота идет избирательно по пептидной связи триптофана. При этом метионин окисляется до S-оксида, а цистеин — до цистина. На практике с целью защиты остатка тирозина в реакционную смесь добавляют немного фенола. Рекомендуется добавлять фенол и в 48%-ную НВr для связывания следов брома. Указанных мер вполне достаточно для полного сохранения тирозина [163], однако известно одно исключение, когда отмечалась его деструкция [57].
2.5.3.1. Расщепление по остатку триптофана путем обработки смесями ДМСО — HCl и ДМСО — НВr [163]. Цитохром с (17 мг) и 20 мг фенола растворяют при 20 °С в смеси следующего состава: ледяная уксусная кислота (600 мкл) + 12 М НСl (300 мкл), ДМСО (12 мкл). Спустя 30 мин в реакционную смесь добавляют 48%-ную НВr (100 мл) и ДМСО (25 мкл) и инкубируют при 20 °С в течение 30 мин. Затем прибавляют 2 мл воды и несколько раз экстрагируют этилацетатом (для удаления гема и продуктов его деструкции). Водную фазу частично упаривают в вакууме, остаток хроматографируют в 10%-ной муравьиной кислоте на колонке (2X14 см) с сефадексом G-50 (супермелкий). Пептидные фрагменты цитохрома с элюируются в виде трех фракций. Первая фракция, которой предшествуют следы агрегированного белка, содержат апоцитохром с с модифицированным (в виде диоксоиндолилаланина) триптофаном-59. Вторая и третья фракции содержат соответственно фрагменты 1—59 и 60—104 (выход, ~60%, продуктов реакции определяют по результатам взвешивания после лиофилизации).
Фрагменты идентифицируют по аминокислотному составу гидролизата после гидролиза З М n-толуолсульфокислотой [117]. Выход аминокислот по результатам анализа соответствовал составу апоцитохрома с и его фрагментов. Остатки метионина в положении 65 и 80 были окислены до метионин- S-оксида. Под действием реагента происходило полное отделение гема по аналогии с действием на цитохром с BNPS-скатола [50].
2.5.3.2. Расщепление по остатку триптофана под действием ДМСО — HCl и BrCN [83]. Предварительно восстанавливают и алкилируют присутствующие в белке остатки цистина (цистеина). Для этой цели используют реагенты обычной классификации. Небольшое количество раствора образца, содержащего 2—3 нмоль белка, помещают в микропробирку объемом 1,5 мл от центрифуги Эппендорф и высушивают лиофильно. К сухому остатку прибавляют 4,9 мкл свежеприготовленного реагента (300 мкл ледяной уксусной кислоты+150 мкл 9 М HCl+40 мкл ДМСО) и инкубируют при 20 °С в течение 30 мин или при 4 °С в течение 2 ч. Затем реакционную смесь охлаждают на ледяной бане, добавляют 4,4 мкл охлажденного во льду 15 М (продажного) NH4OH (при этом возможно появление осадка белка) и 40 мкл раствора бромоциана (0,3 г/мл) в 5 М уксусной или 60%-ной муравьиной кислоте. Пробирку плотно закрывают и герметизируют с помощью пленки парафильм. Реакционную смесь инкубируют при 20 °С без доступа света в течение 12—15 ч или при 4 °С в течение 30 ч.
Расщепление но триптофану проходит почти количественно независимо от строения соседних аминокислот. Реакция не сопровождается расщеплением или модификацией других аминокислот. Проведению реакции не мешает присутствие небольших количеств солей, ионных детергентов или кумасси голубого.