ОСНОВЫ СТРОЕНИЯ И КИНЕТИКИ ФЕРМЕНТОВ В БИОЛОГИЧЕСКИХ СИСТЕМАХ - О. А. Науменко - 2017
4 Лабораторный практикум
4.1 Проведение реакций осаждения белков с оценкой их первичного и вторичного состава с помощью цветных реакций
Реакции осаждения белков используют при разделении белковых фракций в процессе выделения и очистки белков, для получения безбелковых растворов (например, при выделении ДНК из животных тканей), для экспресс - обнаружения белка в биологических жидкостях (например, в моче).
Изменение зарядов белковых молекул и/или снятие гидратной оболочки приводит к агрегации белковых молекул и выпадению их в осадок - денатурации белка. При нагревании молекулы белков денатурируют, т. е. теряют свою нативную структуру, разворачиваются, но остаются во взвешенном состоянии, что проявляется в помутнении разбавленного белкового раствора.
Цель работы
Провести реакции осаждения растворов белков различными методами.
Оценить с помощью цветных реакций до начала и после окончания реакций осаждения качественный состав растворов белков.
Принцип метода
Для осаждения белка нужно лишить его стабилизирующих факторов: снять заряд, удалить гидратную оболочку или разрушить третичную структуру (вызвать денатурацию), используя различные химические реагенты или нагревание.
Методические указания к выполнению лабораторной работы
1. Нагревание вызывает денатурацию белка, сопровождающуюся помутнением раствора.
2. Минеральные и органические кислоты вызывают дегидратацию и перезарядку части белковых молекул, сопровождающуюся их денатурацией.
3. Соли тяжелых металлов вызывают денатурацию белка, что обусловлено адсорбцией ионов металлов на поверхности белковой молекулы и образованием нерастворимого комплекса.
4. Органические растворители снимают гидратную оболочку и понижают устойчивость белка в растворе, но осадок выпадает только в нейтральных и слабокислых растворах. Длительное действие органического растворителя вызывает денатурацию белка.
5. Интенсивность окраски в цветных реакциях пропорциональна количеству реагирующих функциональных групп. Поэтому цветные реакции могут быть использованы для качественного и количественного определения белков, для определения присутствующих в них аминокислот или для анализа состава белков:
- с помощью биуретовой реакции определяют наличие пептидных групп в олигопептидах и в белках (универсальная реакция для любых белков);
- с помощью нингидриновой реакции определяют наличие α-аминогрупп в свободных аминокислотах, олигопептидах и белках (универсальная реакция для любых белков);
- с помощью ксантопротеиновой реакции определяют наличие в белках ароматических аминокислот;
- с помощью реакции Фоля определяют наличие в составе белков серосодержащей аминокислоты - цистеина.
Ход работы
1. Приготовление растворов белков.
Раствор I: белок одного куриного яйца разводят в 300 мл дистиллированной воды и фильтруют; для приготовления раствора II используют 1%-ный раствор желатины. Раствор I содержит овальбумин (яичный белок), а раствор II - желатин (овальбумин содержит все 20 аминокислот, а желатина только 17).
2. Провести цветные реакции с каждым раствором белка и результаты занести в таблицу 4.1.
Таблица 4.1 — Цветные реакции
Реакция |
Номер пробирки |
Ход работы |
Окраска до осаждения |
Окраска после осаждения растворов |
Биуретовая |
1 |
Раствор 1-5 капель, 10 % раствор NaOH- 5 капель, 1 % раствор CuSO4 - 1 капля |
||
2 |
Раствор II - 5 капель, 10 % раствор NaOH - 5 капель, 1 % - оаствоо СuSO4 - 1 капля |
|||
Нингидриновая |
1 |
Раствор 1-5 капель, 1% раствор нингидрина в ацетоне - 2 капли; нагревают |
||
2 |
Раствор II - 5 капель, 1 % раствор нингидрина в ацетоне - 2 капли: нагревают |
|||
Ксантопротеиновая |
1 |
Раствор 1-5 капель, HNO3 (конц.) - 3 капли; осторожно нагревают |
||
2 |
Раствор II - 5 капель, HNО3(конц.) - 3 капли; осторожно нагревают |
|||
Фоля |
1 |
Раствор 1-5 капель, 30 % раствор NaOH- 5 капель, 5 % раствор (СН3СОО)2Рb -1 капля; нагревают до кипения |
||
2 |
Раствор 1-5 капель, 30 % раствор NaOH- 5 капель, 5 % раствор (СН3СОО)2Рb -1 капля; нагревают до кипения |
3. Провести осаждение белка различными методами и результаты занести в таблицу (таблица 4.2):
Таблица 4.2 — Реакции осаждения белка
Реакция осаждения |
Ход работы |
Наблюдения |
Чем обусловлена реакция |
Нагреванием |
В пробирку вносят 10 капель раствора яичного белка, нагревают до появленияосадка |
||
Органическими кислотами - (трихлоруксусная кислота (ТХУ)) |
В пробирку вносят 10 капель раствора белка, добавляют 5 капель 10 % раствора ТХУ, перемешивают |
||
Солями тяжелых металлов (CuSО4) |
В пробирку вносят 5 капель раствора белка, прибавляют 1 каплю 7 % раствора CuSО4, перемешивают |
4. Провести цветные реакции с растворами белка после осаждения.
5. Сформулируйте выводы.
Контрольные вопросы к лабораторной работе
1. Где на практике используются реакции осаждения белков?
2. Что происходит со структурой белка при его осаждении?
3. Расскажите механизм биуретовой реакции.
4. Расскажите механизм ксантопротеиновой реакции.
5. Расскажите механизм реакции Фоля.
6. Расскажите механизм нингидриновой реакции.
7. Будет ли давать яичный альбумин положительные биуретовую, нингидриновую реакции после осаждения тяжелыми металлами? Объясните почему.
8. Будет ли положительной реакция Фоля у яичного альбумина после осаждения тяжелыми металлами и почему?
4.2 Количественное определение белка биуретовым методом
Определение концентрации белка проводят при изучении, выделении и очистке белков; в промышленности в процессе получения ферментов, пищевых белков, белковых лекарственных препаратов.
Существует много различных методов количественного определения белков. Среди них широкое распространение получили колориметрические методы, основанные на способности белков давать окрашенные комплексы с рядом реактивов (цветные реакции). Среди этих методов наиболее распространены биуретовый метод и его модификация (метод Лоури).
Цель работы
Освоить работу фотоэлектроколориметра (ФЭК). Научиться строить стандартные калибровочные кривые. Определить содержание белка в пробе с неизвестной концентрацией.
Принцип метода
Биуретовый метод основан на образовании окрашенного в фиолетовый цвет комплексного соединения азота, входящего в состав пептидных связей белка, с ионами двухвалентной меди в щелочной среде (биуретовая реакция). Интенсивность развивающейся окраски раствора прямо пропорциональна концентрации белка и определяется фотометрически. Для количественного определения белка измеряют интенсивность окраски стандартных растворов белка с известной концентрацией (величину оптической плотности Д.т). По полученным данным строят график зависимости оптической плотности окрашенных растворов от концентрации в них белка (стандартную калибровочную кривую). На оси ординат всегда откладывают величину О как функцию от задаваемых значений.
Измеряют оптическую плотность Вх окрашенного раствора с неизвестной концентрацией белка и по стандартной кривой определяют в нем концентрацию белка. В качестве стандартного раствора белка обычно используют раствор сывороточного альбумина.
Ход работы
1. Приготовьте биуретовый реактив из исходного концентрата (медь сернокислая - 120 ммоль/л, калий йодистый - 300 ммоль/л, калий - натрий виннокислый - 320 ммоль/л, гидроксид натрия - 3 моль/л) и разведите его перед работой непосредственно перед работой в соотношении 1:19.
2. Приготовьте растворы трех концентраций:
- 0 мг/мл;
- 20 мг/мл;
- 30 мг/мл.
3. В три пробирки внесите растворы в соответствии с таблицей 4.3, перемешайте и инкубируйте в течение 30 мин при комнатной температуре.
Таблица 4.3 - Этапы количественного определения белка
Реактивы и этапы |
Контроль |
Стандартный раствор белка |
Раствор неизвестного белка, мг/мл |
||
0 мг/мл |
20 мг/мл |
30 мг/мл |
|||
Раствор яичного альбумина, мл |
- |
0,2 |
0,2 |
0,2 |
0,2 |
Н2O, мл |
0,2 |
- |
- |
- |
- |
Биуретовый реактив, мл |
5 |
5 |
5 |
5 |
5 |
4. Проведите фотоэлектроколориметрию против Н2O при длине волны = 545 нм и толщине кюветы 1 см и определите величину оптической плотности Д.т для каждого раствора.
5. Постройте калибровочную кривую зависимости оптической плотности окрашенных растворов от концентрации в них белка. На оси ординат всегда откладывают величину О как функцию от задаваемых значений.
6. Измерьте оптическую плотность раствора с неизвестной концентрацией белка и по стандартной кривой и определите в нем концентрацию белка.
Контрольные вопросы к лабораторной работе
1. Где на практике используют количественное определение белка?
2. Как приготовить биуретовый реактив.
3. На каких цветных реакциях основано количественное определение белка и почему?
4. Как строить калибровочную кривую?
4.3 Диализ солевого раствора белка
Диализом называют процесс разделения высокомолекулярных веществ (например, белков) и низкомолекулярных (например, солей) с помощью полупроницаемых мембран.
Полупроницаемыми называют мембраны, диаметр пор которых позволяет проходить только низкомолекулярным соединениям. Примером естественных полупроницаемых мембран могут быть капсулы Боумена - Шумлянского в почках. Широко используют искусственные полупроницаемые мембраны целлофан и коллодий, на основе которых созданы диализаторы, в том числе «искусственная почка».
Метод диализа используют в научных лабораториях, промышленности, клинической практике.
Цель работы
Доказать, что низкомолекулярное соединение КаСI проходит через полупроницаемую мембрану, а высокомолекулярный белок не проходит и остается в диализируемом растворе.
Принцип метода
Метод основан на том, что низкомолекулярные вещества легко диффундируют через полупроницаемые мембраны в чистый растворитель, образуя диализат. Диффузия будет продолжаться, пока не произойдет выравнивание концентраций диффундируемого вещества между диализируемым раствором и диализатом. Процесс возобновится, если диализат заменить чистым растворителем или если эта смена будет происходить постоянно (проточный диализ).
Ход работы
1. Подготовка диализатора. Полупроницаемой мембраной могут быть диализные трубки или целлофановые диализные мешочки. Целлофан (квадрат 10x10 см) смачивают дистиллированной водой, делают в нем углубление и получают диализный мешочек.
2. Приготовление диализируемого раствора. В диализный мешочек помещают 20 капель яичного белка, разведенного в 5 % растворе КаСI (белок одного яйца разводят в 300 мл 5 % раствора КаСI), и перемешивают. Края целлофана зажимают между двумя стеклянными палочками, скрепленными между собой резиновыми кольцами.
3. Диализ. Мешочек с солевым раствором белка помещают в стакан с дистиллированной водой так, чтобы часть мешочка с раствором белка была полностью погружена в воду. Сразу же на просвет можно заметить струйки солевого раствора, опускающиеся из мешочка на дно стакана, что обусловлено изменением рефракции воды.
4. Анализ результатов диализа. Через 60 мин после начала диализа проводят качественные пробы на белок (биуретовую реакцию) и на ионы хлора (с AgNO3) в соответствии с таблицей 4.4.
Таблица 4.4 - Порядок выполнения исследования
Реактив |
Проба на белок |
Проба на ионы СI в диализате |
|
в диализате |
в диализируемом растворе |
||
Диализат |
10 капель |
- |
10 капель |
Диализируемый раствор |
- |
10 капель |
- |
10 % раствор NaOH |
5 капель |
5 капель |
- |
1 % раствор CuhSO4 |
1 капля |
1 капля |
- |
10 % - ный раствор HNO3 |
- |
- |
1 капля |
1 % раствор AgNO3 |
- |
- |
1 капля |
Наблюдения |
|||
5. Сформулируйте выводы.
Контрольные вопросы к лабораторной работе
1. Где происходит диализ белка в организме человека?
2. Что может служить в качестве диализатора.
3. Что такое полупроницаемые мембраны?
4. Как готовить диализируемые растворы?
5. Какие реакции подтверждают эффективность диализа и почему?
6. Что такое проточный диализ?
4.5 Бумажная хроматография аминокислот
Хроматографический метод, разработанный русским ученым М. С. Цветом, является одним из относительно простых и быстрых методов разделения смеси веществ.
Существует несколько разновидностей метода в зависимости от принципа разделения смеси на составляющие компоненты (адсорбционная, ионообменная, аффинная хроматография).
Примером адсорбционной хроматографии является распределительная хроматография на бумаге, которая оказалась наиболее удобной для разделения аминокислот, отличающихся гидрофобностью радикалов, а также для
идентификации неизвестных аминокислот путем сравнения их подвижности с подвижностью известных аминокислот («свидетелей»).
Цель работы
Провести разделение смеси двух неизвестных аминокислот, считать для каждой из них коэффициент распределения (Кr) и идентифицировать аминокислоты по сравнению с Кrстандартных аминокислот (глутаминовой кислоты и лейцина).
Принцип метода
Метод основан на различной растворимости отдельных аминокислот в двух частично смешивающихся жидкостях: в воде, которая удерживается фильтровальной бумагой и является неподвижной фазой растворителя, и в подвижной фазе органического растворителя (бутанол: уксусная кислота: вода в соотношении: 5:1:4).
По мере продвижения растворителя по бумаге происходит многократное перераспределение аминокислот между подвижной и неподвижной фазами растворителя. Чем больше гидрофобность аминокислоты, тем быстрее она будет продвигаться по бумаге и наоборот. В соответствии с этим расстояния, которые аминокислоты пройдут с подвижной фазой растворителя по бумаге, будут различными.
Скорость передвижения каждой аминокислоты может быть выражена коэффициентом распределения (Кr). Коэффициентом распределения называют отношение расстояний (в мм) от места нанесения аминокислоты (старта) до середины ее пятна (величина а) к расстоянию от места старта до границы фронта растворителя (величина b). Чем выше гидрофобность аминокислотного радикала, тем ближе к единице будет величина Кr.
Коэффициент распределения для каждой аминокислоты постоянен при стандартных условиях проведения опыта (тип бумаги, температура, тип растворителя, влажность) и служит средством идентификации аминокислот по сравнению с аминокислотами - «свидетелями».
Ход работы
1. Диск хроматографической бумаги диаметром 12 см размечают карандашом (рисунок 4.1).
Рисунок 4.1- Диск хроматографической бумаги
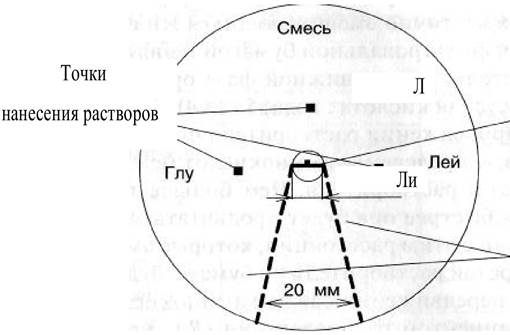
2. В места, отмеченные точками, наносят по 2 мкл образцов стандартных растворов аминокислот (0,6 % раствор глутаминовой кислоты и 0,5 % раствор лейцина) и смесь неизвестных аминокислот. Высушивают бумажный диск с образцами на воздухе.
3. Разрезают хроматографический диск по линиям разреза, отгибают по линии сгиба получившуюся ножку и укорачивают ее до длины 3 см.
4. Помещают диск в хроматографическую камеру (чашку Петри) так, чтобы ножка была погружена в органический растворитель.
5. Когда фронт растворителя пройдет 5-6 см, извлекают хроматограмму из камеры и тщательно обводят карандашом, образовавшийся фронт растворителя.
6. Высушивают диск в сушильном шкафу при температуре от 60 до 80 °С.
7. Погружают диск в 0,5% раствор нингидрина в ацетоне и вновь высушивают до проявления пятен аминокислот.
8. Рассчитывают значение Кr, для каждой аминокислоты, вклеивают полученную хроматограмму или зарисовывают ее.
9. Самостоятельное формулирование выводов
Контрольные вопросы к лабораторной работе
1. Что такое хроматография?
2. Какие есть разновидности хроматографии?
3. К какому виду хроматографии относится распределительная хроматография на бумаге?
4. Что такое коэффициент распределения аминокислоты?
6. Что такое аминокислоты - «свидетели»?
7. Как приготовить хроматографический диск.
8. Что является «фронтом» растворителя?
9. На чем основана распределительная хроматография аминокислот?
10. Как проявляется хроматограмма?
4.6 Титрометрическое определение активности каталазы
Оборудование и реактивы: кипящая водяная баня; пипетки на 5, 10, 20 и 25 мл; цилиндры измерительные с носиком на 10 и 25 мл; колба мерная на 100 мл; колбы конические на 200 мл; ступка с пестиком фарфоровые; перманганат калия (0,1 н); серная кислота (10 %); карбонат натрия; пероксид водорода (0,1 н); свежий растительный материал (картофель или морковь).
Ход работы
1) 2 г сырого картофеля (или моркови) растирают в ступке, постепенно добавляя 2-3 мл воды. Для уменьшения кислой реакции добавляют на кончике шпателя карбонат натрия до прекращения выделения пузырьков углекислого газа;
2) растертую массу количественно переносят в мерную колбу и доводят водой до объема 100 мл;
3) смесь оставляют стоять в течение 30 минут, после чего ее фильтруют;
4) далее определяют активность по схеме: - 2 опытных пробы и 2 контрольных, согласно таблице 4.5:
Таблица 4.5 - Порядок работы
Опыт |
Контроль |
20 мл вытяжки фермента |
20 мл вытяжки фермента |
— |
Нагревание 10 мин на кипящей водяной бане |
25 мл 0,1 н перекиси водорода |
25 мл 0,1 н перекиси водорода |
Инкубация 30 минут при комнатной температуре |
|
5 мл 10 % H2SО4 |
5 мл 10 % H2SО4 |
Опыт и контроль титруют 0,1 н. раствором перманганата калия (до образования устойчивого в течение примерно 1 мин бледно-розового окрашивания). Отмечают количество раствора перманганата калия, пошедшего на титрование оставшегося (после ферментативного разложения) пероксида водорода в опытной колбе и на титрование всего пероксида водорода в контрольной. По разности между опытным и контрольным титрованием находят количество перманганата, эквивалентное количеству разложенного ферментом пероксида водорода.
Расчет ведут в соответствии с уравнением реакции:
5Н2О2 + 2KMnО4 + 3H2SО4 —> 2MnSО4 + K2SО4 + 5О2 + 8Н2О, согласно которому 1 мл 0,1 н раствора перманганата калия соответствует 1,7 мг пероксида водорода.
Пример расчета: из 1,25 г моркови приготовлена вытяжка каталазы объемом 100 мл: на титрование опытной пробы затрачено 15,5 мл, контрольной 30,2 мл 0,1 н раствора перманганата калия. Количество разложенного пероксида водорода в пробе эквивалентно (30,2 - 15,5) 14,7 мл 0,1 н. раствора перманганата калия и, следовательно, равно (14,7 • 1,7) 24,99 мг. Значит, в 1 г сырой моркови содержится количество каталазы, способное разложить (24,99 • 100/ 20 • 1,25) = 99, 96 мг пероксида водорода, а за 1 мин - (99,96:30) 3,33 мг. Так как 1 мкмоль пероксида водорода составляет 0,034 мг, то в 1 г моркови присутствует (3,33: 0,034) 100 Е каталазы.
Контрольные вопросы к лабораторной работе
1. Рассчитайте содержание каталазы в исследуемом материале.
2. Напишите систематическое название данного фермента, его код по систематическому каталогу и опишите его биологическую роль.
4.7 Определение активности амилазы
Фермент амилаза (а - 1,4 Д - глюкан - глюканогидролаза, КФ 3.2.1.1) катализирует реакцию гидролиза α-1,4-гликозидных связей крахмала. Конечными продуктами гидролиза крахмала являются мальтоза и мальтотриоза. Основным источником амилазы у человека и животных являются поджелудочная железа и слюнные железы. Обе формы фермента идентичны по каталитическим свойствам и почти не различаются по электрофоретической подвижности. Активность амилазы может возрастать в присутствии ионов хлора. Оптимум pH фермента приходится на 6,5-7,5. Фермент содержит один ион кальция на молекулу белка. Поэтому в присутствии оксалата и цитрата наблюдается ингибирование активности амилазы, которая обусловлена связыванием ионов кальция этими соединениями.
Принцип метода
В основе предлагаемого метода используется реакция гидролитического расщепления нерастворимого цветного крахмального субстрата α-амилазой, протекающая с выделением свободного синего, растворимого в воде красителя. Количество освобожденного красителя в единицу времени пропорционально активности фермента.
Оборудование: pH - метр, спектрофотометр или фотоэлектроколориметр, центрифуга, магнитная мешалка, термостат.
Посуда: пипетки на 0,1 мл - 2 шт., на 1 мл - 2 шт., 2 мл - 2 шт.; колбы мерные на 50 мл — 2 шт.; стакан на 50 мл; воронка.
Реактивы: концентрированный буферный раствор (0,6 М фосфатный буферный раствор, pH 7, с 0,1 М NaCl); субстрат (цветной крахмал) - 0,6 г;
Приготовление рабочих растворов. Буферный раствор. В мерную колбу емкостью 50 мл вносят 5 мл концентрированного буферного раствора и разбавляют водой до метки. Перед использованием проверяют pH буфера.
Суспензия субстрата. В стакан емкостью 50 мл вносят 10 мл разбавленного буферного раствора и при постоянном перемешивании на магнитной мешалке медленно добавляют 0,1 г субстрата (цветного крахмала). Продолжают перемешивать до возникновения гомогенной суспензии (15- 20 мин). Приготовленную таким образом суспензию можно хранить одну неделю при температуре от +1 до +4°С.
Ход работы
Определение активности а - амилазы проводят следующим образом. В опытную и контрольную пробирки вносят по 1 мл суспензии субстрата. Пробирки прогревают в течение 5 мин при 37°С, затем добавляют в опытную пробирку 1,0 мл сыворотки крови (или супернатанта ткани, в которой определяется активность фермента), а в контрольную пробирку — 1,0 мл дистиллированной воды. Содержимое пробирок перемешивают и инкубируют точно 15 мин при 37°С. После этого добавляют в обе пробирки по 2,0 мл осаждающего раствора, перемешивают при комнатной температуре 15 мин. Супернатант отделяют от образовавшегося осадка центрифугированием 5-10 мин при 3000 об/мин, переносят в кювету шириной 0,5 см, затем измеряют поглощение (D) растворов из опытной пробирки по сравнению с раствором из контрольной пробирки при 590 нм.
Метод расчета. Активность α-амилазы (v) в пробе определяют по следующей формуле:
v = D х 1083 (Е/л), (4.1)
где v - активность амилазы, D - поглощение растворов.
Контрольные вопросы к лабораторной работе
1. К какой группе ферментов относится амилаза, назовите ее порядковый номер по международной номенклатуре.
2. Какую реакцию катализирует данный фермент?
3. Что является субстратом. А что продуктом реакции?
4. На чем основано определение активности данного фермента?
5. Как рассчитать активность амилазы?
4.8 Определение активности пероксидазы
Принцип метода
Пероксидаза является самым распространенным ферментом растений и животных. По своему строению относится к гемсодержащим гликопротеинам. Пероксидаза - самый распространенный фермент биогенных тканей, катализирует реакции индивидуального и совместного окисления субстратов, является компонентом антиоксидантных систем. Пероксидаза относится к группе двухкомпонентных ферментов, в составе которых гемин, представленный протопорфирином IX в комплексе с трехвалентным железом, и полипептидная цепь. Последняя включает от 203 до 308 аминокислот, и, в зависимости от природы изофермента, формирует компактную третичную структуру, представленную двумя доменами (большим и малым). Фермент имеет размер белковой глобулы, равный 50 А, содержащий около 43% α-спиральных участков.
Гемин нековалентно закреплен в углублении полипептидной цепи между доменами и удерживается там за счет гидрофобных связей и солевого мостика, образованного между остатком пропионовой кислоты гемина с одной из аминогрупп апобелка. Гемин можно обратимо отделить от белка при кислых pH.
К оксидазным субстратам фермента относится диоксифумаровая кислота и другие вещества, окисление которых сопровождается образованием продуктов свободнорадикального окисления.
В реакциях пероксидазного окисления субстратами фермента могут быть неорганические и органические соединения, окисляющиеся перекисью водорода. В реакциях пероксидазного окисления на поверхности фермента проявляются два участка, где происходит связывание субстратов, с расположенным вблизи регуляторным участком. При этом гем пероксидазы ориентирован таким образом в структуре белковой глобулы, что его винильные группы обращены внутрь белковой части, а пропионовокислые остатки обращены наружу и за счет ионных связей с функциональными группами белка принимают участие в связывании, ориентации и фиксации гема с апобелком фермента.
Углеводы, расположенные на поверхности белковой глобулы фермента, выполняют следующие функции: ориентируют фермент на поверхности мембраны; защищают белковую глобулу от разрушительного действия свободных радикалов; повышают стабильность пероксидазы к действию высоких температур.
В реакциях индивидуального и совместного пероксидазного окисления субстратами пероксидазы могут быть антиоксиданты (аскорбиновая кислота, дигидрокверцетин, кверцетин, гидрохинон и др.). Малые концентрации антиоксидантов инициируют реакции пероксидазного окисления, тогда как их высокие концентрации понижают каталитическую активность пероксидазы, ингибируя активность фермента. В зависимости от природы антиоксиданта, в реакциях совместного окисления субстратов наблюдаются эффекты активирования пероксидазы. При этом проявляется индивидуальный механизм действия фермента.
Для определения активности пероксидазы используются неорганические и органические соединения, при окислении которых перекисью водорода образуются окрашенные продукты. В данной работе предлагается использовать в качестве субстратов пероксидазы о-дианизидин, продукт пероксидазного окисления которого имеет максимумы поглощения при 460 и 420 нм, с коэффициентами молярного поглощения 30 и 1 мМ - 1см -1 соответственно.
Оборудование: pH-метр, фотоэлектроколориметр или спектрофотометр, центрифуга.
Посуда: пипетки на 0,1 мл — 3 шт., на 0,2 мл — 1 шт.; на 5 мл — 1 шт.; колбы на 50 мл — 2 шт. и на 500 мл — 3 шт.; пробирка — 1 шт.
Реактивы: 0,1 М натрий-фосфатный буфер; pH 7,0; 4,3 мМ
О - дианизидин; 15,4 мМ перекись водорода; супернатант зерновок пшеницы.
Приготовление реактивов. Буферный раствор готовится из исходных 0,1 М растворов Na2HPO4 и NaH2PO4 путем их смешивания на pH-метре до pH 6,0.
Раствор о-дианизидина (1,05 мг/мл) готовят, растворяя 52,5 мг навески в 50 мл 96%-ного этанола. Вещество хорошо растворяется при нагревании. Раствор должен быть бесцветным или слегка розовым.
Раствор ферроцианида калия (9,2 мг/мл) готовят, растворяя 460 мг навески в 50 мл дистиллированной воды.
Перекись водорода — 15,4-15,8 мМ водный раствор готовят на спектрофотометре с поглощением 1,12- 1,15 уел. ед. при длине волны 230 нм (е = 72,7 М 1см - 1).
Контрольные вопросы к лабораторной работе
1. К какой группе ферментов относится пероксидаза, назовите ее порядковый номер по международной номенклатуре.
2. Какую структуру имеет данный фермент?
3. Что является субстратами?
4. На чем основано определение активности пероксидазы?
5. Как рассчитать активность пероксидазы?
4.9 Влияние pH среды на активность пероксидазы
Принцип метода
Ряд факторов среды (pH и температура), а также присутствие активаторов и ингибиторов могут оказывать влияние на активность ферментов.
По данным ЯМР спектроскопии пятым аксиальным лигандом железа является имидазольная группа гистидинового остатка (Гис42) апобелка. Протонирование и депротонирование имидазола гистидина (рК~6,0), входящего в состав активного центра фермента, оказывает влияние на каталитические свойства фермента при различных pH. Оптимум активности фермента приходится на кислые pH и зависит от природы субстрата.
Оборудование: pH-метр, фотоэлектроколориметр, центрифуга.
Посуда: пипетки на 0,1 мл — 2 шт., на 0,2 мл — 1 шт., на 5 мл — 1 шт., на 10 мл — 1 шт.; колбы на 100 мл — 6 шт. и на 500 мл — 5 шт.; пробирки — 6 шт.
Реактивы: 0,1 М натрий-ацетатный буфер (pH 4,0 5,0 6,0) и 0,1 М натрий- фосфатный буфер (pH 6,0, 7,0 8,0); 1 М водный раствор НСI; 4,3 мМ водноспиртовой раствор о - дианизидина; 15,4 мМ раствор перекиси водорода, супернатант зерновок пшеницы.
Приготовление реактивов. Натрий-ацетатные буферные растворы (pH 4,0 5,0 6,0) готовят из исходных 0,1 М водных растворов СН3СООН и CH3COONa, а натрий-фосфатные буферные растворы (pH 6,0, 7,0 8,0) готовят из исходных 0,1 М водных растворов Na2HPO4 и NaH2PO4 путем их смешивания на pH - метре до желаемой величины pH. 1 М раствор НСI готовят, растворяя исходную концентрированную НСI в дистиллированной воде.
Раствор о - дианизидина (4,3 мМ этанольный раствор) готовят, растворяя 105 мг навески в 50 мл 96%-ного этанола. Вещество хорошо растворяется при нагревании. Раствор должен быть бесцветным или слегка розовым.
Перекись водорода - 15,4-15,8 мМ водный раствор готовят на спектрофотометре с поглощением 1,12 - 1,15 уел. ед. при длине волны 230 нм (е = 72,7 М - 1см).
Супернатант зерновок пшеницы получают, как описано в разделе 3.5.
Ход работы. В 6 пробирок последовательно вносят по 0,2 мл супернатанта, 2,6 мл 0,1 М буферных растворов (pH 4,0, 5,0, 6,0, 7,0, 8,0) и по ОД мл 4,3 мМ о- дианизидина, перемешивают, реакцию во всех пробирках инициируют введением 0,1 мл 15,4 мМ раствора Н2O2. Снова перемешивают и через 1 мин реакцию останавливают, добавляя в пробирки по 1 мл 1 М раствора НСI. Затем измеряют поглощение растворов в каждой пробирке на фотоколориметре при 460-500 нм (зеленый светофильтр). Рассчитывают активность пероксидазы в каждой пробирке. Затем строят на миллиметровой бумаге график зависимости изменения активности фермента от pH.
Контрольные вопросы к лабораторной работе
1. Определить pH - оптимум активности пероксидазы.
2. От каких факторов зависит активность ферментов.
3. Что означает оптимум pH ферментов?
4.10 Изучение влияние температуры и pH среды на активность трипсина
Оборудование и реактивы: пробирки, пипетки на 10 мл, две водяные бани, 1 мМ растворы БАПНА в 0,05 М фосфатном буфере со следующими значениями pH: 9, 7.6, 6, 5, раствор трипсина (10 мкг/мл), 1 н НСI.
1. Для изучения влияния pH среды на активность трипсина пользуются растворами БАПНА с разными значениями pH, по 2 опыта и 2 контроля в каждой параллели. Активность определяют по таблице 4.6:
Таблица 4.6 - Ход выполнения работы
Опыт |
Контроль |
1,6 мл раствора БАПНА |
1,6 мл раствора БАПНА |
— |
0,7 мл 1 н НСI |
Преинкубация в термостате при 37 °С в течении 10 минут |
|
0,5 мл раствора трипсина (10 мкг/мл) |
0,5 мл раствора трипсина (10 мкг/мл) |
Инкубация в термостате при 37 °С в течении 30 минут |
|
0,7 мл 1 н НСI |
— |
Измеряют оптическую плотность при 364 нм. Удельную активность фермента выражают в мкМ БАПНА, отщепленного 1 мкг трипсина за 1 мин, по калибровочной кривой. Строят график зависимости активности трипсина от pH среды.
2. Для изучения влияния температуры среды на активность трипсина пользуются этой же схемой, используя раствор БАПНА со значением рН=7,6, но пробирки инкубируют:
а) при комнатной температуре;
б) при 4 °С (инкубировать в холодильнике. Использовать предварительно охлажденные растворы!);
в) на водяной бане при t=55 °С;
г) на водяной бане при t=75 °С.
Содержание отчета
1. График зависимости активности трипсина от pH среды.
2. График зависимости активности трипсина от температуры.
4.11 Очистка алкогольдегидрогеназы методом гель - хроматографии
Принцип метода. Гель - хроматография - это способ разделения веществ на основе разницы в их молекулярной массе (размера частиц). В качестве носителей в гель-хроматографии используются сефадексы (G -10, G -15, G - 25, G - 50, G - 75, G - 100, G - 150, G - 200), основой которых является полисахарид декстран, сшитый поперечными связями, формирующих трехмерную сетчатую структуру с высокой степенью гидрофильности за счет большого количества на их поверхности полярных гидроксильных групп. Сефадекс не растворим в воде и стабилен в кислотных, щелочных и солевых растворах. После погружения в воду сефадекс набухает, приобретая способность фракционировать различные молекулы в зависимости от их размера. Крупные частицы, имеющие более высокую молекулярную массу, двигаются значительно быстрее частиц меньших размеров, которые задерживаются внутри гранул сефадекса.
Таким образом достигается разделение (фракционирование) молекул, которое, используется для:
а) обессоливания растворов;
б) отделения мелких по размеру и молекулярной массе молекул от крупных.
Гель-фильтрация используется для очистки ферментов от субстратов и кофакторов или белков от аминокислот и пептидов и т. д.
Оборудование: фотоэлектроколориметр с проточной кюветой или Uvicord (LKB, Швеция), хроматографическая колонка (1x30 см), лиофильная сушка.
Посуда: стакан; пипетка на 5 мл; пробирки для сбора фракций элюции — 50 шт.
Реактивы: 500 мл 0,05 М раствор глицина; 100 мл 96% - ный этанол; сефадекс G - 25 fine. Приготовление рабочих растворов. Раствор глицина готовится путем растворения 1,875 г глицина в 500 мл дистиллированной воды.
Хроматографическая колонка наполняется сефадексом G-25 fine, который предварительно набухал в течение 24 ч при комнатной температуре в дистиллированной воде. Перед употреблением колонка промывается 0,05 М раствором глицина.
Построение калибровочного графика. В работе используют калибровочный график, построенный для определения белка по Лоури.
Ход работы. Семена пшеницы гомогенизируют на механическом гомогенизаторе до получения однородной массы. Затем добавляют 0,05 М раствор глицина в соотношении 1:3 (на 1 г семян 3 мл раствора). Для удаления не полностью разрушенных клеток и ядер гомогенат центрифугируют 10 мин при 7000 g. В супернатант добавляют этанол до 70% концентрации, интенсивно встряхивают в течение 5 мин, смесь центрифугируют. Осадок после растворения в небольшом количестве 0,05 М раствора глицина наносят на колонку (1 х 30 см) с сефадексом G- 25 fine, уравновешенную 0,05 М раствором глицина, элюирование проводят этим же раствором. Оптическую плотность элюируемых растворов измеряют при 280 нм с помощью прибора Uvicord (LKB, Швеция) или на спектрофотометре оборудованном проточной кюветой. Фракции с наибольшей активностью и малым фоном лиофилизируют. Образец содержит 90-95% алкогольдегидрогеназы от общего содержания белка. Концентрацию белка определяют по биуретовой реакции или методу Лоури.
Выход по белку, активности рассчитывают по показателям общего белка и общей активности, принимая их за 100% у исходных образцов, а степень очистки по величинам удельной активности, принимая показания исходных образцов за единицу.
Контрольные вопросы к лабораторной работе
1. Что такое гель - хроматография?
2. Что такое сефадексы. Где они используются и какими свойствами обладают?
3. За счет чего происходит разделение фракций при гель - хроматографии?
4.12 Обнаружение НАД в дрожжах
Принцип метода
НАД встречается во многих органах и тканях человека и животных, богаты им и дрожжи. Этот кофермент легко извлекается из дрожжей горячей водой (он термостабилен) и может быть обнаружен по образованию флуоресцирующего комплекса с ацетоном. Эта реакция характерна для N-производных амида никотиновой кислоты. Он применяется для определения метилникотинамида в моче.
Реактивы, исследуемый материал:
1) ацетон;
2) раствор NaOH - 300 г/л;
3) концентрированная соляная кислота;
4) спиртовой раствор фенолфталеина - 5 г/л;
5) дрожжи.
Ход работы
В пробирку помещают кусочек дрожжей величиной 4-5 мм, добавляют 1/3 пробирки воды и кипятят 20 - 30 сек., не допуская выбрасывания жидкости. Отфильтровывают в пустую пробирку 5 -10 капель полученного экстракта, добавляют 3-5 капель ацетона и 1-2 капли раствора едкого натра. Оставляют пробирку на 2 мин.; затем добавляют 1 каплю раствора фенолфталеина и по каплям соляную кислоту до обесцвечивания фенолфталеина. Пробирку в процессе добавления кислоты встряхивают. Поместить пробирку на 2 мин. в кипящую водяную баню, затем охладить и поднести к включенному флуориметру.
Ацетоновый комплекс НАД флуоресцирует синим светом.
Контрольные вопросы к лабораторной работе
1. Что такое НАД и какую функцию он выполняет в ферментативном катализе?
2. В состав каких ферментов входит НАД?
3. На каком явлении основано определение НАД в дрожжах?
4.13 Обнаружение цитохромоксидазы в мышцах
Принцип метода
Цитохромоксидаза — заключительный фермент в цепи переноса электронов и протонов. Он способен окислять при участии кислорода не только цитохромы, но и некоторые другие соединения, в частности диметилпарафенилендиамин и α-нафтол. При окислении двух последних соединений образуется индофеноловая синь. Указанная реакция не протекает в тканях человека и животных, однако широко используется для обнаружения цитохромоксидазы. По первым слогам слов «нафтол» и «диметил» она была названа реакцией НАДИ, а реактив, содержащий нафтол и диметилпарафенилендиамин, реактивом НАДИ.
Реактивы, исследуемый материал:
1) реактив НАДИ (готовят за 1 час до определения): 1 % водный раствор диметилпарафенилендиамина смешивают с равным объёмом 1 % спиртового раствора, 1,5 % α-нафтола и 1,5 % раствора карбоната натрия; 2) мышцы.
Ход работы
В ступке с водой растирают кусочек мышцы. Часть полученной переносят в пробирку и подвергают тщательному кипячению. Затем кусочки мышцы, оставшиеся в ступке, и кусочки из пробирки отделяют от избытка воды фильтрованием. Фильтры с кусочками мышцы разворачивают. На мышцу наносят по 2-3 капли реактива НАДИ. Ненагретая мышца постепенно окрашивается в сине-фиолетовый цвет, а нагретая, где цитохромоксидаза инактивирована, окраски не дает.
Указания к оформлению лабораторной работы
В протоколе отметьте принцип работы, ход (кратко). Сделайте выводы о свойствах НАД.
Контрольные вопросы к лабораторной работе
1. Почему восстановление водородом метиленового синего происходит раньше, чем рибофлавина?
4.14 Обнаружение каталазы в крови
Принцип метода
При окислительных процессах может образовываться перекись водорода, которая разлагается ферментом каталазой (содержится в различных клетках, включая клетки крови) на воду и молекулярный кислород.
Реактивы, исследуемый материал:
1) раствор перекиси водорода - 30 г/л;
2) кровь.
Ход работы
В пробирку следует внести 10-15 капель перекиси водорода и 3 капли крови. Отметить выделение пузырьков кислорода. При внесении в пробирку тлеющей лучинки она вспыхивает, так как выделяющийся кислород усиливает горение.
Указания к оформлению лабораторной работы
Результаты сравнивают по интенсивности окраски и делают заключение об открытии окислительного фосфорилирования и разобщении дыхания и окислительногофосфорилирования в митохондриях печени крыс.
4.15 Сукцинатдегидрогеназа мышц и конкурентное торможение её активности
Сукцинатдегидрогеназа (КФ 1.3.99.2) катализирует превращение янтарной кислоты в фумаровую. Кофактором фермента является ФАД. Фермент прочно связан с внутренней мембраной митохондрий.
Принцип метода
В качестве окисляемого субстрата берут янтарную кислоту, а в качестве акцептора водорода краситель синего цвета 2,6 -дихлорфенолиндофенол, который восстанавливается в бесцветную лейкоформу. Конкурентное торможение фермента вызывает структурный аналог янтарной кислоты - малоновая кислота.
Реактивы:
1) краситель - 2,6 - дихлорфенолиндофенол, 0,001 н. раствор;
2) фосфатный буфер, 1/15 М, pH 7,4;
3) NaOH, 0,1 н. раствор;
4) янтарная кислота (сукцинат), 3 % раствор (0,6 М);
5) малоновая кислота (малонат), 3 % раствор.
Ход работы
1-2 г свежей мышцы измельчают ножницами и растирают в ступке с небольшим количеством воды. Полученную кашицу переносят на двойной слой марли, промывают 25 мл дистиллированной воды, отжимают и суспендируют в 4 мл воды. Суспензию разливают по 1 мл в четыре пробирки.
Содержимое первой пробирки кипятят в течение 12 мин. для инактивации фермента. Затем в пробирки приливают реактивы согласно следующей таблице:
Таблица 4.6 - Порядок выполнения работы
Номер пробирки |
Количество реагента, мл |
Краситель, капли |
||
Сукцинат |
Вода |
Малонат |
||
1 пробирка |
1 |
0,5 |
- |
2 |
2 пробирка |
1 |
0,5 |
- |
2 |
3 пробирка |
- |
1,5 |
- |
2 |
4 пробирка |
1 |
- |
0,5 |
2 |
Через 15 мин. наблюдают, исчезновение синей окраски только во второй пробирке.
Указания к оформлению лабораторной работы
Результаты работы оформляют в виде таблицы, в которой указывают фермент, кафактор, донор электронов (в ткани или опыте), акцептор электронов (в ткани или опыте), продукт реакции (окраска), вывод.