Гликопротеины - Хьюз Р. 1985
Строение
Строение О-гликанов
Антигены групп крови
Строго говоря, обозначение «группы крови» относится к антигенным различиям между эритроцитами разных индивидуумов, выявляемым с помощью специфических антител [2]. В начале этого столетия Карл Ландштейнер (Landsteiner) описал основные группы крови системы АBO(H). Это открытие вызвало большой интерес еще и потому, что появился источник естественно встречающихся антител, причина образования которых, впрочем, остается неизвестной и по сей день. Например, индивидуумы, имеющие на поверхности своих эритроцитов антиген группы крови А, в то же время содержат большое количество антител против детерминант В, и наоборот. Люди с группой крови О имеют антитела как против А-, так и против В-детерминант. Естественно, что открытие групп крови имело громадное значение для развития практики переливания крови. Совершенно очевидно, к каким катастрофическим последствиям приводят ошибки при определении группы крови. Интенсивные исследования структурных основ антигенности АВО(Н) были проведены Уолтером Морганом, Винифредом Уоткинсом, Элвиным Кдбатом (Morgan, Watkins, Kabat) и многими другими. Благодаря им мы теперь знаем, что свойства антигенов групп крови зависят от строения углеводов. Последнее в свою очередь полностью определяется генетическим контролем за их сборкой. Более того, сейчас стало очевидно, что гликопротеины разных тканей также обладают антигенными детерминантами, сходными с таковыми для антигенов эритроцитов. Поэтому биологические функции углеводных цепей, каковы бы они ни были, а также их строго генетический контроль у человека нельзя объяснить наличием этих цепей только лишь на поверхности эритроцитов.
Углевод, секретируемый индивидуумами О-генотипа, называется Н-антигеном. В качестве обязательного компонента он имеет остаток фукозы, присоединенный к С-2 остатка галактозы. Последний связан с С-3 или С-4 соседнего N-ацетилглюкозамина. Иногда остатка фукозы может и не быть, что обусловливает в свою очередь отсутствие антигенов А, В или Н на поверхности эритроцитов или у секретируемых гликопротеинов (рис. 2.16). Индивидуумы с этим редким отклонением были впервые обнаружены в Индии, и соответствующий фенотип поэтому был назван бомбейским (Bombay).
В результате присоединения остатков N-ацетилгалактозамина или галактозы (а1→3)-гликозидной связью Н-детерминанта может быть превращена либо в А-, либо в В-детерминанты соответственно.
Совершенно очевидно, что детерминанты А, В и Н находятся на концах О-гликанов секретируемых гликопротеинов. Но что же представляет собой последовательность коровой области этих O-гликанов? Как мы уже видели, существует большое их разнообразие. Например, в гликопротеинах секрета подчелюстной железы свиньи антигенные детерминанты присоединены непосредственно к остатку N-ацетилгалактозамина, который связан с полипептидом (рис. 2.14). Значительно более длинная последовательность, к которой присоединяются антигенные детерминанты, имеется в гликопротеинах толстых кишок крысы (рис. 2.15). Последовательность коровой области гликопротеинов секретов человека с А-, В- и Н-активностью еще полностью не установлена. Предполагаемая структура веществ, секретируемых кистой яичника, показана на рис. 2.16.
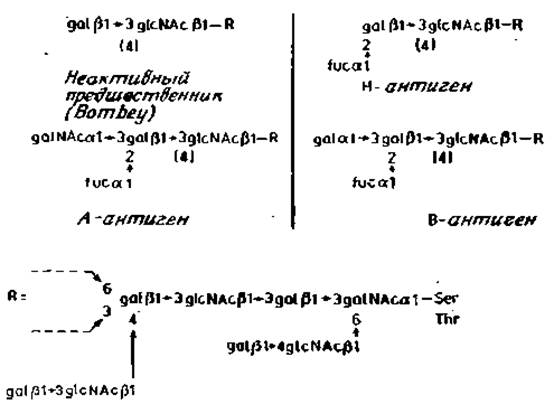
Рис. 2.16. Секретируемые гликопротеины человека с антигенными детерминантами системы ABO (Н).
Следует подчеркнуть, что рассматриваемые здесь углеводы относятся к секретируемым гликопротеинам. Естественно тогда спросить: что же представляют собой активные вещества групп крови, находящиеся в мембранах эритроцитов и впервые обнаруженные Ландштейнером (Landsteiner)? Хотя эта проблема еще до конца и не решена, есть основания полагать, что большинство углеводных цепей с антигенными свойствами вообще отсутствует в гликопротеинах и имеется лишь в гликолипидах [17]. Основная структура гликолипидов изображена на рис. 2.17; в этих соединениях найдены лишь цепи типа galß1→4gIcNAc. Наиболее простыми по строению гликолипидами с активностью групп крови являются вещества типа А—Г, однако найдены и более сложные структуры, например Д и Е.

Рис. 2,17. Гликолипиды мембраны эритроцитов человека, имеющие антигенную активность групп крови. Жирными стрелками обозначены связи, чувствительные К эндо-β-галактозидазе.
Для всех этих цепей отличительной чертой является наличие повторяющихся последовательностей N-ацетилглюкозаминил (ß1→3) галактоз а, соединенных (ß1→4)- связями. Антигенные детерминанты А, В и Н получаются в результате присоединения таких моносахаридов, как фукоза и N-ацетилгалактозамин или галактоза, к концевому остатку галактозы, присоединенной к повторяющейся последовательности (ß1→4)-связью. Если эти остатки отсутствуют, то выявляются антигены другой системы групп крови человека, обозначаемые как Ii-антигены. Как и в первоначальных работах Ландштейнера по группам крови человека АВО(Н), для определения Іі-антигенов используются антитела, встречающиеся в крови некоторых индивидуумов. Весьма вероятно, что специфические антитела к I- и і-детерминантам способны распознавать соответственно разветвленные (Е) и неразветвленные (Д) варианты углеводных цепей (рис. 2.17).
Накапливается все больше данных о том, что значительное количество антигенных детерминант групп крови имеется также и в гликопротеин ах мембран эритроцитов и других клеток. Эти детерминанты располагаются на длинных цепях подобно тем, которые имеются в сложных гликолипидах Д и Е. Они чувствительны к эндо-ß-галактозидазе из Е. freundii. Обработка этим ферментом эритроцитов приводит к полной потере антигенных детерминант ІІ, а гликопротеин, обозначаемый как белок «полосы 3» (разд. 2.6.2), превращается при этом в низкомолекулярный компонент с небольшим содержанием углеводов. Согласно другим данным, у этого же гликопротеина имеется лишь одна такая углеводная цепь [17]. Обсуждаемые длинные углеводные последовательности, называемые полигликозильными единицами и входящие в состав гликопротеинов «полосы 3» эритроцитов, являются также минорными компонентами мембранных гликопротеинов у некоторых других типов клеток, например фибробластов. Полигликозильные цепи гликопротеинов прикрепляются к коровой области N-гликанов, как показано на рис. 2.18. У полигликозильных цепей, обладающих 1-активностью, от основной повторяющейся последовательности отходят ответвления из нескольких остатков галактозы. Такие разветвленные полигликозильные цепи преобладают у зрелых эритроцитов, тогда как эритроциты плода содержат неразветвленные формы цепей, характерные для i-антигена. Очевидно, что ферменты, ответственные за возникновение разветвлений, появляются в ходе развития организма, однако пока непонятно, какое это может иметь значение для нормального созревания клеток эритроидного ряда.
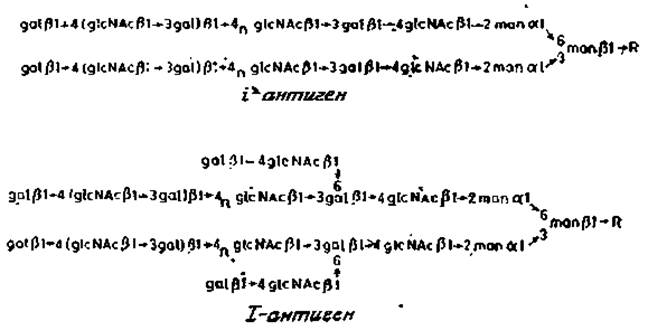
Рис. 2.18. Строение «полигликозил»-N-гликанов гликопротеинов. R — glcNAcß1→4glcNAc, Asn.