Гликопротеины - Хьюз Р. 1985
Строение
Мембранные гликопротеины. Общие представления
Мембраны эритроцитов
Поскольку гликопротеины или простые белки способны встраиваться в мембраны, то требуется объяснить, каким образом полипептид, состоящий из многих аминокислот с заряженными боковыми цепями, взаимодействует со структурой, построенной из липидов. Скорее всего белки используют тот же принцип, что и липиды, которые являются амфипатическими молекулами, содержащими полярную часто заряженную группу и гидрофобную хвостовую часть из жирной кислоты. Липиды располагаются в бислое мембраны таким образом, что полярные группы выходят наружу, а цепи жирных кислот направлены внутрь и образуют непроницаемый гидрофобный слой. В связанных с мембранами полипептидах, как, например, в гликофорине, имеются участки цепи с неполярными боковыми группами, которые проникают в саму мембрану. Согласно ряду данных, домен гликофорина А, богатый углеводами, расположен на наружной поверхности эритроцита, тогда как карбоксильный концевой участок цепи, содержащий большое количество кислых аминокислот, выходит в цитоплазму (рис. 2.20). Известно, что несколько других мембранных гликопротеинов имеют подобную организацию. Однако данные, полученные при изучении второго главного компонента мембран эритроцитов человека, заставляют относиться с осторожностью к предположению, что все гликопротеины располагаются в мембране согласно столь простой модели. Так называемый белок «полосы 3» участвует в транспорте анионов через мембраны эритроцитов человека. Полная аминокислотная последовательность этого белка еще не определена, но установлено, что его полипептидная цепь проходит через липидный бислой не один, а несколько раз (рис. 2,20). Аминоконцевой участок цепи проникает в цитоплазму, тогда как карбоксиконцевой участок, содержащий гликаны, выходит на наружную поверхность клетки. Но основной принцип, установленный ранее для гликофорина, прослеживается и в этом случае — определенные участки белка находятся вне гидрофобной внутренней части мембраны. Эти наружные участки полипептидной цепи, как полагают, способны взаимодействовать с другими белками. Имеются, например, веские доводы в пользу того, что глобулярный белок — анхирин избирательно связывается с аминоконцевой частью белка «полосы 3». В свою очередь анхирин, по-видимому, взаимодействует с фибриллярным белком цитоплазмы эритроцитов — спектрином. Сетка из спектрина выстилает изнутри эритроцитарную мембрану, что придает определенную жесткость всей структуре и поддерживает характерную двояковыпуклую конфигурацию эритроцита. Для сохранения такой формы клетки, вероятно, важно и присутствие актина на цитоплазматической стороне мембраны. Спектрин, вероятно, связывается с актином или его тетрамером в месте, удаленном от участка связывания анхирина. Сам актин, вероятно, прикреплен к мембране через еще один белок эритроцитов, так называемый белок «полосы 4.1». Последний обладает определенным сродством к полярным боковым группам фосфолипидов и поэтому может способствовать взаимодействию тетрамеров актина с внутренней стороной мембраны эритроцитов [21].
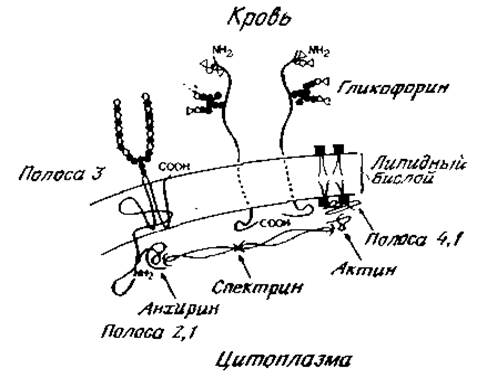

Изложенные данные помогают понять, каким образом относительно просто устроенная мембрана может стать при участии компонентов мышечного аппарата более жесткой, что необходимо для принятия клеткой необычной формы, требующей затраты энергии. Вполне очевидно, какое большое значение это имеет для сохранения определенной морфологии клетки И ее подвижности [22]. Некоторые из этих вопросов кратко рассматриваются в последней главе.