Гликопротеины - Хьюз Р. 1985
Биосинтез
Локализация процесса гликозилирования в клетке
До сих пор мы рассматривали свойства специфических гликозилтрансфераз, проявляемые in vitro. Однако биосинтез гликопротеинов — высокоупорядоченный внутриклеточный процесс. В связи с этим нам теперь необходимо рассмотреть протекающий во времени процесс появления вновь образующихся гликопротеинов в ходе их сборки и локализацию в клетке реакций гликозилирования. Гликопротеины являются составной частью большинства, а возможно, и всех мембранных систем внутри клетки, и наряду с этим большинство, но отнюдь не все секретируемые белки относятся к гликопротеинам. Однако, вероятно, углеводы не являются необходимым сигналом для секреции, так как некоторые белки, например проколлаген, продолжают секретироваться из таких клеток, в которых гликозилирование блокировано — либо вследствие генетической мутации метаболических путей, ответственных за гликозилирование, либо под действием различных ингибиторов гликозилирования белков. Самый широко используемый ингибитор такого рода — туникамицин, который препятствует синтезу долихолдифосфат-N-ацетилглюкозамина на первом этапе сборки N-гликанов. Однако недавние исследования, обсуждающиеся в гл. 4, действительно указывают на то, что предотвращение гликозилирования белка часто вызывает появление гликопротеинов в необычных местах внутри клетки или же ведет к секреции гликопротеинов, которые при нормальных условиях остались бы внутри клеток. Упорядоченность событий в процессе гликозилирования приводит к правильному току гликопротеинов от места синтеза полипептидной цепи к их собственно терминальной стадии синтеза. Следовательно, важно знать, где в клетке осуществляется гликозилирование белка.
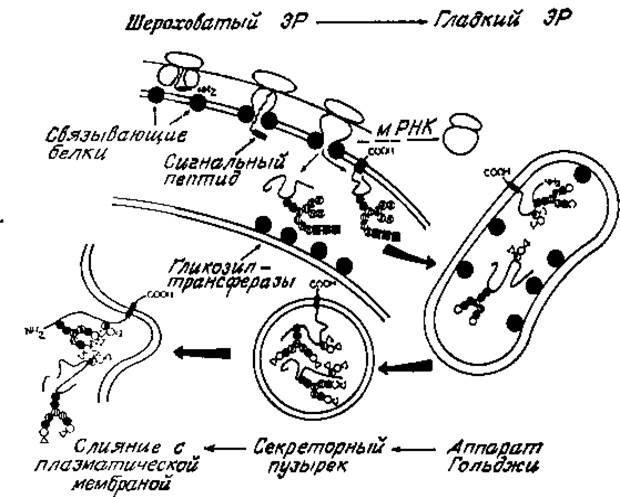
Вряд ли существуют сомнения в том, что полипептидная часть гликопротеинов образуется рибосомами, связанными с мембранной системой эндоплазматического ретикулума («шероховатым» эндоплазматическим ретикулумом). Если к клеткам, участвующим в биосинтезе гликопротеинов, добавить радиоактивные моносахариды, то с помощью радиоавтографии срезов клетки или фракционирования субклеточных фракций можно легко показать, что присоединение N-ацетилглюкозамина и маннозы к полипептиду происходит в шероховатом эндоплазматическом ретикулуме. Пионером этих исследований является Клод Леблонд (Leblond) из Университета МакГилла. Подобными же методами было показано, что фукоза, галактоза и N-ацетилманнозамин — непосредственный и специфический маркер для сиаловых кислот — присоединяются в основном в гладких мембранах, особенно в мембранах аппарата Гольджи. Эти наблюдения могут быть подтверждены прямыми определениями специфических гликозилтрансфераз в субклеточных фракциях, выделенных из разрушенных клеток. Например, в мембранах аппарата Гольджи обнаруживаются трансферазы, ответственные за сборку трисахаридов, содержащих сиаловую кислоту, галактозу и N-ацетилглюкозамин в N-гликанах, а также и за фукозилирование. Недавно было показано, что с помощью окрашенных специфических антител к галактозилтрансферазе в препарате целых клеток можно выявить плотный «колпачок», который представляет собой, очевидно, часть комплекса Гольджи [45]. В отличие от этого гликозилтрансферазы, стимулируемые долихолом, локализованы в шероховатом эндоплазматическом ретикулуме. Биосинтез гликопротеинов с учетом всех этих данных схематически показан на рис. 3.14.
Согласно модели, предложенной Блобелом и Добберштейном (Blobel, Dobberstein) [46], образующиеся полипептиды имеют сигнальную пептидную последовательность, обеспечивающую фиксацию рибосом на мембранах эндоплазматического ретикулума. Эта ассоциация стабилизирована специфическими мембранными белками эндоплазматического ретикулума, обладающими сродством к определенным участкам рибосом. Трансляция мРНК продолжается с векторной разгрузкой образующегося полипептида во внутреннее пространство цистерны шероховатого эндоплазматического ретикулума. На раннем этапе сигнальный пептид отщепляется в результате специфического протеолиза, после чего начинается свертывание полипептидной цепи и обнажается участок полипептида, доступный для гликозилирования. Гликозилирование происходит с использованием промежуточных соединений долихола и заключается в переносе олигосахарида (glc)3(mаn) 9(glcNAc)2 на обнаженные остатки аспарагина пептидной цепи. Трансфераза, переносящая олигосахарид, тесно связана с мембраной [47]. Растворимые гликопротеины пoлнocтью высвобождаются во внутреннее пространство цистерны после окончания трансляции мРНК, тогда как будущие мембранные гликопротеины остаются интегрированными в мембранах эндоплазматического ретикулума. Связь с ними осуществляется с помощью гидрофобного пептидного участка, как и в случае с гликофорином.
![]()
Следующая стадия в процессе биосинтеза гликопротеина заключается в превращении шероховатого эндоплазматического ретикулума в свободные от рибосом гладкие мембраны путем диссоциации от эндоплазматического ретикулума или же латеральной миграции гликозилированных белков в область эндоплазматического ретикулума, где имеется недостаток мембранных рибосомосвязывающих белков. Транспорт вновь синтезированных гликопротеинов в аппарат Гольджи, по-видимому, обеспечивается образованием пузырьков, покрытых (окаймленных) со стороны цитоплазмы белком клатрином [48]. Ранее предполагалось, что эти окаймленные пузырьки участвуют в осуществляемом путем эндоцитоза проникновении в клетку внеклеточного материала. Теперь становится очевиднее их роль во внутриклеточном транспорте. Мембраны аппарата Гольджи в свою очередь образуют различные везикулярные компартменты, включая лизосомы и секреторные пузырьки. Дальнейшее формирование N-гликанов осуществляется на этой стадии, так как гликозилтрансферазы, ответственные за дальнейшую сборку и терминацию N-гликанов, локализованы в мембранах аппарата Гольджи. Гликозидазы, осуществляющие процессинг (глюкозидазы, маннозидазы), выделяются вместе с фракцией гладких мембран. Имеют место и другие события, такие, как фосфорилирование N-гликанов, что, по-видимому, имеет чрезвычайно важное значение для непосредственного прохождения гликопротеинов во внутрь лизосом (разд. 4.3.2). Пузырьки, происходящие из аппарата Гольджи, опять покрываются клатрином, что необходимо для участия в экзоцитозе гликопротеинов. Затем они сливаются с плазматической мембраной, и продукты биосинтеза либо секретируются, либо остаются в качестве интегральных компонентов поверхности мембраны. Отметим, что топология слияния приводит к асимметрии плазматической мембраны, наблюдаемой в эксперименте. Таким образом, гликозилированные участки пептидов, которые существуют внутри цистерн эндоплазматического ретикулума, появляются после слияния на наружной поверхности клетки.
Эта простая схема очень сложных процессов не может, конечно, пролить свет на такие специальные проблемы, как биосинтез гликопротеина полосы 3. Одна из возможностей состоит в следующем: сигнальный пептид некоторых вновь образованных полипептидов остается постоянно включенным в мембрану эндоплазматического ретикулума. Полипептид, находящийся на стадии элонгации, может продергиваться через мембрану эндоплазматического ретикулума несколько раз в процессе элонгации и в конечном итоге становится гликозилированным по С-концевым участкам.
Образование О-гликанов, по-видимому, является относительно поздним событием в биосинтезе [49]. Присоединение моносахаридов, непосредственно примыкающих к полипептиду, и сиаловых кислот, а также превращения N-ацетилнейраминовой кислоты в ходе реакций гидроксилирования и ацетилирования — все это реакции, ассоциированные с мембранами гладкого эндоплазматического ретикулума или мембранами аппарата Гольджи. Различная субклеточная локализация сборки N-гликанов коровой области и реакций терминации биосинтеза N-гликанов, с одной стороны, и сборки О-гликанов — с другой, позволяет объяснить существование разных механизмов их сборки. Такая тесная ассоциация новообразующегося полипептида с мембранами эндоплазматического ретикулума сопряжена, очевидно, с обязательным участием связанных с липидами промежуточных продуктов, в то время как более поздние события биосинтеза, в которых участвуют уже зрелые гликопротеины, осуществляются более простыми способами.