Гликопротеины - Хьюз Р. 1985
Биосинтез
Контроль за биосинтезом гликана
Генетический контроль
Генетический контроль биосинтеза гликопротеинов оказывается возможным в силу двух обстоятельств. Во-первых, он может осуществляться при трансляции генов хорошо известным матричным механизмом, приводящим к образованию полипептидов, имеющих подходящую аминокислотную последовательность (а возможно, и конформацию) вокруг определенных аминокислотных остатков, узнаваемых при гликозилировании. Во-вторых, ему способствует наличие в клетке сложных ферментных систем, обусловливающих как синтез активированных сахаров, предназначенных для переноса таких сахаров на акцепторы, так и процессинг.
Как мы уже видели, для сборки гликанов требуется наличие мультиферментных комплексов: в процессе построения олигосахаридной последовательности продукт реакции становится субстратом для отдельного фермента или нескольких ферментов, действующих конкурентно. Это метаболическое взаимодействие ферментных систем приводит к разнообразию углеводных структур в гликопротеинах. Конечно, эти ферменты сами по себе являются прямыми продуктами генов, и само собой разумеется, что их синтез служит одной из форм генетического контроля. Прямое доказательство такого контроля можно получить в опытах с мутантными линиями клеток, которые будут описаны позже. Однако основные принципы лучше всего проиллюстрировать, рассмотрев генетический контроль биосинтеза (рис. 3.16) основного комплекса антигенов специфичности группы крови АВО(Н) [53].
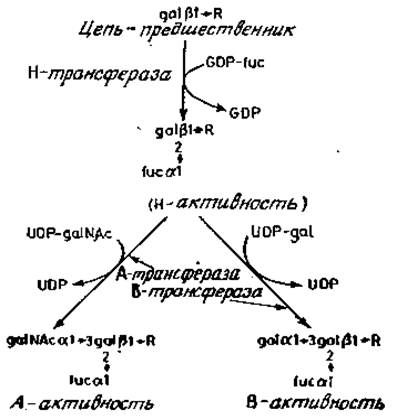
Рис. 3.16. Биохимические пута сборки А-, В- и Н-структур. R — 3 (или 4) glcNAc, связанный с олигосахаридами различных структур, которые, насколько известно, не входят в состав антигенных группоспецифических детерминант системы АВО(Н).
А- и В-детерминанты, уникальные тетрасахаридные структуры которых обнаруживаются с помощью антител и которые могут быть присоединены к различного типа носителям, синтезируются, конечно, специфическими гликозилтрансферазами. Присутствие последних в клетке определяется генотипом данной особи. Необходимая предварительная стадия в сборке А- и В-детерминант заключается в присоединении остатка фукозы к предпоследнему остатку галактозы в предшественнике. Этот фермент присутствует у всех индивидуумов, за редким исключением носителей генотипа Bombay, который уже обсуждался выше. Этот антиген образуется присоединением фукозы и определяется серологически как Н-детерминанта. Он является продуктом фермента, детерминируемого геном Н. Редкий ген h у индивидуумов группы Bombay либо вовсе не кодирует активного фермента, либо активность фермента настолько мала, что последующая модификация олигосахарида эффективно блокируется в условиях нормального биосинтеза. Продукт, образованный благодаря активности Н-трансферазы, затем распознается ферментами, кодируемыми генами А и В. Трансферази, контролируемая геном А, — это UDP-N- ацетилгалактозамин: O-a-L-фукозил-(1→2)-D-галактоза — а-3-N-ацетилгалактозаминилтрансфераза. Индивидуумы с генотипом А образуют данную трансферазу, и, следовательно, у них происходит и синтез сложных углеводных последовательностей, оканчивающихся такими последовательностями. Индивидуумы с генотипом В в отличие от этого образуют фермент UDP-галактозат-О-а- L-фукозил-(1→2)-D-гaлактоза — a-3-галактозилтрансфераза, кодируемый геном В. Индивидуумы группы Bombay несут функционирующие гены А и В, образующие активные А- или В-ферменты, но не способны образовывать А- и В-антигены, так как необходимая первая стадия у них отсутствует из-за того, что у них неактивен либо сам ген Я, либо продукт этого гена. Индивидуумы, несущие как А-, так и В-гены, образуют А- и В-трансферазы и синтезируют углеводные цепи, оканчивающиеся последовательностями, распознаваемыми как А- и В-детерминанты (рис. 3.16).
Судя по всему, гены А и В являются аллельными генами. Это весьма необычно, так как они кодируют ферменты с качественно, различной специфичностью, тогда как обычно продукты аллельных генов различается по своему биохимическому действию только количественно. Предполагается, что третий аллельный ген АВО-систем — молчащий в том смысле, что он не вызывает различий в действии гликозилтрансфераз, действующих на продукт гена Я. У людей с группой крови О Н-активная структура далее не модифицируется в серологически распознаваемую форму.