Гликопротеины - Хьюз Р. 1985
Функции
Лектины: белки, связывающие углеводы
Клетки, резистентные к лектину
Относительно нетрудно выделить клетки, не чувствительные к цитотоксическому действию лектинов, например рицину, из мутировавших или немутировавших клеточных популяций. Резистентные клеточные линии, которые очень стабильны, подразделяются на две основные группы: клетки, неспособные связывать лектин своей поверхностью, и клетки, неспособные пропустить внутрь токсин, уже связанный на поверхности. Клетки первой группы мутантов особенно удобны для изучения функций углеводов клеточной поверхности [59].
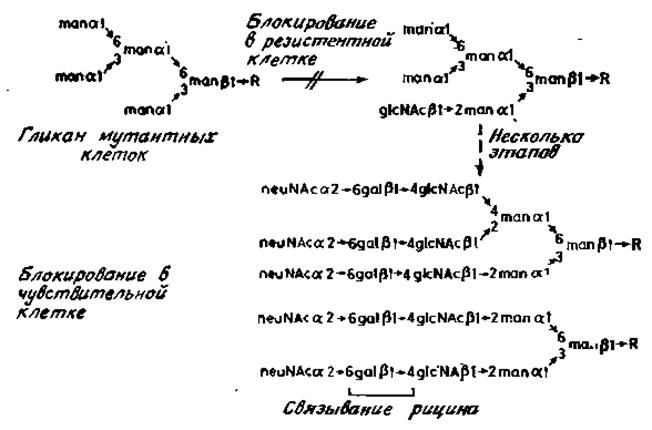
Рис. 4.5. Блокирование ферментов в клетках, резистентных к рицину. R — glcNAcß1→4gLcNAc.Asn.
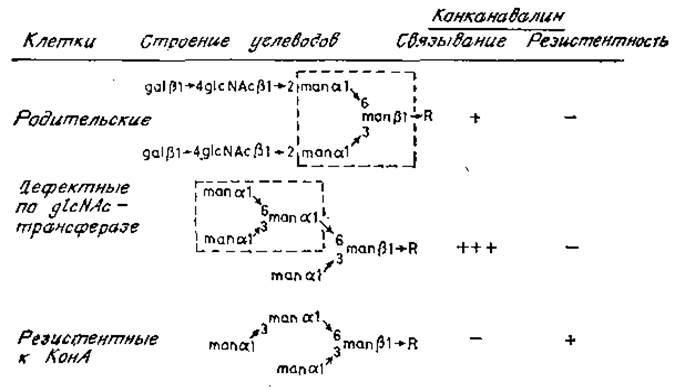
Рис. 4.6, Строение углеводов у клеток, резистентных к конканавалину А. Пунктиром обведены звенья, связывающиеся с конкававалином A. R — glcNAcß1→4glcNAc.Asn.
Обычно у мутантных клеток, резистентных к рицину, отсутствует фермент N-ацетилглюкозаминилтрансфераза I (гл. 3). Экстракты таких клеток не способны переносить N-ацетилглюкозамин от UDP-N-ацетилглюкозамина к соответствующему акцептору, например к гликопептиду V овальбумина. Поэтому в таких клетках уже на ранней стадии блокируется сборка N-гликана и образуются углеводные цепи, лишенные участков, содержащих галактозу, что необходимо для связывания рицина поверхностью клетки (рис. 4.5). Однако углеводные цепи мутантных клеток служат прекрасными рецепторами для конканавалина А, и поэтому такие клетки более чувствительны к слабому цитотоксическому действию этого лектина.
У клеток, резистентных к конканавалину А, обнаружено необычное нарушение процесса сборки N-гликанов (рис. 4.6). Из мутантов, дефектных по glcNAc-трансферазе I, можно отобрать двойные мутанты, резистентные к конканавалину А. Такие двойные мутанты плохо связывают конканавалин А, так как у них произошла потеря одного остатка a-маннозы (рис. 4.6), необходимого для связывания (рис. 4.1). Возможно, этот дефект объясняется недостаточностью a1→6-маннозилтрансферазы, участвующей в сборке олигосахарид-липидного промежуточного продукта. В результате происходит накопление углевода (man)7, который гликозилируется, переносится на белок и в отсутствие glcNAc-трансферазы I превращается в углевод, показанный на рис. 4.6 [60]. Другой тип мутации, обусловливающий резистентность к конканавалину А, уже упоминался. Сниженная способность к связыванию этого лектина характерна и для клеток, не способных к образованию долихилманнозилофосфата [27, 61]. Очевидно, что у гликопротеинов таких мутантов меньше олигоманнозидных цепей, способных эффективно реагировать с конканавалином А.