Гликопротеины - Хьюз Р. 1985
Функции
Внутриклеточный транспорт гликопротеинов
Цикл лизосомных ферментов
Данные, непосредственно свидетельствующие о важной роли нормального процесса гликозилирования, были получены за последние пять лет при изучении внутриклеточного цикла группы гидролаз, присутствующих в лизосомах. В ходе этих исследований была обнаружена особая система, имеющая общее значение, и, кроме того, вскрывающая биохимический дефект, лежащий в основе одного патологического состояния у человека.
Это редкое заболевание называется I-клеточной болезнью. (Не следует путать с Іі-антигенами; это не очень удачная номенклатура, но она широко используется в литературе и ее не так просто изменить.) Лица, страдающие I-клеточной болезнью, погибают в раннем возрасте, причем у них обнаруживаются в клетках большие скопления высокомолекулярных гликоконъюгатов. Основная причина этой болезни — нарушение нормального содержания внутриклеточных лисозомных гидролаз, обусловливающих расщепление поглощенных компонентов соединительной ткани. Аналогичный дефект наблюдается при культивировании клеток (например, фибробластов кожи), взятых у таких больных: культивируемые клетки секретируют в среду аномально большое количество лизосомных гидролаз. Иными словами, эти клетки секретируют гидролазы, которые в нормальных условиях находятся внутри лизосомных пузырьков и разрушают поглощенные макромолекулы и остатки клеток [64]. На поверхности нормальных и 1-клеток имеется рецептор, распознающий определенные структурные признаки лизосомных гидролаз и вызывающий адсорбционный эндоцитоз этих ферментов, І-клетки способны опосредовать поглощение гидролаз из нормальных клеток, но не могут распознать ферменты, образованные и секретируемые ими самими. Более того, нормальные клетки также не могут распознать гидролазы, синтезированные 1-клетками; очевидно, поэтому, что наблюдаемый дефект связан со строением самих гидролаз 1-клеток, а не с блокированием адсорбционного эндоцитоза или рецепторной функции клеток. Впервые важная роль углеводного компонента лизосомных гидролаз была установлена, когда обнаружилось, что 1) маннозо-6-фосфат конкурентно подавляет поглощение нормальных гидролаз нормальными фибробластами, 2) у различных лизосомных ферментов имеются фосфорилированные N-гликаны и 3) обработка фосфатазами приводит к тому, что поглощение гидролаз снижается. У ферментов, секретируемых 1-клетками, такой углеводный компонент отсутствует, и они не связываются поверхностью ни нормальных, ни клеток и не поглощаются имя. Рецептор маннозо-6-фосфата имеется в небольшом количестве на клеточной поверхности, и именно здесь он был впервые обнаружен. Однако по крайней мере 90% всех рецепторов находятся в эндоплазматическом ретикулуме, мембранах аппарата Гольджи и лизосомах. Это свидетельствует о том, что рецепторы, по-видимому, участвуют прежде всего в транспорте новообразованных гидролаз из шероховатого ретикулума в гладкие мембраны и в конечном счете в лизосомы (рис. 4,7).
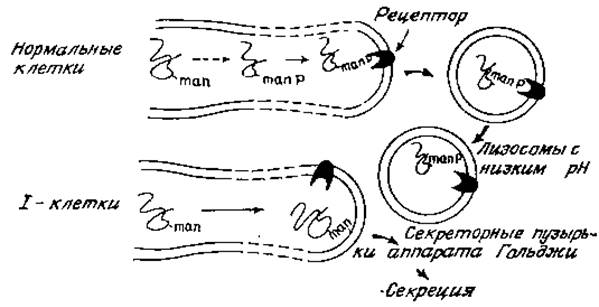
Рис. 4 7. Схема внутриклеточного транспорта лизосомных гидролаз и дефекта, имеющегося в I-клетках.
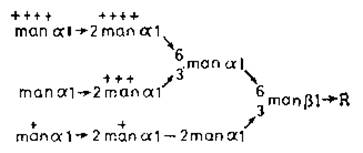
Рис. 4.8. Фосфорилированные N-гликаны лизосомных ферментов 165]. Степень фосфорилирования отдельных остатков маннозы обозначена крестиками.
Можно предположить следующую последовательность событий. Вслед за гликозилированием новообразованных полипептидов олигоманнозидными промежуточными продуктами происходит фосфорилирование определенных остатков маннозы. Этот процесс не случайный, поскольку некоторые из остатков маннозы фосфорилируются предпочтительнее (рис. 4.8,+++), а другие вообще не фосфорилируются. Во многих случаях у одного N-гликана могут быть две фосфорилированные маннозы, а данный определенный фермент (например, ß-глюкуропидаза) может иметь целый набор разновидностей гликанов. Причины такой гетерогенности до сих пор не установлены {65]. Маннозо-6-фосфатные звенья узнаются специфическими рецепторами, локализованными на стороне цистерн тех участков элементов эндоплазматического ретикулума и аппарата Гольджи, которые в конце концов отпочковываются в первичные лизосомы, содержащие полный набор гидролитических ферментов па внутренней стороне лизосомной мембраны. Для лизосом характерны низкие значения pH, что, вероятно, обусловлено очень большой концентрацией гликопротеинов, содержащих сиаловую кислоту и обращенных внутрь пузырьков. Вследствие такого pH ослабляется связь между маннозо-6-фосфатными группами и специфическими рецепторами, и гидролазы оказываются более или менее свободно распределенными в лизосомной жидкости. Гликаны этой стадии дефосфорилируются для удаления сигнала узнавания [66]. Макромолекулы и клеточные остатки, попадающие в клетки в результате адсорбционного эндоцитоза в виде эндоцитотических пузырьков, сливаются затем с первичными лизосомами и быстро разрушаются под действием всего набора лизосомных ферментов (при оптимальном для них значении pH 4,5). В 1-клетках фосфорилирование N-гликанов, по-видимому, блокировано. Поэтому сигналы узнавания отсутствуют, и лизосомные ферменты попадают в секреторные пузырьки, а не в участки эндоплазматического ретикулума и аппарата Гольджи, предназначенные для образования лизосом.
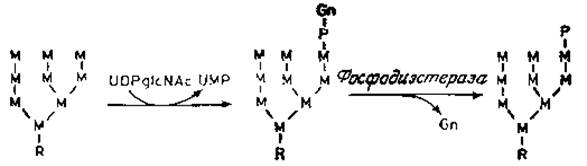
Рис. 4.9. Промежуточные продукты биосинтеза лизосомной ß-глюкоронидазы. R — коровая область N-гликанов. Показана только одна фосфорилированиая форма. Другие формы показаны на рис. 4.8.
Эксперименты, проведенные в последнее время, заставили, однако, видоизменить эту простую схему [67, 68]. Фосфорилирование остатков маннозы лизосомных гидролаз не происходит непосредственно путем переноса фосфатных групп с АТР, например под действием киназ. Вероятно, после частичного процессинга и переноса обычного полисахарида, содержащего глюкозу и маннозу, с липидного предшественника на белок (рис. 4.9) происходит перенос a-N-ацетилглюкозамин-1-фосфата от UDP-N-ацетилглюкозамина на С-6 остатка маннозы. Поскольку эта реакция является высокоизбирательной и происходит только с лизосомными ферментами, она скорее всего осуществляется лишь на поздней стадии дифференцировки эндоплазматического ретикулума и образования предшественника лизосом. Кроме того, может быть, что только ферменты лизосом имеют в «участке узнавания» некий домен (часть полипептидной цепи), который исключает другие гликопротеины, имеющие гликаны с высоким содержанием маннозы. Возможно также, что соответствующая специфическая трансфераза локализована вблизи от рецепторов маннозо-6-фосфата в специализированных участках эндоплазматического ретикулума па той стороне, где находятся цистерны. На следующем этапе ферментативного процесса под действием высокоспецифической а-N-ацетилглюкозаминил — фосфодиэстеразы образуется маннозо-6-фосфатный «сигнал», под действием которого высвобождается свободный N-ацетилглюкозамин и запускается связывание лизосомных ферментов с рецепторами. Оба описанных выше фермента преимущественно обнаруживаются в очищенном препарате гладких мембран аппарата Гольджи, что хорошо укладывается в основную гипотезу. В полном соответствии с данными о том, что биохимический дефект в 1-клетках заключается в неспособности образовывать фосфорилированную форму лизосомных ферментов, специфическая реакция переноса N-ацетилглюкозамин-1-фосфата в этих клетках полностью отсутствует. Ферменты, содержащие остатки маннозо-6-фосфата, широко распространены, как это можно было предвидеть, исходя из того, что лизосомы — характерный компонент клеток.