Гликопротеины - Хьюз Р. 1985
Строение
Строение N-гликанов
Овальбумин
В течение длительного времени этот главный гликопротеин белка куриного яйца служил излюбленным объектом при структурных исследованиях. Его удается выделить в чистом кристаллическом виде, т. е. в виде препарата, состоящего лишь из одного определенного полипептида с одним остатком аспарагина, который расположен в определенном положении в цепи. Именно к нему и прикрепляется углеводный компонент. Проведенное сравнительно недавно определение полной последовательности углеводной цепи овальбумина оказало значительное влияние на современные представления о биосинтетической сборке N-гликанов вообще.
Анализ строения углеводного компонента овальбумина проводился по схеме, охарактеризованной выше (табл. 2.2). Гликопептидную фракцию можно выделить методом гель-фильтрации из гидролизата, полученного после исчерпывающего протеолиза овальбумина неспецифической протеазой — проназой. Аминокислоты и небольшие пептиды, образующиеся в результате протеолиза проназой, хорошо отделяются от аспарагин-углеводного комплекса, Который имеет большую молекулярную массу. Можно было бы ожидать, что углеродсодержащий фрагмент, получаемый с помощью проназы, будет однородным веществом или же по крайней мере относительно простой смесью, так как овальбумин содержит уникальный полипептид, к которому присоединена только одна углеводная цепь. Однако на деле это оказалось не так: гликопептидную фракцию можно разделить по крайней мере на шесть компонентов (I—VI) с помощью ионообменной хроматографии [9]. Столь важное наблюдение навело на мысль, что углеводный компонент, прикрепленный к определенному остатку аминокислоты, может обладать структурной гетерогенностью. Вначале это показалось удивительным, и были затрачены значительные усилия, чтобы исключить ряд возможных обычных причин подобной гетерогенности: 1) сходная гетерогенность была обнаружена у овальбумина, выделенного из яиц одной и той же курицы; 2) все генетические варианты кур обладали одним и тем же набором гликопептидов; 3) относительный состав гликопептидов не зависел от возраста яйца; 4) поскольку белок куриного яйца обладает гликозидазной активностью, обусловленной присутствием а-маннозидаз и ß-N-ацетилглюкозаминидаз, то были изучены альбумины яиц тех птиц (например, индейки), у которых гликозидная активность яичного белка либо совсем отсутствует, либо находится на незначительном уровне. Оказалось, что в этом случае обнаруживается несколько гликопептидных фракций. Следовательно, их наличие не может быть артефактом, возникающим при расщеплении гликозидазами единой исходной углеводной цепи.
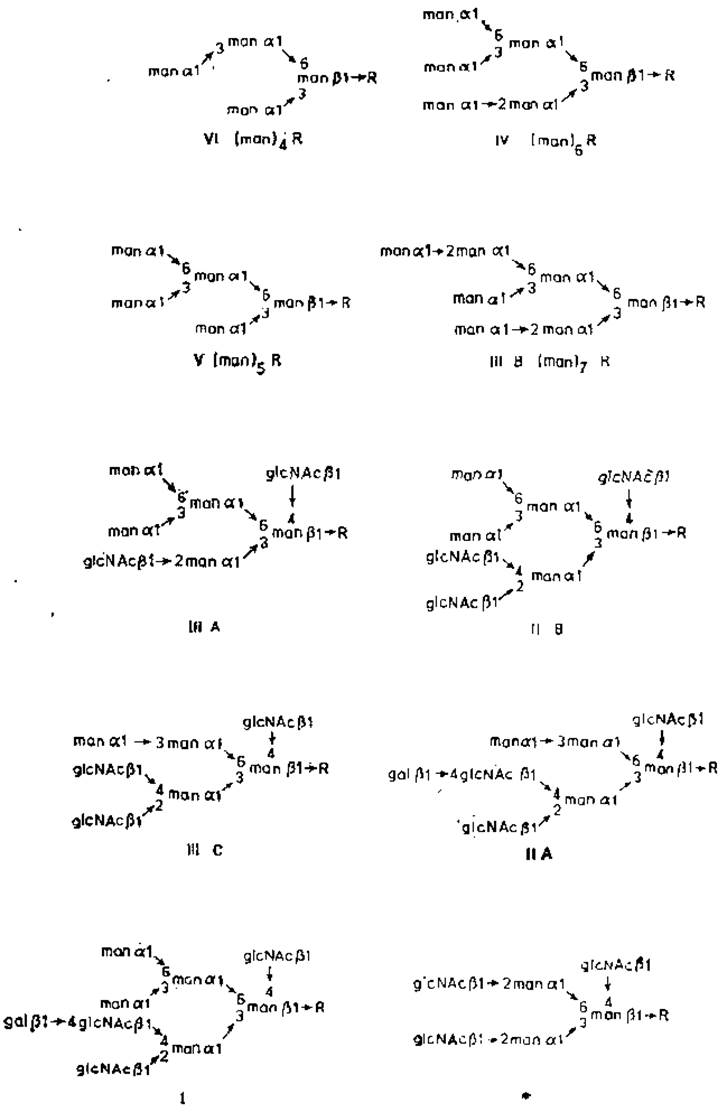
Рис. 2.6. Строение гликопептидов овальбумина. R — glcNAcß1→4glcNAc.Asn. Звездочкой обозначен минорный компонент фракции V, выделенный методом электрофореза [10].
Все шесть выделенных гликопептидных фракций содержат лишь одну аминокислоту — аспарагин. Очень сходен и их моносахаридный состав: всегда обнаруживаются манноза и N-ацетилглюкозамин в качестве основных (фракции I и II) или единственных (фракции III, IV, V и VI) компонентов. Фракции II—IV можно разделить на две или три подфракции [10]. Полная структура каждого из основных гликопептидов овальбумина была выяснена сочетанием физических, химических и ферментативных методов (рис. 2.6). Весьма удивительно, что у всех гликопептидов имеется общий участок («ядро», коровая область), связанный с аспарагином. Гликопептиды VI, V, IV и IIIB образуют группу очень сходных олигоманнозидных, или маннозообогащенных структур, содержащих от 1 до 7 остатков маннозы, а также связанную с аспарагином хитобиозу (N-ацетилглюкозаминил ß1→N-ацетилглюкозамин). В каждом случае к гидроксильным группам при С-3 и С-5 остатка маннозы, присоединенного ß-гликозидной связью к хитобиозе, в свою очередь присоединяется два маннозильных остатка а-гликозидной связью. Дальнейшее удлинение углеводной цепи происходит путем присоединения других остатков маннозы к этим а-маннозильным звеньям. Присутствие концевых а-маннозильных остатков несложно обнаружить, обрабатывая гликопептиды а-маннозидазами и определяя затем количество освободившейся маннозы. После такой обработки гликопептидов V и IV освобождается точно 4 и 5 остатков в расчете на 1 моль, как это можно было предсказать, исходя из структуры, показанной на рис. 2.6. В каждом случае гидролиз останавливается, когда достигается остаток маннозы, присоединенный ß-гликозидной связью к N-ацетилглюкозамину. Во всех случаях остается один и тот же трисахарид, связанный с аспарагином и имеющий следующее строение: manß1→4glcNacßl→4glcNAc. В отличие от этого после обработки экзо-β-N-ацетилглюкозаминидазой нельзя обнаружить свободных остатков N-ацетилглюкозамина. Как уже говорилось ранее, экзогликозидазы могут действовать лишь на концевые невосстанавливающие остатки, и поэтому остатки N-ацетилглюкозамина, входящие в состав хитобиозной коровой области, не чувствительны к этим ферментам. Данные, полученные в опытах с экзогликозидазами, полностью соответствуют структуре других гликопептидов овальбумина. После обработки фракций I, II и III экзо-β-N-ацетилглюкозаминидазой можно обнаружить в виде свободных сахаров несколько остатков N-ацетнлглюкозамина, тогда как меньшая часть маннозильных остатков является чувствительной к a-маннозидазе, В таких гибридных цепях концевые остатки ß-N-ацетилглюкозамина занимают два основных положения: они присоединены или 1) (ß1→4) -связью к остатку маннозы коровой области, или же 2) (ß1→2)- или (ß1→2)- и (ß1→4)-связями к а-маннозильным остаткам, прилегающим к коровой области. В последнем случае некоторые из звеньев N-ацетилглюкозамина замещены в свою очередь галактозой и образуют N-ацетиллактозаминовую последовательность. Впервые дисахарид galß1→4gIcNAc был найден в молекуле орозомукоида (иначе называемого кислым а-гликопротеином).