ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 1. ОСНОВЫ БИОХИМИИ СТРОЕНИЕ И КАТАЛИЗ - 2011
ЧАСТЬ I. СТРОЕНИЕ И КАТАЛИЗ
2. ВОДА
2.2. Ионизация воды, слабые кислоты и слабые основания
Многие свойства воды в качестве растворителя можно объяснить, рассматривая Н2О как незаряженную молекулу. Однако иногда необходимо учитывать небольшую степень ионизации воды и наличие в воде ионов водорода Н+ и гидроксид- ионов ОН-. Ионизация воды как любая обратимая реакция характеризуется константой равно
весия. При растворении в воле слабых кислот они ионизуются и вносят в воду дополнительные ионы Н+; слабые основания присоединяют к себе Н+ и переходят в протонированную форму. Каждый из этих процессов характеризуется константой равновесия. Общая концентрация ионов водорода определяется экспериментально и выражается как pH раствора. Чтобы предсказать состояние ионизации того или иного вещества в растворе, необходимо учесть константы равновесия соответствующих реакций ионизации. Поэтому мы сейчас обратимся к рассмотрению вопроса об ионизации воды, а также растворенных в воде слабых кислот и оснований.
Чистая вода ионизована слабо
Молекулы воды имеют небольшую склонность к ионизации, т. е. к образованию ионов водорода (протона) и гидроксила в соответствии со следующим уравнением:
Н2О ⇄ Н+ + ОН (2-1)
Обычно мы представляем продукт диссоциации воды как Н+, однако следует иметь в виду, что свободных протонов в воде не существует. Ионы водорода в воде немедленно гидратируются, т. е. превращаются в ион гидроксония (гидрония) Н3О+. Благодаря наличию водородных связей между молекулами воды гидратация протонов происходит практически мгновенно:
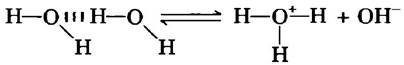
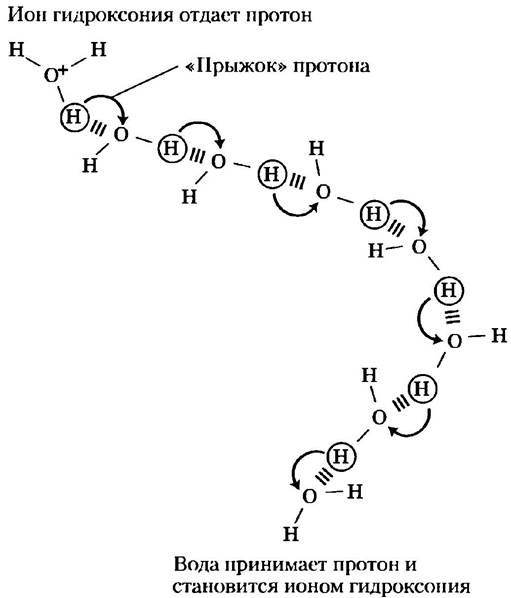
Степень ионизации воды можно определить по ее электрической проводимости. Чистая вода проводит электричество, поскольку Н3О+ движется к катоду, а ОН- — к аноду. Движение этих ионов в электрическом поле отличается исключительной быстротой по сравнению с такими ионами, как Na+, K+ или Сl-. Такую высокую подвижность можно объяснить, учитывая механизм передачи протона, изображенный на рис. 2-13. Дело в том, что не один конкретный протон передвигается в толще воды на дальние расстояния, а целая «армия» протонов переносит заряд между соседними, связанными водородными связями молекулами воды; суммарный эффект этого состоит в переносе протона на дальнее расстояние за удивительно короткое время. Благодаря столь высокой подвижности Н+ (а также ОН-, который перемещается так же быстро, только в противоположном направлении) кислотно-основные реакции в водных растворах обычно протекают с очень высокими скоростями. Кроме того, как отмечалось выше, такой механизм переноса протона играет, по всей видимости, очень важную роль в биологических процессах (рис. 2-10; см. также рис. 19-67).
Рис. 2-13. Механизм «протонных прыжков». Своеобразные «прыжки» протонов между соседними связанными водородной связью молекулами воды очень сильно увеличивают общую скорость переноса протона на достаточно большие расстояния. Как только ион гидроксония (наверху слева) отдает свой протон, практически сразу молекула воды, находящаяся от него на некотором расстоянии (внизу справа), принимает протон и сама становится ионом гидроксония. Скорость передачи протона в соответствии с таким механизмом оказывается намного выше скорости диффузии и объясняет удивительно высокую подвижность протона по сравнению с подвижностью других одновалентных катионов, таких как Nа+ или К+.
Поскольку обратимая ионизация воды имеет очень важное значение для понимания роли воды в функционировании клеток, необходимо знать способы количественного выражения степени ионизации. Рассмотрим кратко некоторые общие свойства обратимых химических реакций.
Равновесие любой химической реакции характеризуется константой равновесия Keq часто обозначаемой просто К. Константу равновесия химической реакции
А + В ⇄ С + D (2-2), можно выразить через концентрации реагирующих веществ (А и В) и продуктов реакции (С и D) в соответствии с уравнением:
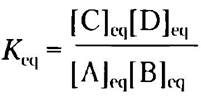
Строго говоря, в уравнении должны стоять активности (эффективные концентрации в неидеальных растворах) каждого вещества. Однако, за исключением отдельных, очень точных экспериментов, константу равновесия можно оценить, измеряя равновесные концентрации веществ. Константа равновесия — безразмерная величина, но следует помнить, что для ее определения в уравнение подставляют значения концентрации веществ, выраженные в молях.
Константа равновесия — это постоянная величина, которая служит количественной характеристикой любой химической реакции приданной температуре. Она позволяет вычислить состав равновесной смеси, независимо от количеств исходных веществ и образующихся продуктов. И наоборот, если известны концентрации всех исходных веществ и конечных продуктов в состоянии равновесия, то для реакции, протекающей при данной температуре, можно легко вычислить константу равновесия. Как мы показали в гл. 1, логарифм константы равновесия напрямую связан с изменением свободной энергии Гиббса ∆G°.
Ионизацию воды можно охарактеризовать величиной константы равновесия
Ионизация воды в соответствии с уравнением 2-1 протекает лишь в незначительной степени; в любой конкретный момент при 25 °С лишь две из 109 молекул воды находятся в ионизованном состоянии. Константу равновесия для обратимой реакции (2-1) можно записать как
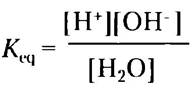 (2-3)
(2-3)
В чистой воде при 25 °С концентрация воды составляет 55,5 М (эту величину получают, разделив число граммов воды в 1 л на молекулярную массу воды: (1000 г/л)/(18,015 г/моль) = 55,5 М). Эту величину можно считать практически постоянной по сравнению с гораздо более низкими концентрациями и ОН-, составляющими 1 • 10-7 М. Таким образом, значение 55,5 М можно подставить в уравнение 2-3, в результате чего получаем:
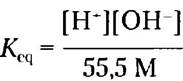
Или (55,5 М) Кeq = [Н+] [ОН-] = Kw (2-4)
где Кw представляет собой произведение 55,5 • Кeq и называется ионным произведением воды при 25 °С.
Численное значение Кeq, определенное по электропроводности чистой воды, при 25 °С равно 1,8 • 10-16. Подстановкой этой величины в уравнение 2-4 получаем численное значение ионного произведения воды:
Kw = [Н+] [ОН-] = (55,5 М) (1,8 • 10-16 М) = 1,0 • 1014 М2
Это означает, что произведение [Н+] [ОН-] в водном растворе при 25 °С всегда равно 1 • 1014 М2. Если концентрации ионов Н+ и ОН- в точности равны друг другу, что действительно так, например, в чистой воде, раствор называется нейтральным (имеет нейтральное значение pH). Можно рассчитать концентрации Н+ и ОН- в таких условиях, пользуясь значением ионного произведения воды:
Kw = [H+] [OH-] = [H+]2 = [OH-]2
Решая это уравнение относительно Н+, получаем
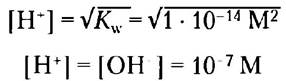
Так как ионное произведение воды является постоянной величиной, очевидно, что если концентрация ионов Н+ превышает 1 • 10-7 М, то концентрация ионов ОН должна быть меньше этой величины, и наоборот. Когда концентрация Н+ очень высокая, как, например, в соляной кислоте, концентрация ОН- должна быть очень низкой, поскольку их произведение — постоянная величина. Таким образом, используя численное значение ионного произведения воды, мы можем вычислить концентрацию Н+ если известна концентрация ОН-, и наоборот.
Пример 2-3. Расчет [Н+]
Какова концентрация ионов Н+ в 0,1 М растворе NаОН?
Решение. Запишем уравнение ионного произведения воды:
Кw = [Н+] [ОН-]
Решая это уравнение относительно [Н+], получаем для [ОН-] = 0,1 М
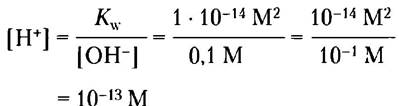
Пример 2-4. Расчет [ОН-]
Какова концентрация ОН- в растворе, содержащем 1,3 • 104 М Н+?
Решение. Запишем уравнение ионного произведения воды:
Kw = [Н+] [ОН-]
Решая это уравнение относительно [ОН-], получаем для [Н+] = 1,3 • 10-4
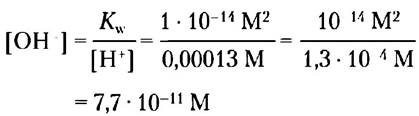
При решении этих или любых других уравнений округляйте результат до необходимого числа значащих цифр, как показано здесь.
Шкала pH: обозначения концентраций ионов Н+ и OН-
Шкала pH составлена на основе ионного произведения воды Кw (табл. 2-6). Она представляет собой удобный способ обозначения концентраций Н+, а, следовательно, и ионов ОН-, в любом водном растворе в интервале между 1,0 М Н+ и 1,0 М ОН-. Что же такое pH?
Таблица 2-6. Шкала рН
[Н+] (М) |
pH |
[ОН-] (М) |
рОН* |
10°(1) |
0 |
10-14 |
14 |
10-1 |
1 |
10-13 |
13 |
10-2 |
2 |
10-12 |
12 |
10-3 |
3 |
10-11 |
11 |
10-4 |
4 |
10-10 |
10 |
10-5 |
5 |
10-9 |
9 |
10-6 |
6 |
10-8 |
8 |
10-7 |
7 |
10-7 |
7 |
10-8 |
8 |
10-6 |
6 |
10-9 |
9 |
10-5 |
5 |
10-10 |
10 |
10-4 |
4 |
10-11 |
11 |
10-3 |
3 |
10-12 |
12 |
10-2 |
2 |
10-13 |
13 |
10-1 |
1 |
10-14 |
14 |
100(1) |
0 |
* Иногда используется такая форма выражения основности (концентрации ОН-) раствора, как рОН; по определению рОН = - lg[ОН-]. Заметьте, что всегда pH + рОН = 14.
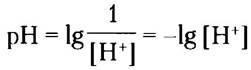
где символ «р» означает отрицательный логарифм. Можно рассчитать pH нейтрального раствора при 25 °С, в котором концентрация ионов Н+ равна 1 • 10-7:
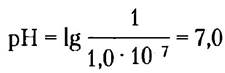
Обратите внимание на то, что концентрация протонов должна быть выражена в молях (М).
В случае нейтрального раствора pH = 7, и это не произвольно выбранная величина, а результат, полученный из ионного произведения воды при 25 °С, причем целое число получено расчетным путем. Растворы с pH >7 — щелочные, поскольку в них концентрация ОН" больше концентрации Н+, растворы с pH <7 — кислые.
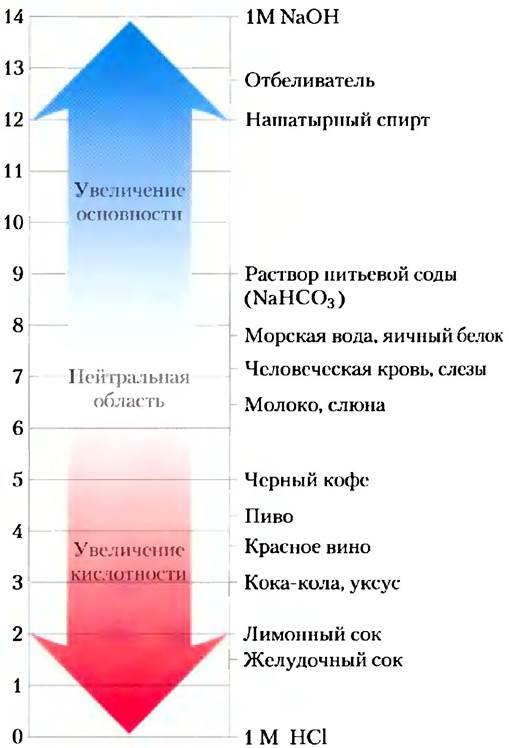
Важно понимать, что шкала pH — логарифмическая. Если говорят, что величины pH каких- то двух растворов различаются на единицу, то это означает, что концентрация Н+ в одном из них в 10 раз выше, чем в другом, хотя мы можем и не знать абсолютных значений pH этих растворов. На рис. 2-14 приведены значения pH для некоторых жидкостей. Заметьте, что концентрация ионов Н+ в кока-коле (pH 3,0) или красном вине (pH 3,7) примерно в 10 000 раз выше, чем в крови (pH 7,4).
Рис. 2-14. pH (левая шкала) некоторых жидкостей.
Для приблизительной оценки pH водного раствора можно использовать различные красители (индикаторы), например, лакмус, фенолфталеин или феноловый красный, которые изменяют цвет при диссоциации протона из молекулы красителя. Точное определение pH в химической или клинической лаборатории осуществляют с помощью стеклянных электродов, которые обладают селективностью по отношению к ионам Н+, но не реагируют на присутствие ионов Na+, К+ и других катионов. В приборе рН-метре сигнал от стеклянного электрода, опускаемого в измеряемый раствор, усиливается и сравнивается с сигналом, генерируемым раствором с точно известным значением pH.
■ Измерение pH является одной из наиболее важных и часто используемых в биохимии процедур, поскольку от pH зависит структура и действие многих биологических макромолекул, в частности каталитическая активность ферментов (рис. 2-21). Измерения pH крови и мочи — эго рутинные процедуры, постоянно используемые в медицинской диагностике. Например, у людей, страдающих тяжелой формой диабета, значение pH крови часто снижено по сравнению с нормальным значением 7,4. Такое состояние носит название ацидоза (ниже оно описано более детально). При некоторых других заболеваниях pH крови может быть выше нормы; такое состояние называется алкалозом. Случаи сильного ацидоза или алкалоза могут быть опасны для жизни. ■
Слабые кислоты и основания характеризуются константами диссоциации
Молекулы соляной, серной и азотной кислот, называемых обычно сильными кислотами, полностью ионизованы в разбавленных водных раствоpax. Аналогичным образом, сильные основания NaOH и КОН также полностью ионизованы. Однако для биохимии более важное значение имеют слабые кислоты и основания — те, которые не ионизованы полностью в водных растворах. Они повсеместно встречаются в биологических системах и принимают активное участие в метаболизме и его регуляции. Поведение водных растворов слабых кислот и оснований легче понять, если сначала познакомиться с некоторыми определениями.
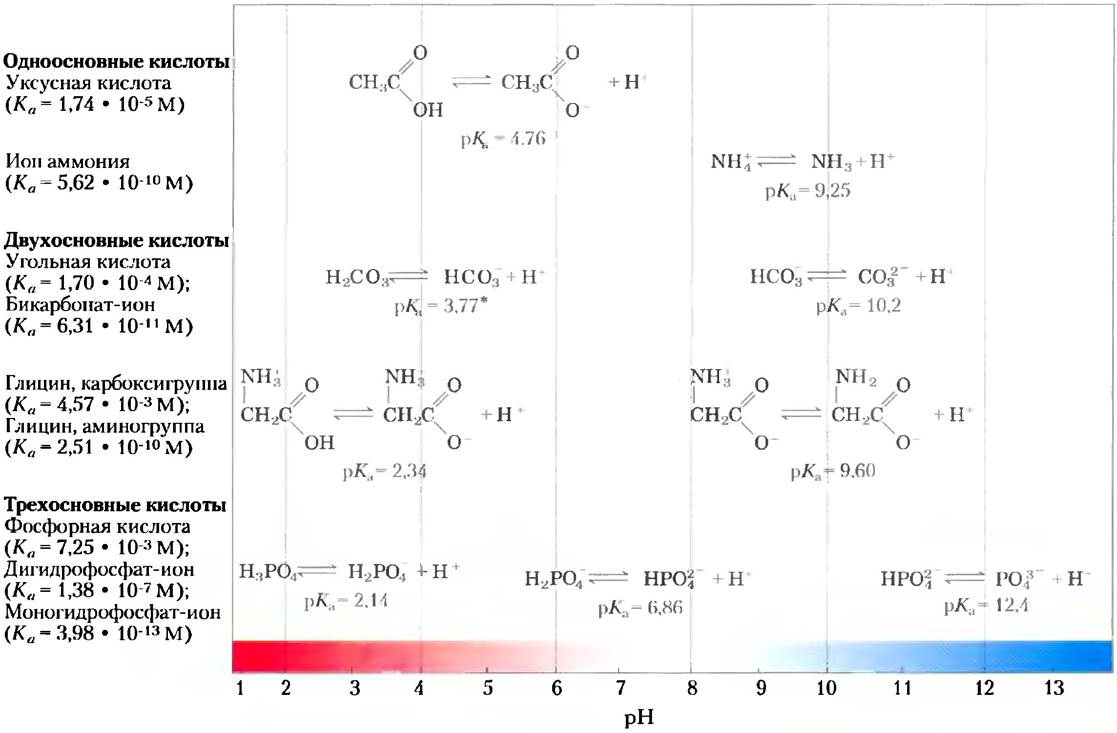
Кислоты можно определить, как доноры протонов, а основания — как акцепторы протонов. Донор протона и соответствующий акцептор образуют сопряженную кислотно-основную пару (рис. 2-15). Примером сопряженной кислотно- основной пары являются уксусная кислота (СН3СООН — донор протона) и ацетат-анион (СН3СОО — акцептор протона). Они связаны между собой следующей обратимой реакцией:
СН3СООН ⇄ Н+ + СН3СОО-
Рис. 2-15. Акцептор и донор протона составляют сопряженную кислотно-основную пару. Некоторые соединения, такие как уксусная кислота или ион аммония, являются одноосновными, т. е. при диссоциации могут отщепить лишь один протон. Существуют также двухосновные (угольная кислота (Н2СО3) или глицин) и трехосновные кислоты (например, фосфорная кислота (Н3РО4)). Реакции диссоциации для нескольких сопряженных кислотноосновных пар, показанных на рисунке, расположены в соответствии с градиентом pH. Для каждой реакции приведены константы диссоциации (Ка) и показатели их отрицательных логарифмов (рКа). Для объяснения кажущегося противоречия в значениях рКа угольной кислоты Н2СО3 см. с. 99.
Характерная особенность каждой кислоты состоит в том, что в воде она теряет свой протон. Чем сильнее кислота, тем сильнее выражена эта тенденция. Способность любой кислоты НА отщеплять протон и образовывать сопряженное основание А характеризуется константой равновесия (К) обратимой реакции
НА ⇄ Н+ + А-
где
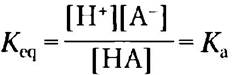
Константы равновесия реакций ионизации обычно называют константами ионизации или константами диссоциации кислоты. Численные значения констант диссоциации некоторых кислот представлены на рис. 2-15. Более сильные кислоты, такие как фосфорная или угольная кислоты, имеют более высокие константы диссоциации, тогда как более слабые кислоты, такие как анион НРО42-, характеризуются более низкими значениями констант.
На рис. 2-15 приводятся также значения рКа, которые по аналогии с pH определяются в соответствии с уравнением:
рКа = lg (1/Ka) = -lgKa
Чем сильнее способность соединения отдавать протон, тем более сильной кислотой оно является и тем более низкое значение рKа ему соответствует. Как мы увидим далее, численное значение рКa слабых кислот довольно легко определить.
Значения рКа слабых кислот можно определить из кривых титрования
Для определения количества кислоты в данном растворе проводят титрование. Для этого к точно отмеренному объему раствора кислоты добавляют раствор сильного основания (обычно едкого натра NаОН) с известной концентрацией. Раствор основания добавляют маленькими порциями до тех пор, пока не произойдет нейтрализация кислоты, что устанавливают по показаниям рН-метра или изменению окраски индикатора. Концентрацию кислоты в анализируемом растворе можно определить исходя из объема и концентрации добавленного раствора NаОН.
График, отражающий зависимость pH титруемого раствора от концентрации добавленного основания, называется кривой титрования. Из этого графика можно определить величину рКа слабой кислоты. Проследим за ходом титрования 0,1 М раствора уксусной кислоты (для простоты обозначим ее здесь как HАс) с помощью 0,1 М раствора NаОН при 25 °С (рис. 2-16). Процесс включает в себя две обратимых реакции:
Н2O ⇄ H+ + ОН (2-5)
НАс ⇄ Н+ + Ас- (2-6)
Эти реакции характеризуются соответствующими константами равновесия:
Кw = [Н+] [ОН-] = 1 • 10-14 М2 (2-7)
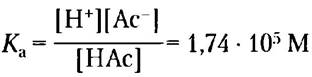 (2-8)
(2-8)
В начале титрования, до добавления NаОН, уксусная кислота уже слегка ионизована, причем степень ее ионизации можно определить, зная константу диссоциации (уравнение 2-8).
Рис. 2-16. Кривая титрования уксусной кислоты. После добавления каждой порции NаОН к раствору уксусной кислоты измеряют значение pH. Эту величину откладывают по оси ординат, тогда как по оси абсцисс откладывают долю общего количества NаОН, требуемого для превращения всей уксусной кислоты в депротонированную форму, т. е. в ацетат. По полученным точкам проводят кривую титрования. В рамках указаны преобладающие ионные формы уксусной кислоты при соответствующих значениях pH. В средней точке кривой титрования концентрации донора и акцептора протонов равны, а значение pH в этой точке численно равно значению рКa. Зона, выделенная голубым цветом, соответствует буферной зоне системы (когда ионизовано от 10 до 90% титруемой уксусной кислоты).
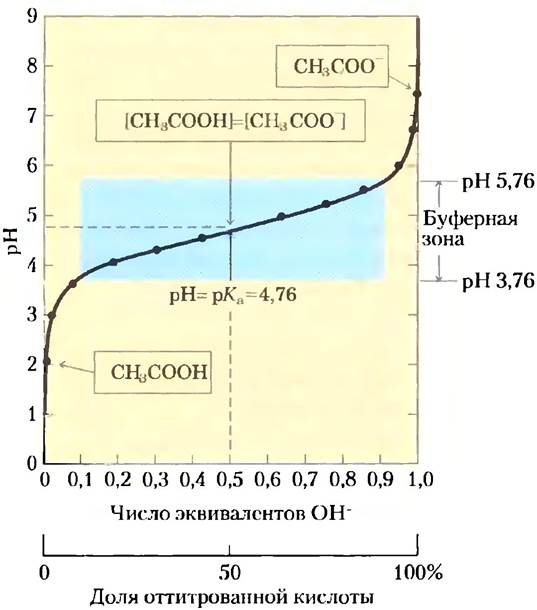
По мере добавления NаОН ионы ОН- соединяются со свободными ионами Н+ и образуют молекулы воды. При этом концентрации обоих ионов в растворе должны постоянно соответствовать значению ионного произведения воды (уравнение 2-7). Как только свободные ионы Н- оказываются связанными, уксусная кислота НАс диссоциирует далее в соответствии с собственной константой диссоциации (уравнение 2-8). В результате по мере добавления щелочи концентрация НАс постоянно уменьшается, а концентрация аниона Ас- увеличивается. В средней точке титрования, точно соответствующей добавлению 0,5 эквивалентов NаОН, половина исходной кислоты находится в диссоциированной форме, а это значит, что концентрация донора протона НАс становится равной концентрации акцептора Ас-. В этой точке соблюдается очень важное соотношение: значение pH раствора, содержащего равные молярные концентрации уксусной кислоты и иона ацетата, а именно 4,76, точно равно значению рKа уксусной кислоты (сравните значения на рис. 2-15 и 2-16). Скоро нам станет ясен смысл этого соотношения, которое соблюдается для всех слабых кислот.
По мере того как мы продолжаем титрование, добавляя новые порции NаОН, оставшаяся недиссоциированная кислота постепенно превращается в ацетат. Конечная точка титрования наблюдается около pH 7,0: вся уксусная кислота передала свои протоны анионам ОН-, в результате чего образовались вода и ацетат. На протяжении всего процесса титрования существуют два взаимосвязанных равновесия (уравнения 2-5 и 2-6), каждое из которых характеризуется своей константой равновесия.
На рис. 2-17 сравниваются кривые титрования трех слабых кислот с сильно различающимися константами диссоциации: уксусной кислоты (рKa = 4,76), дигидрофосфат-иона (рKa = 6,86) и иона аммония (рКa = 9,25). Кривые титрования этих кислот имеют одинаковую форму, но соответствуют разным значениям pH, поскольку кислоты различаются по своей силе. Уксусная кислота имеет наиболее высокое значение Ka, (самое маленькое рKa) и является самой сильной из этих трех слабых кислот (легче других отдает свой протон); при pH 4,76 она уже наполовину диссоциирована. Дигидрофосфат отдает протон труднее; он диссоциирован наполовину при pH 6,86. Самой слабой из трех кислот является ион аммония, он диссоциирует на 50% лишь при pH 9,25.
Рис. 2-17. Сравнение кривых титрования трех слабых кислот: СН3СOOН, Н2РО4- и NН4+. В рамках указаны преобладающие ионные формы этих соединений при соответствующих значениях pH. Справа указаны соответствующие буферные зоны. Сопряженные кислотно-основные пары являются эффективными буферными системами при тех значениях pH, при которых доноры протонов ионизованы на 10-90%.
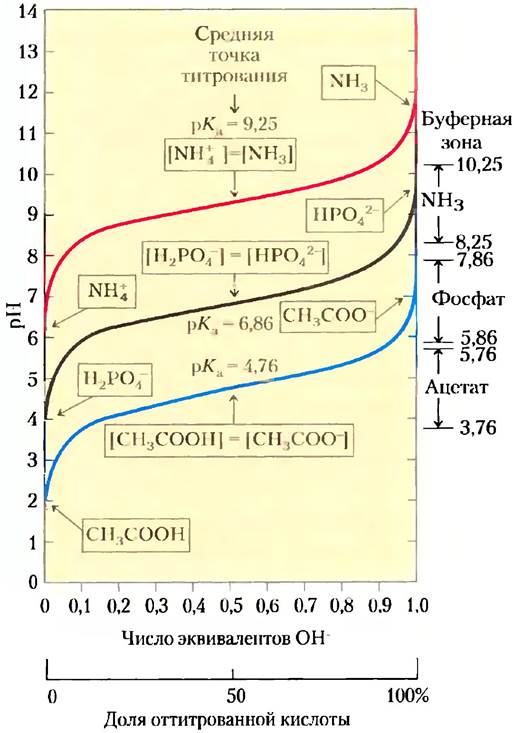
Самый важный вывод, который можно сделать на основании кривых титрования слабых кислот, состоит в том, что характер этих кривых указывает на возможность использования слабых кислот и их анионов в качестве буферов, которые будут описаны далее.
Краткое содержание раздела 2.2. Ионизация воды, слабые кислоты и слабые основания
■ Чистая вода слабо ионизована; в ней содержатся равные количества ионов водорода (ионов гидроксония Н3O+) и гидроксид-ионов. Степень ионизации воды характеризуется константой равновесия
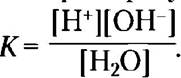
Из этого выражения можно вывести значение ионного произведения воды (Kw). При 25 °С Кw = [Н+] [ОН-] = 55,5К = 10-14 М2.
■ Значение pH водного раствора отражает концентрацию ионов водорода в логарифмических единицах: pH = lg (1/[Н+]) = - lg [Н-].
■ Чем выше кислотность раствора, тем ниже его pH. Слабые кислоты частично диссоциируют с высвобождением иона водорода, снижая тем самым pH водного раствора. Слабые основания принимают протон, повышая pH. Тенденция принимать или отдавать протон для каждого конкретного основания или кислоты характеризуется константой диссоциации (Ka):
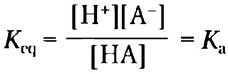
■ Значение рKa, отражает относительную силу слабого основания или кислоты в логарифмических единицах: рKa = lg (1/Кa) = -lgKa.
■ Чем сильнее кислота, тем ниже р/С, этой кислоты; чем сильнее основание, тем выше рKa, этого основания. Значение рKa, можно определить экспериментально: оно равно значению pH в средней точке кривой титрования данной кислоты или основания.