ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 1. ОСНОВЫ БИОХИМИИ СТРОЕНИЕ И КАТАЛИЗ - 2011
ЧАСТЬ I. СТРОЕНИЕ И КАТАЛИЗ
3. АМИНОКИСЛОТЫ, ПЕПТИДЫ И БЕЛКИ
3.2. Пептиды и белки
Теперь мы обратимся к рассмотрению полимеров аминокислот — пептидов и белков. В природе существуют полипептиды самого разного размера, состоящие из двух-трех или из тысяч аминокислотных остатков. Мы сосредоточим свое внимание на основных химических свойствах этих полимерных молекул.
Пептиды — это цепочки аминокислот
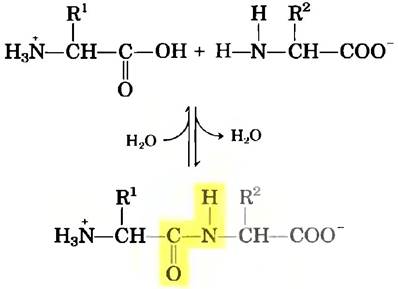
Две одинаковые или разные аминокислоты могут ковалентно связываться друг с другом при помощи замещенной амидной связи, называемой пептидной связью, с образованием дипептида. Пептидная связь возникает в результате отщепления компонентов молекулы воды от α-карбоксильной группы одной аминокислоты и α-аминогруппы другой (рис. 3-13). Образование пептидной связи относится к реакциям конденсации, широко распространенным в живых клетках. В стандартных биохимических условиях равновесие реакции, приведенной на рис. 3-13, смещено в сторону образования аминокислот, а не дипептида. Эта реакция стала бы термодинамически более выгодной, если карбоксильная группа модифицирована или активирована таким образом, чтобы облегчить уход гидроксильной группы. Химический метод решения этой задачи будет рассмотрен далее в настоящей главе, а биологические пути ее решения являются основным предметом обсуждения в гл. 27.
Рис. 3-13. Образование пептидной связи в реакции конденсации. α-Аминогруппа одной аминокислоты (с группой R2) выступает в качестве нуклеофила и замещает гидроксильную группу другой аминокислоты (с группой R1), в результате чего образуется пептидная связь (выделена желтым цветом). Аминогруппы являются хорошими нуклеофилами, но гидроксил - плохая уходящая группа, и ее не так просто заместить. Поэтому при физиологических значениях pH изображенная здесь реакция практически не происходит.
Три аминокислоты могут соединиться с помощью двух пептидных связей и образовать трипептид; точно так же можно получить тетрапептиды, пентапентиды и т. д. Несколько аминокислотных остатков, соединенных таким образом в цепочки, образуют олигопептиды. При соединении большого числа аминокислот получаются полипептиды. В белках может содержаться несколько тысяч аминокислотных остатков. Термины «белок» и «полипептид» иногда взаимозаменяемы, но все же полипептидами скорее следует называть молекулы с молекулярной массой до 10 000, а белками — более крупные молекулы.
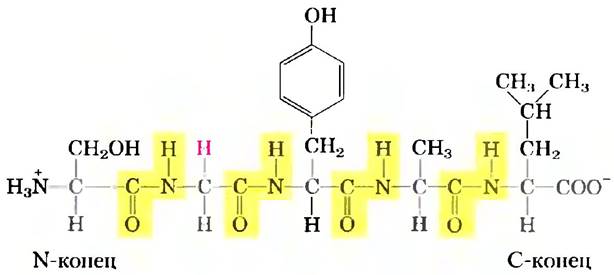
На рис. 3-14 представлена структура пентапептида. Как уже говорилось ранее, аминокислотные звенья в пептидах часто называют остатками, поскольку они представляют собой части молекул аминокислот, оставшиеся после ухода атома водорода из аминогруппы и гидроксила из карбоксильной группы. Аминокислотный остаток, находящийся на том конце пептида, где расположена свободная α-аминогруппа, называется N-концевым (или аминоконцевым) остатком, а остаток на противоположном конце цепи, несущем свободную карбоксильную группу, — С-концевым (или карбоксиконцевым) остатком.
Рис. 3-14. Пентапептид серил-глицил-тирозил-аланил-лейцин (Ser-Glу-Туr-Аlа-Lеu). Названия пептидов образуются из названий аминокислот, начиная с N-концевого остатка, который при записи формулы принято располагать слева. Пептидные связи выделены желтым цветом, а R-группы показаны красным цветом.
Ключевые договоренности.
При изображении аминокислотной последовательности пептида, полипептида или белка N-конец принято размещать слева, а С-конец- справа. Последовательность читают слева направо, начиная с N-конца. ■
Гидролиз пептидной связи является экзергоническим процесссом, однако он протекает медленно из-за высокой энергии активации (см. с. 48). В результате пептидные связи в белках довольно стабильны и в стандартных условиях внутри клетки имеют среднее время полураспада (t1/2) около семи лет.
Пептиды различаются по способности переходить в ионную форму
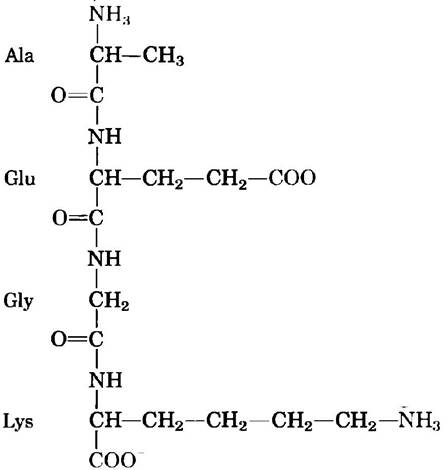
В молекуле пептида только одна свободная α-амииогруппа и одна свободная α-карбоксильная группа, которые расположены на противоположных концах пептидной цепи (рис. 3-15). Эти группы могут ионизироваться в пептидах так же, как и в свободных аминокислотах, однако с другими константами ионизации, поскольку заряженные противоположным образом группы больше не связаны с α-атомом углерода. Что же касается α-амино- и α-карбоксильных групп остальных аминокислот, связанных ковалентными пептидными связями, то они не вносят никакого вклада в кислотноосновные свойства пептидов, поскольку уже не способны к ионизации. Однако R-группы некоторых аминокислот могут быть ионизованы (табл. 3-1), что вносит определенный вклад в кислотно- основные свойства всей молекулы (рис. 3-15). Таким образом, кислотно-основные свойства пептида можно предсказать, исходя из наличия на его концах одной свободной α-аминогрунны и одной свободной α-карбоксильной группы, а также природы и числа ионизируемых R-групп.
Рис. 3-15. Аланил-глутамил-глицил-лизин. Этот тетрапептид имеет одну свободную α-аминогруппу и одну свободную α-карбоксилъную группу, а также две ионизируемые R-группы. Красным цветом выделены группы, ионизированные при pH 7,0.
Подобно аминокислотам, пептиды имеют характерные кривые титрования и значения изоэлектрических точек, т. е. значения pH, при которых они не движутся в электрическом поле. Эти свойства используются в некоторых методах разделения пептидов и белков, как мы покажем далее в данной главе. Следует еще раз подчеркнуть, что значения рКаионизируемых групп в свободной аминокислоте и аминокислоте в составе пептида могут различаться. В пептиде на величину рКa влияют потеря заряда на α-амино- и α-карбоксильной группе, взаимодействия с другими R-группами пептида, а также другие факторы изменившегося окружения. Приведенные в табл. 3-1 значения рКa R-групп можно использовать только для оценки диапазона pH, при котором эти группы могут быть ионизированы, а не как точные значения рКаR-групп в пептидах.
Биологически активные пептиды и полипептиды сильно различаются по размерам и составу
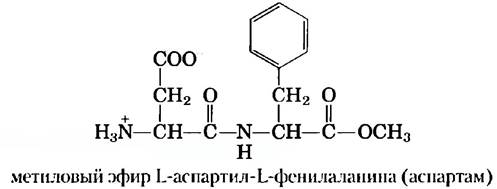
Не существует никакой зависимости между размером пептидов и белков и их биологической активностью. Природные пептиды имеют размеры от двух до нескольких тысяч аминокислотных остатков, причем биологической активностью могут обладать даже малые белковые молекулы. В качестве примера можно привести искусственно синтезированный дипептид метиловый эфир L-аспартил-L-фенилаланина, использующийся в качестве заменителя сахара и более широко известный под торговым названием аспартам или Нутрасвит.
Многие небольшие пептиды оказывают действие при очень низких концентрациях. Например, гормоны позвоночных животных (гл. 23) являются небольшими пептидами. К ним относятся окситоцин (9 аминокислотных остатков), секретируемый задней долей гипофиза и стимулирующий сокращения матки; тиролиберин (3 остатка), образующийся в гипоталамусе и стимулирующий высвобождение другого гормона — тиреотропина — из передней доли гипофиза. Небольшими пептидами являются некоторые очень токсичные грибные яды (аманитин) и многие антибиотики.
Какова длина пептидных цепей в белках? Как видно из табл. 3-2, этот параметр изменяется в широких пределах. Человеческий цитохром с состоит из 104 остатков, соединенных в одну цепь; химотрипсиноген быка состоит из 245 остатков. Гигантский белок титин, входящий в состав мышц позвоночника, содержит около 27 000 аминокислотных остатков и имеет молекулярную массу около 3 000 000. Преобладающее большинство природных белков имеют гораздо меньшие размеры, чем титин, и содержат обычно менее 2000 аминокислотных остатков.
Таблица 3-2. Молекулярные харатеристики некоторых белков
Молекулярная масса |
Число остатков |
Число цепей |
|
Цитохром с(человека) |
12 400 |
104 |
1 |
Рибонуклеаза А (из поджелудочной быка) |
13 700 |
124 |
1 |
Лизоцим (из яичного белка) |
11 300 |
129 |
1 |
Миоглобин (из сердца лошади) |
10 700 |
153 |
1 |
Химотрипсин (из поджелудочной быка) |
25 200 |
241 |
3 |
Химотрипсиноген (быка) |
25 700 |
245 |
1 |
Гемоглобин (человека) |
64 500 |
574 |
4 |
Сывороточный альбумин (человека) |
66 000 |
609 |
1 |
Гексокиназа (дрожжей) |
107 900 |
972 |
2 |
РНК-полимераза (Е. coli) |
450 000 |
4 158 |
5 |
Анодипонротеин В (человека) |
513 000 |
4 536 |
1 |
Глутаминсинтетаза (Е. coli) |
619 000 |
5 628 |
12 |
Титин (человека) |
2 993 000 |
26 926 |
1 |
Некоторые белки построены из единственной полипептидной цепи, другие, называемые мультисубъединичными белками, содержат две или несколько нековалентно связанных между собой цепей (табл. 3-2). Цепи в мультисубъединичных белках могут быть как одинаковыми, так и различными. Если хотя бы две цепи в белке идентичны, то такой белок называют олигомерным, а идентичные субъединицы (в свою очередь состоящие из одной или нескольких цепей) — протомерами. Например, гемоглобин состоит из четырех полипептидных субъединиц: двух идентичных α-цепей и двух идентичных β-ценей, удерживаемых в едином комплексе нековалентными взаимодействиями. Обе α-субъединицы идентичным образом образуют пары с β-субъединицами, так что гемоглобин можно рассматривать как тетрамер, состоящий из четырех полипептидных цепей, или как димер αβ-протомеров.
В некоторых белках полипептидные цепи связаны ковалентной связью. Например, две полипептидные цепи в молекуле инсулина связаны между собой дисульфидными мостиками. В подобных случаях отдельные полипептиды рассматривают не как субъединицы, а просто как полипептидиые цепи.
Аминокислотный состав белков весьма разнообразен. Двадцать основных аминокислот практически никогда нс встречаются в белках в равной пропорции. Некоторые аминокислоты могут встречаться лишь однажды, а могут и вообще не встречаться в данном типе белков, другие могут присутствовать в большом количестве. В табл. 3-3 отражен аминокислотный состав цитохрома с быка и химотрипсиногена быка — неактивного предшественника пищеварительного фермента химотрипсина. Эти два белка, имеющие совершенно разные функции, сильно различаются по своему аминокислотному составу.
Таблица 3-3. Аминокислотный состав двух белков
Число остатков |
в молекуле белка* |
|
Аминокислота |
Цитохром с быка |
Химотрипсиноген быка |
Ala |
6 |
22 |
Arg |
2 |
4 |
Asn |
5 |
14 |
Asp |
3 |
9 |
Cys |
2 |
10 |
Gin |
3 |
10 |
Glu |
9 |
5 |
Gly |
14 |
23 |
His |
3 |
2 |
lie |
6 |
10 |
Leu |
6 |
19 |
Lys |
18 |
14 |
Met |
2 |
2 |
Phe |
4 |
6 |
Pro |
4 |
9 |
Ser |
1 |
28 |
Thr |
8 |
23 |
Trp |
1 |
8 |
Туг |
4 |
4 |
Val |
3 |
23 |
Всего |
104 |
245 |
* В таких методах анализа, как кислотный гидролиз, Asp и Asn практически нельзя различить, поэтому их объединяют и обозначают как Asx (или В). Аналогичным образом, нельзя различить Glu и Gin, которые обозначают как Glx (или Z). Кроме того, при кислотном гидролизе полностью разрушается Тгр. Для определения точного аминокислотного состава необходимо использовать дополнительные методы анализа.
Для оценки числа аминокислотных остатков в белке, не содержащем компонентов другой химической природы, его молекулярную массу следует разделить на 110. Поясним, откуда это число. Для двадцати основных аминокислот средняя молекулярная масса составляет 138, однако в белках преобладают более легкие аминокислоты. Если учесть вклад различных аминокислот в построение белковых цепей (табл. 3-1), то средняя молекулярная масса аминокислоты, входящей в состав белка, окажется равной приблизительно 128. Поскольку при образовании каждой пептидной связи теряется одна молекула воды (Мr = 18), средняя молекулярная масса аминокислотного остатка составляет 128 - 18 = 110.
Некоторые белки имеют в составе не только аминокислотные остатки, но и другие группы
Многие белки, например, ферменты рибонуклеаза А и химотрипсиноген, содержат в молекуле только аминокислотные остатки и не имеют никаких других химических компонентов; их называют простыми белками. Однако есть белки, которые кроме аминокислот содержат и другие химические группы; их называют сложными белками. Неаминокислотную часть сложного белка называют простетической группой. Сложные белки классифицируют в соответствии с химической природой простетических групп (табл. 3-4). Например, липопротеины содержат липиды, гликопротеины имеют в своем составе сахара, а металлопротеины — определенные металлы. Некоторые белки содержат несколько простетических групп. Обычно простетическая группа играет важную роль при выполнении биологических функций белка.
Таблица 3-4. Сложные белки
Класс |
Простетическая группа |
Пример |
Липопротеины |
Липиды |
β1-Липопротеин крови |
Гликопротеины |
Углеводы |
Иммуноглобулин G |
Фосфопротеины |
Фосфатные группы |
Казеин молока |
Гемопротеины |
Гем (комплекс железа с протопорфирином) |
Гемоглобин |
Флавопротеины |
Флавиновые нуклеотиды |
Сукцинатдегидрогеназа |
Металлопротеины |
Железо |
Ферритин |
Цинк |
Алкогольдегидрогеназа |
|
Кальций |
Кальмодулин |
|
Молибден |
Нитрогеназа |
|
Медь |
Пластоцианин |
Краткое содержание раздела 3.2 Пептиды и белки
■ Аминокислоты могут соединяться с помощью ковалентных пептидных связей, образуя пептиды и белки. В клетках обычно содержится несколько тысяч различных белков, каждый из которых обладает характерной биологической активностью.
■ Некоторые белки представляют собой очень длинные полипептидные цепи, содержащие от 100 до нескольких тысяч аминокислотных остатков, однако существуют также природные пептиды, состоящие всего лишь из нескольких аминокислот. Некоторые белки образованы несколькими нековалентно связанными полипептидными цепями, называемыми субъединицами. В результате гидролиза простых белков образуется смесь аминокислот. Сложные белки, кроме того, содержат компоненты другой химической структуры, например, ионы металлов или органические простетические группы.
■ Аминокислотная последовательность является важной характеристикой белка и называется его первичной структурой. Это первый уровень из четырех уровней организации белковых молекул.