ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 1. ОСНОВЫ БИОХИМИИ СТРОЕНИЕ И КАТАЛИЗ - 2011
ЧАСТЬ I. СТРОЕНИЕ И КАТАЛИЗ
4. ТРЕХМЕРНАЯ СТРУКТУРА БЕЛКОВ
4.2. Вторичная структура белка
Термин вторичная структура может относиться к любому выбранному фрагменту полипептидной цепи и описывает локальную пространственную укладку атомов, составляющих основную цепь, без учета конформации боковых цепей или взаимодействия с другими фрагментами. Регулярная вторичная структура имеет место тогда, когда величины обоих торсионных углов (φ и Ψ) остаются постоянными или почти постоянными на протяжении определенного участка цепи.
Наиболее известными типами вторичной структуры являются α-спирали и β-слои; также довольно часто встречаются β-повороты. Если регулярных структур не обнаружено, говорят о неопределенности вторичной структуры или о случайной спирали. Однако это последнее определение не дает правильного представления о структуре таких участков. Укладка полипептидного остова практически в любом белке не является случайной; более того, обычно она неизменна и специфична для структуры и функционирования конкретного белка. Здесь мы сосредоточимся на рассмотрении наиболее часто встречающихся регулярных структур.
α-Спираль — это распространенный вид вторичной структуры белка
Архитектура белка — α-спираль. Полинг и Кори знали о важном значении водородных связей для ориентирования полярных химических групп, таких как С=О и N-Н, в составе пептидной группы. Кроме того, они знали о результатах работы Уильяма Астбери, который в 1930-х гг. впервые осуществил рентгеноструктурный анализ белков. Астбери показал, что белок, составляющий основу волоса и иглы дикобраза (фибриллярный белок α-кератин), имеет регулярную структуру, а именно состоит из повторяющихся единиц размером 5,15-5,20 А. (Размерность единицы длины ангстрем (А) введена в честь шведского физика Андерса Йонеса Ангстрема; 1 А = 0,1 нм. Эта единица не входит в систему СИ, но очень широко используется в структурной химии и биологии при описании размеров атомов и межатомных расстояний.) Владея данной информацией и собственными данными о строении пептидной связи, а также используя точно сконструированные модели, Полинг и Кори взялись за определение вероятных конформаций белковых молекул.
Самым простым способом организации полипептидной цепи с ее жесткой пептидной связью и остальными связями, способными к вращению, является спиральная структура, которую Полинг и Кори назвали α-спиралью (рис. 4-4). В этой структуре полипептидный остов образует плотные витки вокруг длинной оси молекулы, тогда как R-группы аминокислотных остатков выступают из спирального остова наружу. Периодически повторяющаяся единица соответствует одному витку спирали, шаг которой составляет приблизительно 5,4 А, что лишь ненамного больше значения, определенною Астбери при рентгеноструктурном анализе кератина волос. Аминокислотные остатки в α-спирали имеют значения углов φ = -57° и Ψ = -47°, причем каждый виток спирали содержит 3,6 аминокислотных остатка. В α-спиральных участках белков часто наблюдается некоторое отклонение от этих значений торсионных углов, причем вариации возможны даже внутри самого участка, что позволяет спирали образовывать небольшие изгибы и петли. Во всех белках α-сиираль закручена вправо (доп. 4-1). Выяснилось, что α-спираль является преобладающей структурой в α-кератинах. Более того, около четверти всех аминокислотных остатков в полипептидных цепях входят в состав α-спиралей (в разных белках это значение несколько различается).
Рис. 4-4. Модели α-спирали, демонстрирующие различные аспекты ее структуры, а) Шаростержневая модель правой α-спирали, на которой показаны водородные связи внутри цепи. Шаг спирали соответствует 3,6 аминокислотных остатков, б) Вид на α-спираль с одного ее конца вдоль длинной оси (РDВ ID 4TNС). Обратите внимание на расположение R-групп, изображенных здесь лиловым цветом. При взгляде на эту шаростержневую модель создается ложное впечатление, что спираль внутри пустая, но дело в том, что размер шариков здесь не соответствует ван-дер-ваальсовым радиусам атомов, в) Как видно на шаровой модели, атомы в центре α-спирали очень плотно упакованы, г) Проекция спирали. Цветом выделены поверхности, обладающие теми или иными свойствами. Например, желтым цветом изображены гидрофобные остатки, которые располагаются на границе данной спирали и другой части этого же или другого полипептида. Красные и синие остатки иллюстрируют возможное взаимодействие между положительно и отрицательно заряженными группами боковых цепей, разделенных двумя остатками в спирали.
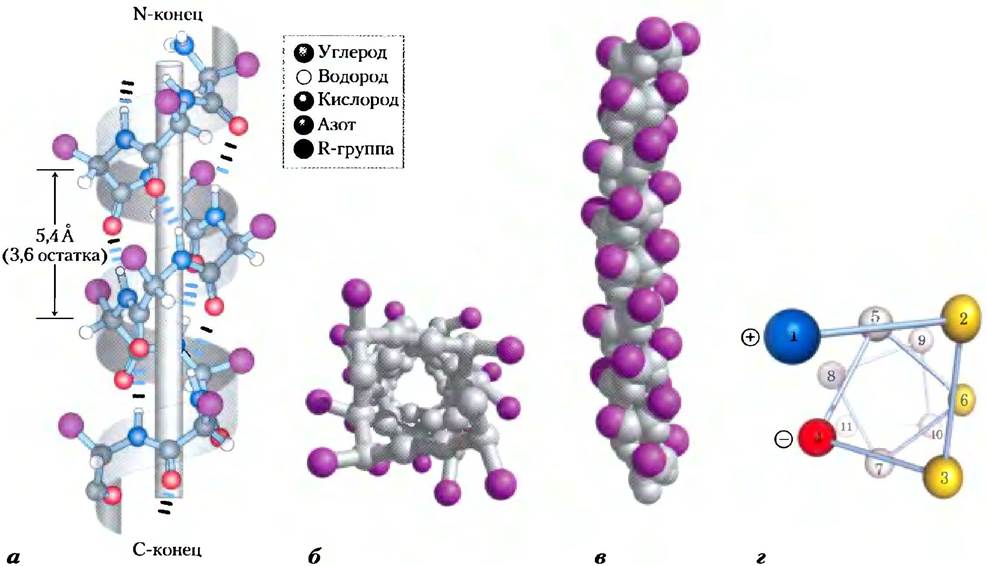
Почему α-спираль образуется чаще других возможных структур? До некоторой степени это объясняется тем, что в α-спирали оптимальным образом используются водородные связи внутри молекулы. Данная структура стабилизируется водородными связями между атомом водорода, соединенным с электроотрицательным атомом азота пептидной связи, и электроотрицательным атомом кислорода карбонильной группы четвертой аминокислоты (считая вдоль цепи назад) (рис. 4-4, а). В образовании подобных водородных связей участвует каждая пептидная группа α-спирали (за исключением концевых групп). В результате каждый последующий виток связан с предыдущим тремя или четырьмя водородными связями, что делает эту конформацию полипептидной цепи довольно устойчивой.
В последующих модельных экспериментах было показано, что α-спираль может образовываться как из L-, так и из D-аминокислот, но все остатки должны представлять собой стереоизомеры одного и того же ряда, поскольку D-аминокислота нарушала бы регулярную структуру, состоящую из L-аминокислот, и наоборот. В принципе, существующие в природе L-аминокислоты могут образовывать как правую, так и левую спираль, однако протяженные левозакрученные спирали в белках не обнаружены.
Дополнение 4-1. Методы. Как отличить правую спираль от левой?
Существует простой метод, позволяющий различить правую и левую спирали. Сначала прижмите четыре пальца каждой руки к ладоням, а большие пальцы оставьте свободными и направьте их строго вверх (см. рисунок). Теперь посмотрите на свою правую руку и представьте, что четыре пальца обвивают большой палец в виде спирали, направленной туда, куда он показывает (т. е. против часовой стрелки). Это правая спираль. С левой рукой — то же самое: четыре пальца образуют участок левой спирали, обпивающейся вокруг большого пальца и направленной вверх (т. е. по часовой стрелке).
Пример 4-1. Вторичная структура и размеры белков
Какова длина полипептида, состоящего из 80 аминокислотных остатков, образующих единственную α-спираль?
Решение. Оборот идеальной α-спирали образован 3,6 аминокислотными остатками, что составляет в длину 5,4 А. Таким образом, вклад каждого аминокислотного остатка в длину спирали составляет 1,5 А. Получаем, что длина полипентидной цепи равна: 80 остатков • 1,5 А/остаток = 120 А.
Последовательность аминокислот влияет на стабильность α-спирали
Не все полипептиды способны образовывать устойчивую α-спираль. Каждый аминокислотный остаток в полипептидной цепи обладает более или менее выраженной склонностью к образованию α-спирали (табл. 4-1), связанной со свойствами R-группы и способностью соседних атомов основной цени создавать необходимые значения углов φ и Ψ. В большинстве экспериментальных модельных систем наибольшую склонность к образованию α-спиралей демонстрирует аланин.
Таблица 4-1. Склонность аминокислот принимать конформацию α-спирали
Аминокислота |
∆∆G° (кДж/моль)* |
Аминокислота |
∆∆G° (кДж/моль)* |
Ala |
0 |
Leu |
0,79 |
Arg |
0,3 |
Lys |
0,63 |
Asn |
3 |
Met |
0,38 |
Asp |
2,5 |
Phe |
2,0 |
Cys |
3 |
Pro |
4 |
Gln |
1,3 |
Ser |
2,2 |
Glu |
1,4 |
Thr |
2,4 |
Glv |
4.6 |
Tyr |
2,0 |
His |
2,6 |
Trp |
2.0 |
lle |
1,4 |
Val |
2,1 |
*∆∆С° — изменение свободной энергии при принятии аминокислотным остатком α-спиральной укладки по сравнению с таковым для аланина.
Важную роль играет также положение аминокислотного остатка по отношению к его окружению. Взаимодействия между боковыми цепями аминокислотных остатков могут как стабилизировать, так и дестабилизировать эту структуру. Например, если в полипептидной цепи имеется протяженный участок, содержащий остатки глутаминовой кислоты, то при pH 7,0 такой участок не может укладываться в α-спираль. Дело в том, что отрицательно заряженные карбоксильные группы соседних остатков Glu отталкиваются настолько сильно, что мешают образованию спирали. По той же причине участки с близко расположенными остатками Lys и (или) Arg, R-группы которых при pH 7,0 несут положительный заряд, отталкиваются и препятствуют образованию спирали. Расположенные по соседству остатки Asn, Ser, Thr и Cys тоже могут дестабилизировать α-спираль; в данном случае причина заключается в больших размерах и форме их R-групп.
Виток α-спирали обеспечивает взаимодействие между боковой цепью одной аминокислоты и боковой цепью другой аминокислоты, расположенной от первой на расстоянии трех или четырех остатков (рис. 4-4, г). Часто положительно заряженные аминокислоты располагаются на расстоянии трех остатков от отрицательно заряженных, что способствует образованию ионной пары. Две ароматические аминокислоты часто расположены в пространстве одинаковым образом, что обеспечивает возможность гидрофобных взаимодействий.
Еще одним препятствием для образования α-спирали является присутствие остатков Pro или Gly, которые менее всего склонны образовывать α-спираль. В пролине атом азота входит в состав жесткого кольца (рис. 4-7, б), что исключает возможность вращения вокруг связи N—Сα. В результате остатки Pro вносят в α-спирали дестабилизирующие петли. Кроме того, при атоме азота в остатке Pro нет атома водорода, который мог бы участвовать в образовании водородной связи с другим аминокислотным остатком. В связи с этим пролин крайне редко встречается в последовательностях, организованных в виде α-спирали. Глицин редко встречается в α-спиралях по другой причине: у него больше конформационных возможностей, чем у других аминокислотных остатков, поэтому полимеры глицина образуют спиралевидные структуры, отличающиеся от α-спиралей.
Наконец, для устойчивости α-спиральной структуры полипептида важно, какие именно аминокислотные остатки расположены на концах сегментов спирали. Каждая пептидная связь имеет небольшой электрический диполь (рис. 4-2, а). Эти диполи связаны через водородные связи, возникающие в спирали, в результате чего вся структура представляет собой диполь, причем его величина возрастает с увеличением длины спирали (рис. 4-5). Четыре аминокислоты на каждом конце спирали не полностью вовлечены в образование водородных связей. Частичный положительный и частичный отрицательный заряды диполя обычно локализованы на пептидной аминогруппе и карбонильной группе вблизи N- и С-концов спирали соответственно. По этой причине на N-конце спирального участка часто обнаруживают отрицательно заряженные аминокислоты, способные нейтрализовать положительный заряд диполя. Наличие положительно заряженных аминокислот на этом конце будет оказывать дестабилизирующее действие. Все сказанное выше (с точностью до противоположных знаков зарядов) верно и для С-конца спирали.
Рис. 4-5. Диполь α-спирали. Электрический диполь, который существует на каждой пептидной связи (см. рис. 4-2, а), по водородным связям распространяется на всю длину α-спирального участка. На рисунке аминогруппы и карбонильные группы каждой пептидной связи обозначены знаками + и - соответственно. N- и С-концевые амино- и карбонильные остатки пептидных групп, не задействованные полностью в образовании водородных связей, показаны красным цветом.

Итак, на устойчивость α-спирали влияют пять типов различных факторов: 1) склонность аминокислотных остатков образовывать а-спираль; 2) взаимодействия между R-группами, особенно между находящимися на расстоянии трех (или четырех) аминокислотных остатков; 3) близкое расположение аминокислотных остатков с R-группами большого размера; 4) наличие остатков Gly и Pro; 5) взаимодействие между аминокислотными остатками на N- и С-концах спирального участка и электрическим диполем, возникающем в спирали. Таким образом, способность конкретного участка полипептидиой цепи образовывать α-спираль зависит от того, какие аминокислоты и в каком порядке расположены на этом участке.
Участки полипептидных цепей с β-конформацией образуют β-слои
Архитектура белка — β-слой. В 1951 г. Полинг и Кори предсказали также существование второго тина регулярной организации пептидов — β-структуры, при которой цепи находятся в более вытянутой конформации, что подтверждается данными рентгеноструктурного анализа. В данном случае остов полипептидной цепи образует не спиральную, а зигзагообразную структуру (рис. 4-6). Зигзагообразные полипептидные цени могут быть уложены параллельно, образуя ряд складок. В данной структуре, называемой β-слоями, водородные связи возникают между соседними участками полипептидных цепей. Обычно в образовании β-слоев участвуют фрагменты, расположенные в полипептидной цепи поблизости друг от друга, но иногда это могут быть сравнительно удаленные участки последовательности и даже участки разных полипептидных цепей. R-группы аминокислот выступают по обе стороны зигзагообразной структуры, что хорошо видно при изображении цепи в боковой проекции (рис. 4-6).
Рис. 4-6. β-Конформация полипептидной цепи. Вид на полипептидные цепи сверху и сбоку позволяет разглядеть выступающие в стороны R-группы боковых цепей аминокислот и подчеркивает плоскую структуру β-слоев, которые иначе называют β-складками или β-листами. Водородные связи между соседними слоями изображены в виде коротких синих черточек. Ориентация N- и С-концов соседних цепей (показана стрелками) может быть одинаковой или противоположной, образуя, а) антипараллельный β-слой или б) параллельный β-слой.
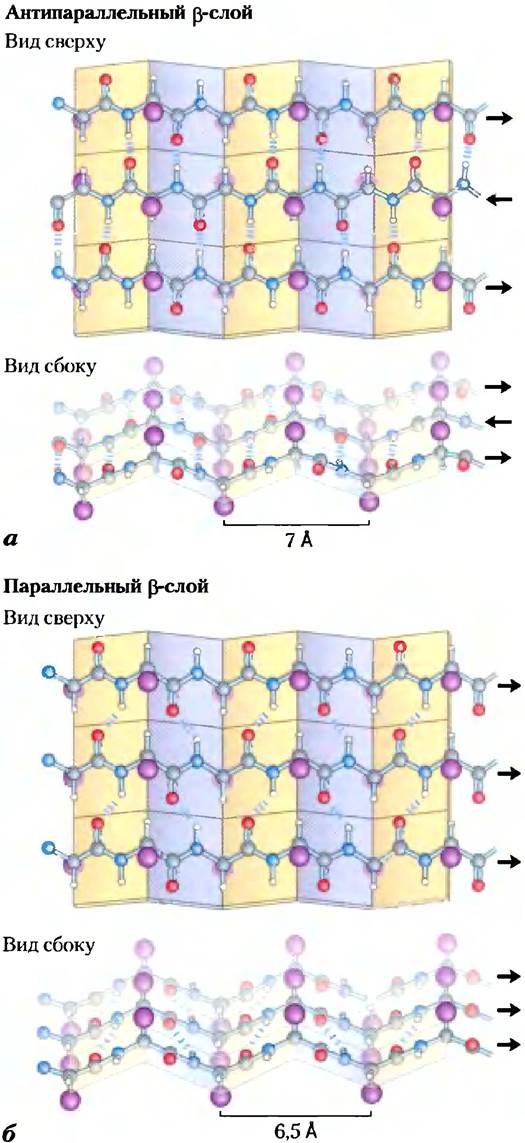
Прилегающие друг к другу в p-слоях полипептидные цени могут быть как параллельными, так и антипараллельными (т. е. иметь одну и ту же или разную С-N-ориентацию). Возникающие при этом структуры довольно похожи, но несколько различаются по размерам повторяющегося звена (6,5 А при параллельном расположении и 7,0 А при аптипараллельном расположении цепей), и водородные связи в них организованы по-разному. В идеальных структурах значения углов составляют: φ = -119°, Ψ = +113° (параллельная укладка) и φ = -139°, Ψ = +135° (антипараллельная укладка); в реальных белках эти значения несколько отличаются, что приводит к вариациям структуры, как было показано выше для α-спирали.
Некоторые аминокислотные последовательности ограничивают возможность образования β-слоев. В частности, для того чтобы два или более β-слоев могли укладываться рядом в белке, соприкасающиеся R-группы аминокислотных остатков должны иметь сравнительно небольшие размеры. Такие p-кератины, как фиброины шелка и паутины, содержат очень высокую долю остатков Gly и Ala, R-группы которых имеют самые малые размеры. В фиброине шелка, например, остатки Gly и Ala чередуются на протяжении довольно длинных участков последовательности.
В белковой структуре часто встречаются β-повороты
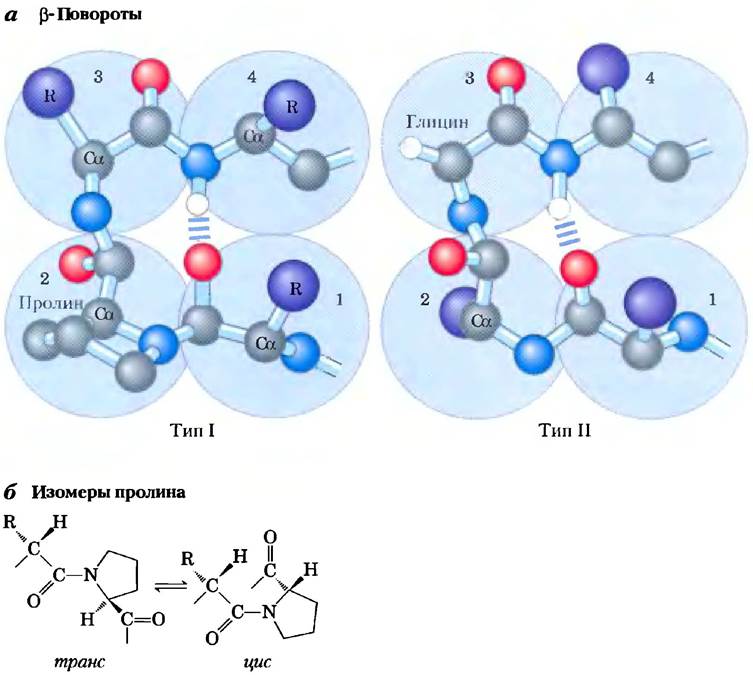
Архитектура белка — β -поворот. В глобулярных белках, характеризующихся компактной упаковкой полипептидных цепей, около одной трети всех аминокислотных остатков приходится на повороты и петли, возникающие при изменении направления укладки полипептидной цепи (рис. 4-7). Эти элементы структуры связывают между собой участки α-спиралей и β-слоев. Наиболее часто встречаются β-повороты, связывающие концы двух соседних участков антипараллельного β-слоя. Эта структура представляет собой повернутую на 180° петлю, в которой задействовано четыре аминокислотных остатка, причем кислород карбонильной группы первого остатка образует водородную связь с водородом аминогруппы четвертого остатка. Пептидные группы двух средних остатков не участвуют в образовании никаких водородных связей с другими остатками. Часто в этих структурах встречаются остатки Gly и Pro: первый — благодаря своему малому размеру и гибкости, а второй — благодаря легкости, с которой пептидная связь с участием азота иминогруппы пролина принимает цис-конфигурацию, способствующую образованию петли (рис. 4-7, б). На рис. 4-7, а представлены те два типа β-поворотов, которые наиболее часто встречаются в белках. Эти структуры обычно находятся близко к поверхности белка, где две средние аминокислоты из тех четырех, что образуют поворот, могут участвовать в образовании водородных связей с водой. Сравнительно реже в белках можно встретить состоящие из трех аминокислотных остатков y-повороты, в которых водородная связь возникает между первым и третьим остатками.
Рис. 4-7. Структура p-поворота, а) Наиболее распространены в белках β-повороты типа I и II, причем тип I встречается в два с лишним раза чаще, чем тип II. В β-поворотах типа II в третьей позиции всегда находится остаток Gly. Обратите внимание на водородные связи между первым и четвертым остатками петли (отдельные аминокислотные остатки схематично изображены в виде больших голубых кругов и пронумерованы). б) транс- и цис-Изомеры пептидной связи с участием иминогруппы пролина. Пептидные связи между аминокислотными остатками в белках на 99,95% имеют транс-конфигурацию. Исключение составляют пептидные связи с участием Pro: 6% образуемых им пептидных связей имеют цис-конфигурацию; многие из этих связей расположены в β-поворотах.
Вторичные структуры белка характеризуются определенными углами связей
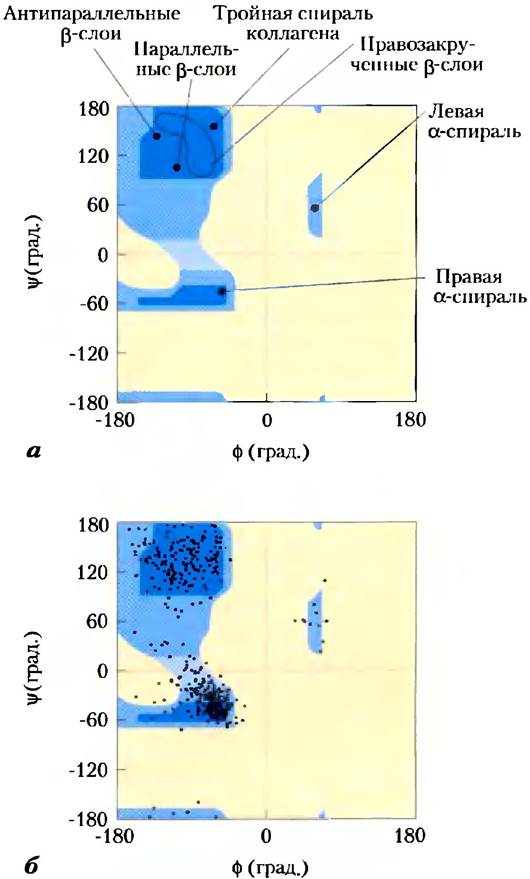
Наиболее распространенными вторичными структурами в большинстве белковых молекул являются α-спирали и β-слои, хотя в некоторых специализированных белках встречаются и другие вторичные структуры (примером является коллаген, рис. 4-12). Каждый тип вторичной структуры можно полностью описать с помощью значений углов ф и гр, образуемых связями в аминокислотных остатках. Как видно из карты Рамачандрана, α-спирали и β-слои попадают в довольно узкий диапазон разрешенных конформаций (рис. 4-8, а). Большинство значений углов φ и Ψ, взятых из известных белковых структур, попадают в необходимый диапазон, причем наибольшая часть из них соответствует именно конформации α-спирали и β-слоя (рис. 4-8, б). Единственной аминокислотой, чьи характеристики выпадают из этого диапазона, является глицин. Благодаря малому размеру боковой цени (единственному атому водорода) остаток глицина может участвовать в образовании самых разных конформаций, которые являются стерически запрещенными для других аминокислот.
Рис. 4-8. Карта Рамачандрана для различных белковых структур, а) На график, представленный на рис. 4-3, нанесены значения φ и Ψ для различных вторичных структур. Хотя левые α-спирали длиной в несколько аминокислот теоретически могут существовать, в белках такой структуры не обнаружено, б) На карте разрешенных конформаций (рис. 4-3) нанесены значения φ и Ψ для всех аминокислотных остатков (за исключением глицина) пируваткиназы кролика. Небольшие и способные принимать различные конфигурации остатки Glу исключены из рассмотрения, поскольку они часто выпадают из разрешенного диапазона (синего цвета).
Вторичные структуры можно идентифицировать с помощью метода кругового дихроизма
Молекулы с асимметричной структурой по- разному поглощают правую и левую компоненты плоскополяризованного света. Измерение этих различий лежит в основе спектроскопии кругового дихроизма (КД). Упорядоченные структуры, такие как свернутые белки, имеют спектры поглощения, в которых могут быть пики и впадины. Спектры белков снимают в дальней ультрафиолетовой области (от 190 до 250 нм). Поглощающей (хромофорной) единицей в данном случае является пептидная связь; сигнал получают от пептидной связи, находящейся в окружении свернутого белка. Разницу молярных коэффициентов экстинкции (см. доп. 3-1) для левополяризованного и правополяризованного света (∆ε) откладывают на графике как функцию длины волны.
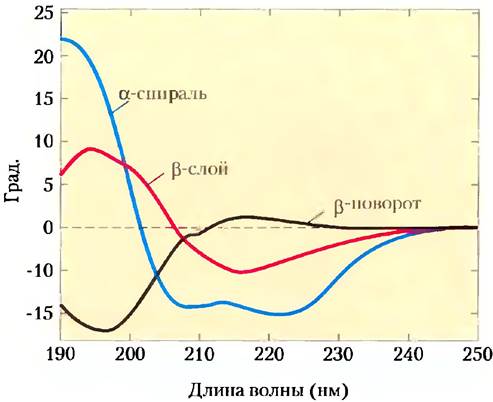
α-Спирали и β-слои имеют характерные спектры КД (рис. 4-9). С помощью спектров КД можно установить, правильно ли свернут белок, оценить долю белка, находящегося в той или иной конформации, а также следить за переходами между свернутым и несвернутым белком.
Рис. 4-9. Спектры кругового дихроизма полилизина. На спектрах полилизин представлен полностью в виде α-спирали, β-слоя или денатурированной случайной спирали. На оси у отложены величины в единицах, чаще всего используемых в экспериментах по КД. Поскольку спектры в случае α-спирали, β-слоя и денатурированной случайной спирали различаются между собой, спектр КД для данного белка можно использовать для грубой оценки доли белка, имеющего одну из двух наиболее распространенных типов вторичной структуры. Спектр КД нативного белка может служить контролем, соответствующим полностью свернутому белку, что удобно при изучении денатурации или конформационных изменений, вызванных изменениями условий в растворе.
Краткое содержание раздела 4-2 Вторичная структура белка
■ Вторичная структура — это упорядоченная структура аминокислотных остатков на участке полипептидной цепи, в котором все остатки расположены в пространстве строго определенным образом по отношению друг к другу.
■ Наиболее распространенными регулярными вторичными структурами белков являются α-спирали, β-слои и β-новороты.
■ Вторичная структура участка полипептидной цепи полностью описывается набором значений углов φ и Ψ для всех аминокислотных остатков, расположенных в этом участке.
■ Спектры кругового дихроизма позволяют идентифицировать в белке области с основными типами вторичной структуры, а также следить за процессом свертывания.