ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 1. ОСНОВЫ БИОХИМИИ СТРОЕНИЕ И КАТАЛИЗ - 2011
ЧАСТЬ I. СТРОЕНИЕ И КАТАЛИЗ
7. УГЛЕВОДЫ И ГЛИКОБИОЛОГИЯ
7.2. Полисахариды
Большинство углеводов в природе представлено полисахаридами — полимерными молекулами с большой молекулярной массой. Полисахариды, или гликаны, различаются между собой природой составляющих их моносахаридных звеньев, длиной цепи, типом гликозидных связей, а также степенью разветвленности. Гомополисахариды содержат мономерные звенья только одного вида; гетерополисахариды могут содержать звенья двух или большего числа видов (рис. 7-13). Некоторые гомополисахариды, такие как крахмал и гликоген, служат в качестве запасной формы моносахаридов, использующихся в качестве топливных молекул. Другие гомополисахариды (например, целлюлоза и хитин) выполняют функцию структурных элементов в клеточных стенках растений и наружном скелете животных. Гетерополисахариды служат элементами внеклеточного каркаса у организмов всех царств. Например, прочный слой оболочки бактериальной клетки (пептидогликан) содержит в своем составе гетерополисахарид, построенный из двух чередующихся типов моносахаридных звеньев. В тканях животных внеклеточное пространство заполнено гетерополисахаридами различного типа, которые образуют каркас, удерживающий вместе индивидуальные клетки, а также обеспечивающий форму и защиту клеткам, тканям и органам.
Рис. 7-13. Гомо- и гетерополисахариды. Полисахариды могут состоять из одного, двух или нескольких типов моносахаридных звеньев, соединенных в линейные или разветвленные цепи разной длины.
В отличие от белков полисахариды обычно нельзя охарактеризовать строго определенной молекулярной массой, что объясняется различными механизмами сборки этих биополимеров. Как мы обсудим в гл. 27, белки синтезируются на матрице с определенной последовательностью и длиной (на информационной РНК) с помощью ферментов, синтез в точности следует «указаниям» матрицы. Для синтеза полисахаридов такой матрицы не существует; программа синтеза полисахарида заключена в самом ферменте, катализирующем полимеризацию мономерных звеньев, и в данном случае нет специфической команды для остановки процесса синтеза.
Некоторые гомополисахариды служат для запасания энергии клеткой
Наиболее важным запасным полисахаридом в клетках растений является крахмал, а в клетках животных — гликоген. Оба этих соединения находятся в клетках в виде крупных кластеров или гранул. Молекулы крахмала и гликогена сильно гидратированы, поскольку имеют множество обращенных наружу гидроксильных групп, доступных для образования водородных связей с водой. Крахмал образуется в большинстве клеток растений (см. рис. 20-2), но наиболее высока его концентрация в клубнях (например, картофеля) и семенах.
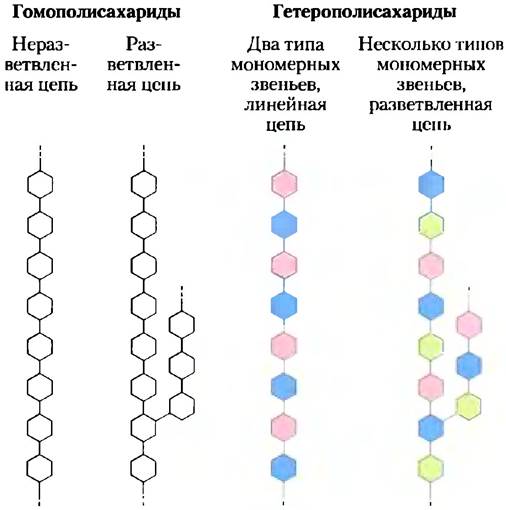
Крахмал — это смесь двух полимеров глюкозы: амилозы и амилопектина (рис. 7-14). Первый из них состоит из длинных неразветвленных цепей из остатков D-глюкозы, соединенных (α1 —> 4)-связями. Молекулярная масса таких цепей варьирует от нескольких тысяч до миллионов дальтон. Амилопектин также имеет
большую молекулярную массу (до 100 млн Да), но, в отличие от амилозы, его молекулы сильно разветвлены. В неразветвленных участках остатки глюкозы соединены между собой (α1 —> 4)- гликозидными связями, а в участках ветвления (встречающихся через каждые 24-30 остатков) — (α1—> 6)-связями.
Рис. 7-14. Гликоген и крахмал, а) Короткий фрагмент амилозы — линейного полимера, состоящего из остатков D-глюкозы, соединенных (α1 —> 4)-гликозидными связями. Единственная цепь амилозы содержит несколько тысяч остатков глюкозы. Амилопектин между точками ветвления имеет участки с таким же строением. У гликогена основная структура та же, но он более разветвленный, чем амилопектин. б) Точка ветвления в молекуле амилопектина, в которой мономерные звенья связаны (α1 —> 6)-гликозидной связью, в) Фрагмент гранулы крахмала, состоящего из нитей амилозы и амилопектина. Нити амилопектина (изображены красным цветом) образуют двойные спирали друг с другом или с молекулами амилозы (изображена синим цветом). В клетке при использовании крахмала для получения энергии остатки глюкозы на невосстанавливающих концах внешних ветвей отщепляются ферментативным путем. Гликоген имеет сходное строение, но его молекулы более компактны и сильнее разветвлены.
Гликоген — основной запасной полисахарид в животных клетках. Подобно амилопектину, гликоген представляет собой полимер, состоящий из соединенных (α1 —> 4) связями остатков глюкозы с разветвлениями, образованными (α1—> 6)-связями. Однако гликоген имеет гораздо более разветвленную (точки ветвления встречаются через каждые 8-12 остатков глюкозы) и более компактную структуру, чем крахмал. В наибольшем количестве гликоген содержится в печени, где на его долю приходится до 7% общей массы органа, а кроме того, он встречается в скелетных мышцах. В гепатоцитах гликоген присутствует в виде крупных гранул, которые, в свою очередь, состоят из более мелких гранул, образованных единичными сильно разветвленными молекулами гликогена со средней молекулярной массой до нескольких миллионов дальтон. С этими гранулами прочно связаны ферменты, отвечающие за синтез и распад гликогена.
Поскольку каждая цепь гликогена оканчивается невосстанавливающим остатком сахара, в молекуле гликогена ровно столько невосстанавливающих концов, сколько ветвей содержится в его молекуле, но восстанавливающий конец только один. При использовании гликогена в качестве источника энергии остатки глюкозы отщепляются от невосстанавливающих концов по одному. Ферменты, катализирующие распад гликогена, действуют только на невосстанавливающие концы, но могут одновременно разрушать несколько ветвей, что значительно ускоряет процесс превращения полимера в составляющие его моносахариды.
Почему же глюкоза не хранится в клетке в виде мономера? Расчеты показали, что запас гликогена в гепатоците соответствует концентрации глюкозы 0,4 М. Реальная концентрация нерастворимого гликогена составляет 0,01 мкМ (это означает, что его вклад в осмолярность цитозоля очень мал). Если бы в цитозоле содержалось 0,4 М глюкозы, то осмолярность стала бы угрожающе высокой и привела бы к проникновению в клетку воды, что могло привести к лизису клетки (рис. 2-12). Более того, при внутриклеточной концентрации глюкозы 0,4 М и внеклеточной концентрации около 5 мМ (такова концентрация глюкозы в крови у млекопитающих) изменение свободной энергии, соответствующее переносу глюкозы внутрь клетки против такого значительного градиента концентрации, было бы недопустимо велико.
Декстраны — полисахариды бактерий и дрожжей, построенные из остатков D-глюкозы, соединенных (α1 —> 6)-связями. Все декстраны имеют точки ветвления, в которых остатки соединены (α1 —> 3)-связями, а у некоторых декстранов, кроме того, встречаются разветвления с (α1—> 2) или (α1—> 4) тинами связи. Зубной камень, который образуют живущие на поверхности зубов бактерии, содержит большое количество декстранов. Синтетические декстраны используются в некоторых коммерческих продуктах, например, для производства носителей для гель-фильтрации (например, Sephadex) (рис. 3-17, б). В подобных продуктах декстраны с помощью химических методов подвергают перекрестной сшивке, в результате чего они представляют собой нерастворимые материалы с разной степенью пористости, что позволяет разделять макромолекулы разного размера.
Некоторые гомополисахариды выполняют структурную функцию
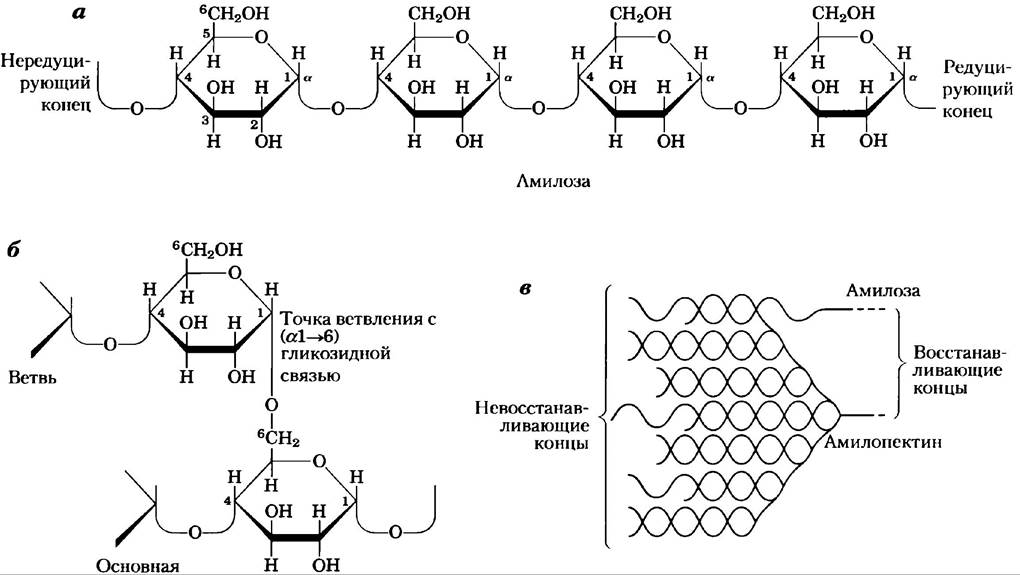
Целлюлоза — прочное, волокнистое, нерастворимое в воде вещество; она содержится в клеточных стенках растений, главным образом в стеблях травянистых растений и стволах, и ветвях деревьев. Целлюлоза является основным компонентом древесины, а хлопок состоит почти исключительно из целлюлозы. Подобно амилозе и главным цепям амилопектина и гликогена, целлюлоза представляет собой линейный неразветвленный гомополисахарид, состоящий из 10 000-15 000 остатков D-глюкозы. Но есть важное отличие: в целлюлозе гликозидные связи имеют β-конфигурадию (рис. 7-15), тогда как в амилозе, амилопектине и гликогене — α-конфигурацию. В целлюлозе остатки глюкозы связаны (β1—> 4)-связями, а в амилозе, крахмале и гликогене — (α1—> 4)-связями. Это и объясняет весьма существенные различия в структуре и физических свойствах целлюлозы и амилозы.
Рис. 7-15. Структура целлюлозы, а) Два мономерных звена целлюлозной цепи — остатки D-глюкозы, соединенные (β1—> 4)-связью. Звенья зафиксированы в конфигурации кресла, но могут поворачиваться друг относительно друга. б) Изображение в масштабе участков двух параллельных волокон целлюлозы, демонстрирующее конформацию остатков D-глокозы и наличие перекрестных водородных связей. В левом нижнем остатке гексозы изображены все атомы водорода; в трех других остатках атомы водорода, соединенные с углеродом, не показаны, чтобы не загромождать рисунок, поскольку они не участвуют в образовании водородных связей.
Гликоген и крахмал, попадающие в организм с пищей, расщепляются α-амилазами слюны и желудочно-кишечного тракта, которые разрывают (α1 —> 4)-гликозидные связи между остатками глюкозы. Что касается целлюлозы, то большинство животных не могут использовать ее в качестве пищи, поскольку в их организме нет фермента, расщепляющего (β1—> 4)-связи. Целлюлозу способны переваривать термиты, но эта их способность связана с тем, что в их желудочно-кишечном тракте обитает симбиотический микроорганизм Trichonympha, секретирующий целлюлазу, которая как раз и расщепляет (β1—> 4)-связи. Целлюлазу, кроме того, образуют некоторые грибы и бактерии, вызывающие гниение древесины (рис. 7-16).
Рис. 7-16. Разрушение целлюлозы древесными грибами. Фотография древесного гриба, растущего на дубовом пне. Все древесные грибы содержат фермент целлюлазу, расщепляющую (β1 —> 4) гликозидные связи в молекуле целлюлозы, поэтому древесина может служить для этих грибов источником метаболизируемых сахаров (глюкозы). Среди позвоночных только крупный рогатый скот и другие жвачные (козы, овцы, верблюды, жирафы) могут использовать в пищу целлюлозу. В дополнительных отделах желудка этих животных (в рубце) обитают бактерии и простейшие, секретирующие целлюлазу.

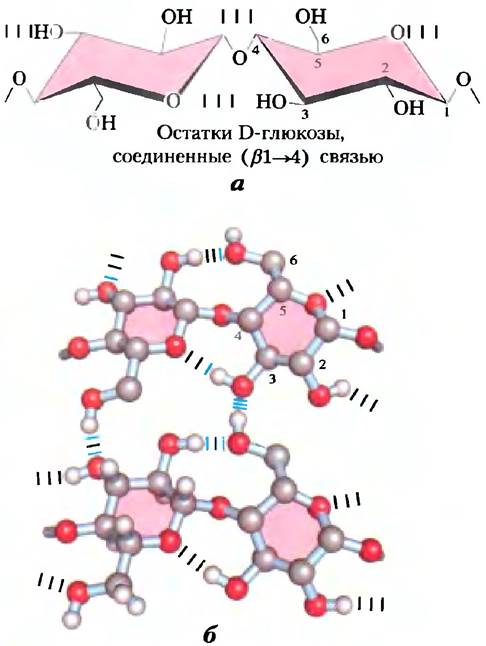
Хитин — линейный гомополисахарид, состоящий из остатков N-ацетилглюкозамина, соединенных β-гликозидными связями (рис. 7-17). Единственное отличие от целлюлозы состоит в том, что в данном полимере вместо гидроксильных групп у атомов углерода С-2 находятся ацетилированные аминогруппы. Хитин образует длинные волокна, напоминающие волокна целлюлозы; подобно целлюлозе, хитин не переваривается позвоночными животными. Хитин составляет основу прочного наружного скелета у приблизительно миллиона видов членистоногих: насекомых, омаров, крабов и, возможно, является вторым по распространенности природным полисахаридом после целлюлозы; примерно 1 млрд т хитина производится в биосфере ежегодно!
Рис. 7-17. Хитин, а) Короткий фрагмент молекулы хитина, состоящей из звеньев N-ацетил- D-глюкозамина, соединенных (β1—> 4)-гликозидными связями. б) Жук Pelidnotapunctata имеет прочный панцирь (внешний скелет) из хитина.
На трехмерную структуру гомополисахаридов влияют стерические факторы и образование водородных связей
Трехмерная структура полисахаридов формируется по тем же принципам, что и пространственная структура полипептидных цепей. Мономерные звенья, строение которых строго определяется ковалентными связями, образуют трехмерные макромолекулярные структуры, которые стабилизируются слабыми взаимодействиями внутри молекулы или между соседними молекулами: водородными связями, гидрофобными, ван-дер- ваальсовыми, а в полимерах, имеющих заряженные мономерные звенья, и электростатическими взаимодействиями. Поскольку полисахариды содержат множество гидроксильных групп, водородные связи оказывают особенно сильное влияние на их структуру. Гликоген, крахмал и целлюлоза, а также олигосахариды в составе гликопротеинов и гликолипидов, которые будут обсуждаться далее, построены из шестичленных кольцевых звеньев. Такие молекулы можно представить в виде серии жестких пиранозных колец, соединенных кислородным мостиком (гликозидной связью). Такая структура, в принципе, позволяет вращение относительно обеих С—О-связей между остатками (рис. 7-15, а). Однако подобно тому, как это происходит в полипептидах (рис. 4-2, 4-8), вращение вокруг каждой связи ограничено стерическими факторами, которые определяются структурой заместителей. Трехмерная структура этих молекул может быть описана с помощью значений двугранных углов φ и Ψ, образуемых гликозидной связью (рис. 7-18), по аналогии с углами φи Ψ, образуемыми пептидной связью (рис. 4-2).
Рис. 7-18. Конформация гликозидных связей в целлюлозе, амилозе и декстране. Полимеры изображены в виде жестких пиранозных колец, соединенных гликозидными связями, относительно которых возможно свободное вращение. Заметьте, что в молекуле декстрана, кроме того, возможно вращение вокруг связи, соединяющей атомы углерода С-5 и С-6 (торсионный угол со (омега)).
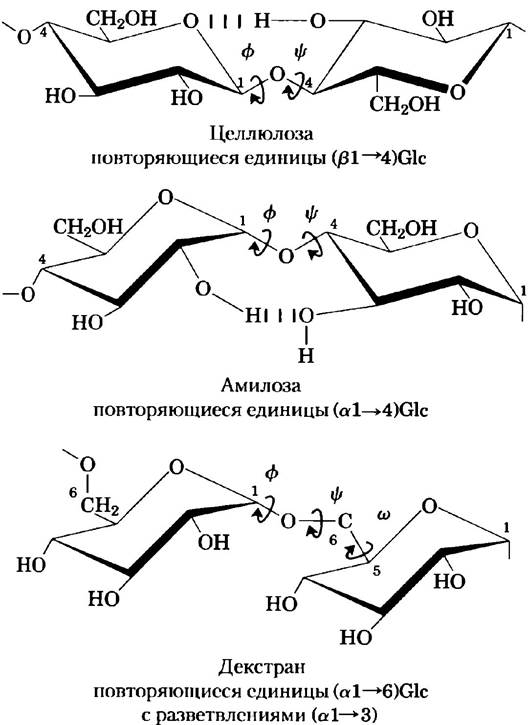
Специфическая форма и большой размер пиранозного кольца и заместителей в кольце накладывают ограничения на величины углов φи Ψ; некоторые конформации оказываются гораздо более устойчивыми, чем другие, что можно показать с помощью энергетической поверхности как функции φи Ψ (рис. 7-19).
Рис. 7-19. Карта разрешенных конформаций олигосахаридных и полисахаридных цепей. Торсионные углы φ и Ψ (рис. 7-18), определяющие пространственное взаиморасположение соседних колец, в принципе, могут принимать любые значения от 0 до 360°. В реальности некоторые значения углов соответствуют запрещенной по пространственным соображениям конформации, а другие, напротив, создают возможность для реализации максимального количества водородных связей, а) Если построить график энергии (Σ), соответствующий каждому значению φ и Ψ, и провести изоэнергетические контуры (линии, соответствующие одинаковым значениям энергии) с интервалами 1 ккал/моль, то можно определить, какие значения углов соответствуют предпочтительным конформациям. Эта карта аналогична карте Рамачандрана для пептидов (рис. 4-3,4-8). б) Два состояния дисахарида gal (β1 —>3) gal, соответствующие минимуму и максимуму энергии на диаграмме (а), помечены красным и синим кружками на карте. Красный кружок показывает наименее выгодную конформацию, синий — наиболее выгодную. Конформационные состояния трех полисахаридов, изображенных на рис. 7-18, были определены методом рентгеновской кристаллографии: все они соответствуют областям с низким уровнем энергии.
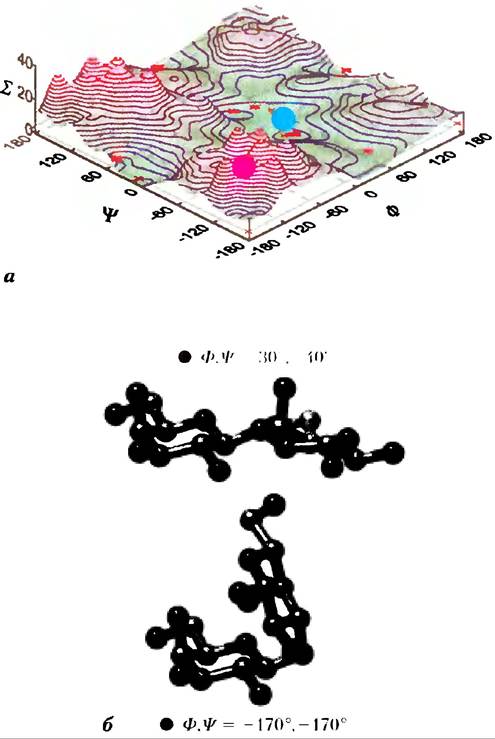
Наиболее устойчивой трехмерной структурой (α1 —> 4)-цепей крахмала и гликогена является плотно свернутая спираль (рис. 7-20), которая стабилизируется водородными связями внутри цепи. В случае амилозы, не имеющей разветвлений, такая структура оказывается настолько упорядоченной, что позволяет получать кристаллы этого вещества и исследовать его структуру методом рентгеновской дифракции. В среднем плоскость каждого остатка в цепи амилозы располагается по отношению к плоскости предыдущего остатка под углом 60°, так что в витке образующейся спирали содержится шесть остатков. Внутреннее пространство спирали амилозы имеет размер, который в точности подходит для размещения там комплексных иодид-ионов (I3- или I5-); реакция с иодом дает интенсивное синее окрашивание и используется в качестве стандартного количественного теста для определения амилозы.
Рис. 7-20. Структура крахмала (амилозы). а) В наиболее устойчивом состоянии полимерная цепь амилозы, состоящая из остатков, жестко зафиксированных в конформации кресла, образует спираль, что отличает ее от целлюлозы, образующей прямые протяженные волокна (рис. 7-16). б) Изображение участка спирали амилозы в масштабе. Благодаря наличию (α1 —> 4)-связей амилоза, амилопектин и гликоген приобретают сильно спирализованную компактную структуру. Эта структура является основой плотных запасных гранул крахмала и гликогена во многих клетках (рис. 7-14).
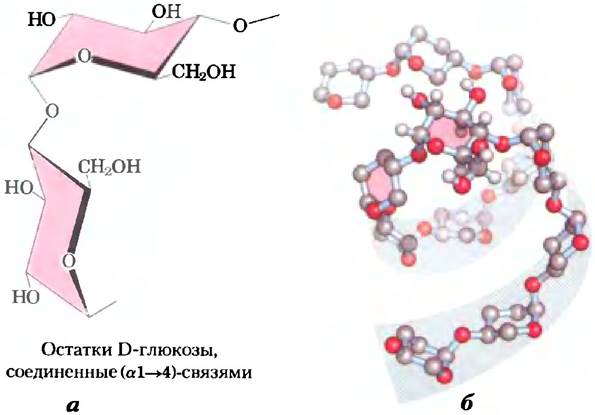
В наиболее устойчивой форме целлюлозы каждый остаток глюкозы в конформации кресла повернут по отношению к соседнему на 180°, в результате чего образуются протяженные прямые нити. Все гидроксильные группы молекулы доступны для образования водородных связей с соседними цепями. Сеть внутримолекулярных и межмолекулярных водородных связей между лежащими рядом цепями целлюлозы придает волокнам большую прочность (рис. 7-15, б). Данное свойство целлюлозы используется человеком на протяжении тысячелетий. Из целлюлозы состоят папирус, бумага, картон, вискоза, теплоизоляционная плитка и многие другие полезные материалы. Содержание воды в подобных материалах низкое, поскольку обширная сеть межмолекулярных водородных связей насыщает потребность молекул целлюлозы в образовании этих связей.
Клеточные стенки бактерий и водорослей содержат структурные гетерополисахариды
Каркас клеточных стенок бактерий (пептидогликан) образован гетерополимером из чередующихся звеньев N-ацетил глюкозами на и N-ацетилмурамовой кислоты, соединенных (β1—> 4)-связями (см. рис. 20-31). Линейные полимеры плотно уложены в клеточной стенке и удерживаются за счет коротких поперечных сшивок, образованных различными пептидами, тип которых зависит от вида бактерии. Пептидные сшивки объединяют полисахаридные цепи в прочный каркас, обволакивающий всю клетку и препятствующий ее разбуханию и лизису в случае притока в клетку воды. Фермент лизоцим вызывает гибель бактерий, поскольку гидролизует (β1 —> 4)- гликозидные связи между N-ацетил глюкозамином и N-ацетилмурамовой кислотой (см. рис. 6-24). Лизоцим присутствует в слезной жидкости, где выполняет защитную функцию, препятствуя проникновению инфекции. Некоторые вирусы бактерий образуют лизоцим, позволяющий им выходить из бактериальной клетки-хозяина (важный этап цикла развития вируса). Пенициллин и родственные ему антибиотики уничтожают бактерии, поскольку препятствуют синтезу перекрестных сшивок каркаса, в результате чего клеточная стенка не может противостоять осмотическому лизису (см. с. 314-316).
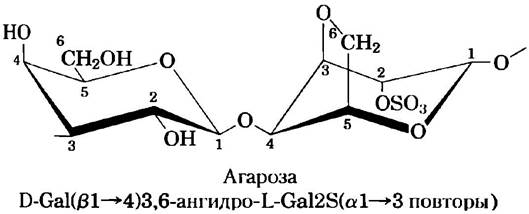
Клеточные стенки некоторых красных морских водорослей содержат агар — смесь сульфатированных гетерополисахаридов, состоящих из D-галактозы и производного L-галактозы, в котором атомы углерода С-3 и С-6 соединены эфирной связью (рис. 7-21). Два основных компонента агара — это неразветвленный полимер агароза (Мr ≈ 120 000) и разветвленный полимер агаропектин. Замечательное свойство агарозы образовывать гели широко используется в биохимических лабораториях. Если суспензию агарозы в воде нагреть, а затем охладить, то ее молекулы образуют двойную спираль: две параллельно ориентированные молекулы закручиваются одна вокруг другой, причем виток спирали содержит три остатка сахара, а центральную полость занимают молекулы воды. Такие структуры в свою очередь связываются друг с другом, образуя гель — трехмерную матрицу, удерживающую большое количество воды. Агарозные гели используются в качестве инертных носителей для электрофоретического разделения нуклеиновых кислот, в частности секвенирования ДНК (см. рис. 8-33). Агар применяют для изготовления твердых сред для выращивания колоний бактериальных клеток. Кроме того, из агара состоят оболочки капсул некоторых витаминов и лекарств; агар быстро растворяется в желудке и является метаболически инертным веществом.
Рис. 7-21. Структура агарозы. Повторяющиеся единицы молекулы агарозы состоят из остатков D-галактозы, связанных (β1 —> 4) связью с 3,6-ангидро-L-галактозой, в которой эфирная связь соединяет атомы углерода С-3 и С-6. Между собой эти структурные единицы соединены (α1—> 3)-гликозидными связями, в результате чего образуется полимер из 600-700 остатков. Некоторые остатки 3,6-ангидрогалактозы этерифицированы серной кислотой у атома углерода С-2, как показано на рисунке.
Гликозаминогликаны — гетерополисахариды внеклеточного матрикса
Внеклеточное пространство в тканях многоклеточных животных заполнено гелеобразным веществом, называемым внеклеточным матриксом или основным веществом, которое удерживает клетки вместе и обеспечивает структуру пор для проникновения питательных веществ и кислорода к отдельным клеткам. Внеклеточный матрикс (ВКМ), окружающий фибробласты и другие клетки соединительной ткани, представляет собой сложную сеть из гетерополисахаридов и фибриллярных белков, таких как коллаген, эластин и фибронектин. Базальная мембрана — это особый тип внеклеточного матрикса, расположенного под эпителиальными клетками; она состоит из специализированного коллагена, ламинина и гетерополисахаридов. Эти гетерополисахариды — гликозаминогликаны — образуют семейство линейных полимеров, построенных из повторяющихся дисахаридных звеньев (рис. 7-22). Гликозаминогликаны есть у животных и у бактерий, а в растениях они не обнаружены.
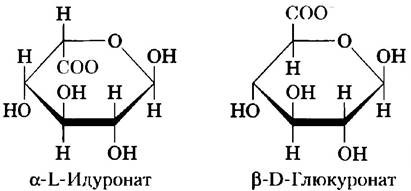
Один из двух моносахаридов — всегда либо N-ацетилглюкозамин, либо N-ацетилгалактозамин; вторым моносахаридом обычно является уроновая кислота — чаще всего D-глюкуроновая или L-идуроновая кислота. Некоторые гликозаминогликаны содержат этерифицированные сульфатные группы. Сочетание сульфатных и карбоксильных групп в остатках уроновых кислот создает на молекулах гликозаминогликанов высокую плотность отрицательных зарядов. Чтобы минимизировать отталкивание между соседними группами, молекулы в растворе принимают развернутую конформацию, образуя вытянутую спираль с расположенными на концах отрицательно заряженными карбоксилатными группами (как показано для гепарина на рис. 7-22). Вытянутая форма также дает возможность максимально развести в пространстве отрицательно заряженные сульфатные группы. Специфическое распределение сульфатированных и несульфатированных остатков сахаров в гликозаминогликанах позволяет за счет электростатических сил осуществлять связывание определенных белковых лигандов. Гликозаминогликаны связываются с внеклеточными белками и образуют протеогликаны (разд. 7.3).
Рис. 7-22. Повторяющиеся единицы в структуре некоторых гликозаминогликанов внеклеточного матрикса. Гликозаминогликаны представляют собой сополимеры, построенные из чередующихся остатков уроновых кислот и аминосахаров (за исключением кератансулъфата), которые могут быть сульфатированы по любому атому (кроме гиалуроновой кислоты). Ионизованные карбоксильные и сульфатные группы (выделены красным цветом на проекционных формулах) сообщают молекулам полимера характерный отрицательный заряд. Лекарственная форма гепарина в основном содержит идуроновую кислоту (IdоА) и небольшое количество глюкуроновой кислоты (GlсА; не показана); молекулы гепарина обычно сильно сульфатированы и гетерогенны по размеру. Пространственная модель, изображающая участок гепарина в том состоянии, в котором он находится в растворе (по данным ЯМР-спектроскопии; РDВ ID 1HРN). Атомы углерода идуроновой кислоты изображены синими, а атомы углерода глюкозамина — зелеными. Атомы кислорода и серы, как всегда, изображены соответственно красными и желтыми. Для простоты атомы водорода не показаны. Гепарансульфат (не показан) похож на гепарин, но имеет более высокое содержание GlсА и меньше сульфатных групп, которые распределены менее регулярным образом.
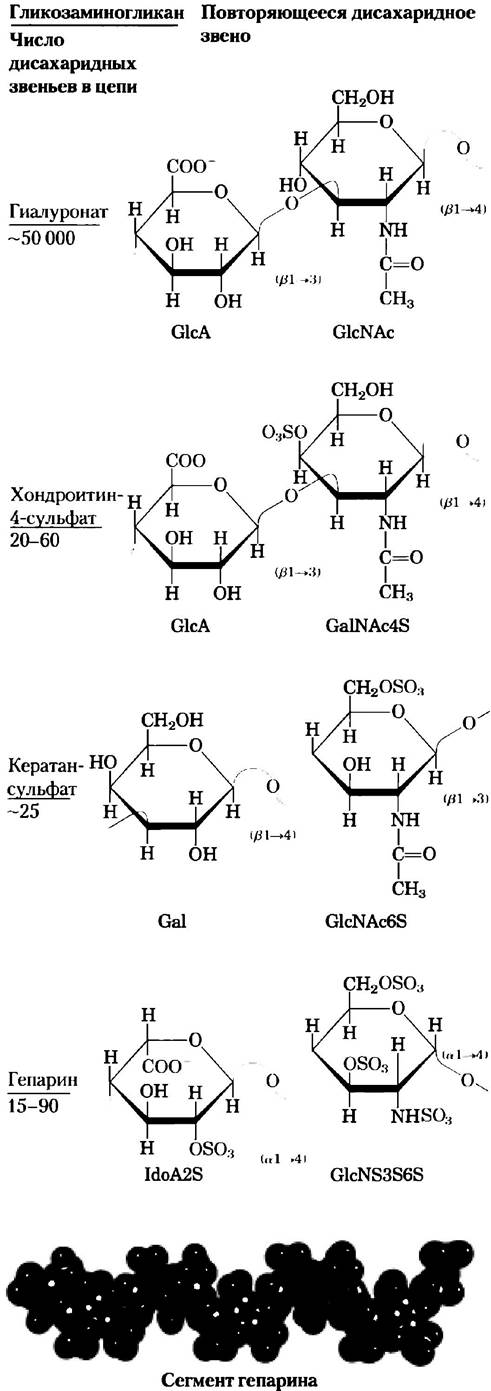
Гликозаминогликан гиалуроновая кислота (при физиологических значениях pH находится в форме гиалуропата) состоит из чередующихся звеньев D-глюкуроновой кислоты и N-ацетил- глюкозамина (рис. 7-22). Гиатуронаты содержат до 50 000 основных дисахаридных звеньев и имеют молекулярную массу свыше 1 млн Да. Эти вещества образуют прозрачные и очень вязкие среды, входящие в состав синовиальной жидкости, где служат в качестве смазки суставов, а также в состав стекловидного тела глаза позвоночных, придавая ему желеобразную консистенцию (от греч. hyalos — стекло; растворы гиалуронатов имеют прозрачный или полупрозрачный вид). Гиалуронаты, кроме того, являются важной составляющей внеклеточного матрикса хрящей и сухожилий, которым они придают прочность и эластичность, поскольку взаимодействуют с другими компонентами матрикса. Некоторые патогенные бактерии секретируют фермент гиалуронидазу, способную расщеплять гликозидные связи гиалуроната, что делает ткани более уязвимыми для бактериальной инфекции. У многих организмов похожий фермент, содержащийся в сперматозоидах, гидролизует внешнюю гликозаминогликановую оболочку яйцеклеток и позволяет сперматозоидам проникнуть внутрь.
Другие гликозаминогликаны отличаются от гиалуронатов по трем признакам: во-первых, их размеры гораздо меньше; во-вторых, они связаны ковалентной связью со специфическими белками, образуя протеогликаны; в-третьих, один или оба их мономера отличаются от мономеров гиалуроната. Хондроитинсульфат (от греч. chondros — хрящ) придает прочность хрящам, сухожилиям, связкам и стенкам аорты. Дерматансульфат (от греч. derma — кожа) определяет эластичность кожи, а также кровеносных сосудов и клапанов сердца. В этом полимере многие остатки глюкуроната (GlcA), присутствующие в хондроитине, заменены 5-эпимером — L-идуронатом (IdoA).
Кератансульфаты (от греч. kerns — рог) не содержат уроновой кислоты, а количество сульфатированных групп в них колеблется. Они обнаружены в роговице глаза, хрящах, костях, а также многих ороговевших структурах, образованных отмершими клетками: рогах, волосах, копытах, ногтях и когтях. Гепарансульфат (от греч. hepar — печень) синтезируется всеми животными клетками и содержит сульфатированные и несульфатированные сахара в различном сочетании. Сульфатированные участки цепи позволяют гепарину взаимодействовать с разными белками, включая факторы роста и компоненты ВКМ, а также с ферментами и факторами, присутствующими в плазме крови. Гепарин — фракционированная форма гепарансульфата, выделяемая в основном из тучных клеток (тип лейкоцитов). Гепарин является лекарственным препаратом, который используют для предотвращения свертывания крови, используя его способность связываться с ингибитором протеиназ антитромбином. Связывание с гепарином заставляет антитромбин связывать и ингибировать тромбин протеазу, играющую важную роль в свертывании крови. Взаимодействие гепарина с антитромбином осуществляется за счет электростатических сил; молекула гепарина несет на себе высокий отрицательный заряд, плотность которого превышает плотность заряда всех других известных биологических молекул (рис. 7-23). Очищенный гепарин добавляют в образцы крови при проведении клинических анализов, а также в донорскую кровь для предотвращения свертывания. В табл. 7-2 суммированы данные по составу, свойствам, биологической роли и распространению полисахаридов, описанных в разд. 7.2.
Рис. 7-23. Взаимодействие между гликозаминогликаном и белком. Показана структура образца, полученного путем сокристаллизации фактора роста фибробластов (ФРФ1), его клеточного рецептора и короткого фрагмента гликозаминогликана (гепарина) (PDB ID 1Е00). На данном рисунке использовано сплошное изображение поверхностей белков, причем цвет отражает распределение электрического заряда: красный цвет означает преимущественно отрицательный заряд, а синий — преимущественно положительный заряд. Гепарин изображен в виде шаростержневой модели; отрицательно заряженные группы гепарина (-SO3- и -СОO-) связаны с положительно заряженной (синей) областью в молекуле белка. В данном эксперименте использовали гепарин, но в реакции in vivo с ФРФ связывается гепарансульфат.
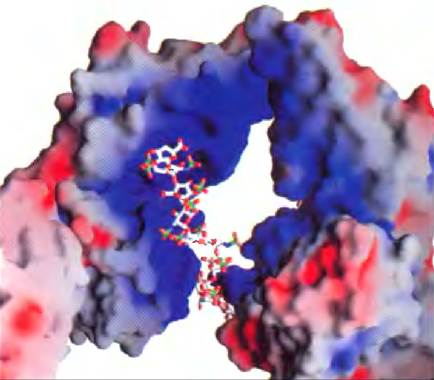
Таблица 7-2. Структура и роль некоторых полисахаридов
Полимер |
Тип* |
Повторяющееся звено** |
Размер (число моносахаридных звеньев) |
Биологическая функция |
Крахмал Амилоза Амилопектин |
Гомо- Гомо- |
(α1 —> 4)Glс, линейный (α1—4)Glc с (α1—> 6)Glcразветвлениями через каждые 24-30 остатков |
50-5000 До 106 |
Запас энергии в клетках растений |
Гликоген |
Гомо- |
(α1 —> 4)Glc с (α1—> 6)Glc разветвлениями через каждые 8-12 остатков |
До 50 000 |
Запас энергии в бактериальных и животных клетках |
Целлюлоза |
Гомо- |
(β1 —> 4)Glc |
До 15 000 |
Структурная: придает жесткость и прочность клеточным стенкам растений |
Хитин |
Гомо- |
(β1 —> 4)GlcNAc |
Очень большой |
Структурная:обеспечивает прочность внешнего скелета насекомых, паукообразных и ракообразных |
Декстран |
Гомо- |
(α1 —> 6)Glc с разветвлениями (α1 —> 3) |
Изменяется в широком диапазоне |
Структурная: адгезия бактериальных клеток |
Пеитидогликан |
Гегеро-; связан с пептидами |
Мur2Ас(β1 —> 4)GlcNAc |
Очень большой |
Структурная: придает жесткость и прочность оболочке бактериальной клетки |
Агароза |
Гегеро- |
D-Gal(β1 —> 4)3,6- ангидро-L-Gal(α1—3) |
1000 |
Структурная: входит в состав клеточной стенки водорослей |
Гиалуронат (гликоз- аминогликан) |
Гетеро-; кислый |
Gle(β1 —> 3)GleNAe(β1—> 4) |
До 100 000 |
Структурная:внеклеточный матрикс кожи и соединительных тканей, смазка суставов позвоночных |
* Каждый полимер классифицирован как гомополисахарид (гомо-) или гетерополисахарид (гетеро-).
** Сокращенные названия структурной единицы пептидогликана, агарозы и гиалуроната указывают на то, что их полимеры состоят из дисахаридов. Например, в пептидогликане остаток GleNAc одного дисахарида связан (β1—> 4)-связью с первым остатком следующего дисахарида.
Краткое содержание раздела 7.2 Полисахариды
■ Полисахариды (гликаны) служат для хранения энергии и в качестве структурных компонентов клеточной стенки и внеклеточного матрикса.
■ Гомополисахариды крахмал и гликоген запасают энергию в клетках растений, животных и бактерий. Они состоят из остатков D-глюкозы, соединенных (β1 —> 4)-связями, и имеют разветвленное строение.
■ Гомополисахариды целлюлоза, хитин и декстран играют структурную роль. Целлюлоза, построенная их остатков D-глюкозы, соединенных (β1—>4)-связями, придает прочность и жесткость клеточным стенкам растений. Хитин, состоящий из остатков N-ацетил- глюкозамина, соединенных (β1 —> 4)-связями, служит основой внешнего скелета членистоногих. Декстран формирует капсулу вокруг некоторых бактериальных клеток.
■ Гомополисахариды имеют трехмерную структуру. Конформация кресла, в которой существует пиранозное кольцо, является очень жесткой, так что структура полимеров определяется возможностью вращения вокруг связей кислорода с аномерными атомами углерода. Крахмал и гликоген образуют спиральную структуру, которая удерживается большим количеством водородных связей. Целлюлоза и хитин образуют протяженные прямые нити, взаимодействующие посредством водородных связей с соседними нитями.
■ Прочность клеточных стенок бактерий и водорослей объясняется наличием в них гетеронолисахаридов — пептидогликанов у бактерий и агара у красных водорослей. Повторяющееся дисахаридное звено пептидогликана имеет структуру Мur2Ас (β1 —> 4) GlсNAс, а звено агарозы — D-Gаl (β1 —> 4) 3,6-ангидро-L-Gal.
■ Гликозаминогликаны — это внеклеточные гетероиолисахариды, в которых одной из двух моносахаридных единиц является уроновая кислота, а второй — N-ацетилированный аминосахар. Некоторые гидроксильные группы этих полимеров и аминогруппы некоторых остатов глюкозамина сульфатированы, что придает им большой отрицательный заряд и заставляет принимать развернутую конформацию. Подобные полимеры (гиалуронат, хондроитин- сульфат, дерматансульфат, кератансульфат и гепарин) обеспечивают вязкость, адгезивность и прочность внеклеточного матрикса.