ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 1. ОСНОВЫ БИОХИМИИ СТРОЕНИЕ И КАТАЛИЗ - 2011
ЧАСТЬ I. СТРОЕНИЕ И КАТАЛИЗ
9. ТЕХНОЛОГИЯ НА ОСНОВЕ ИНФОРМАЦИИ ИЗ ДНК
9.4. Изменения генома и новые продукты биотехнологии
Не надо заглядывать в далекое будущее, чтобы найти практические применения новых биотехнологий или увидеть перспективы новых открытий в фундаментальной науке. Геномика сама подает идеи и берется за их осуществление. Мы не только можем понять строение геномов, мы можем их изменять. Пожалуй, эта возможность является наивысшим достижением современных технологий. Мы расширим наши возможности управления организмами и получения новых фармацевтических агентов и, следовательно, улучшим питание и здоровье человека. Такие перспективы можно осуществить только в том случае, если на практике будут соблюдаться меры предосторожности во избежание безответственного применения новых технологий.
Бактериальные паразиты растений способствуют клонированию в растениях
Введение рекомбинантной ДНК в растения имеет огромное значение для сельского хозяйства, позволяя изменять питательные характеристики и урожаи культур или их устойчивость к воздействиям окружающей среды, например, насекомым-вредителям, заболеваниям, холоду, засоленности почв и засухе. Взрослые растения некоторых видов можно создать из единственной трансформированной клетки, так чтобы введенный ген переходил к потомкам в семенах.
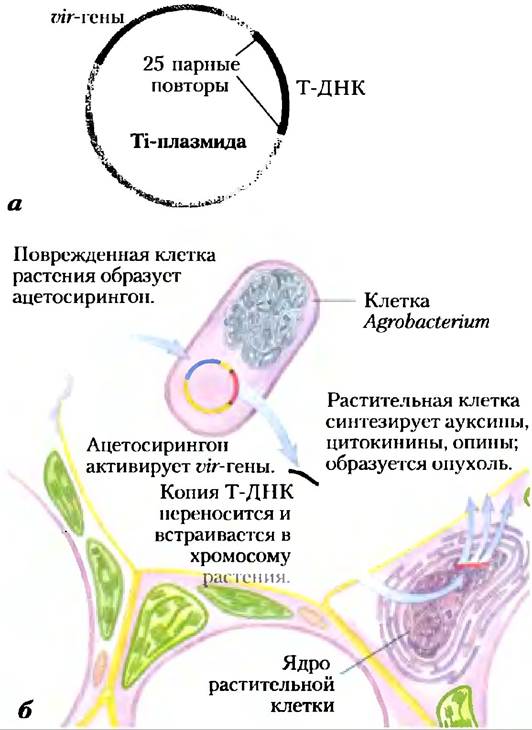
Ученые пока не обнаружили встречающихся в природе плазмид растительных клеток, способствующих клонированию в растениях, поэтому основная техническая проблема заключается во введении ДНК в растительные клетки. Эта проблема была решена при помощи почвенной бактерии Agrobacterium tumefaciens. Эта бактерия способна поражать растения в месте повреждения, трансформировать соседние клетки и вызывать образование опухоли под названием корончатый галл. Клетка Agrobacterium содержит огромную (200 000 п. н.) Ti-плазмиду (рис. 9-26, а). При контакте бактерии с поврежденной клеткой растения 23000 п. н. сегмента Ti-плазмиды под названием Т-ДНК переносятся из плазмиды и встраиваются в произвольном месте одной из хромосом клетки растения (рис. 9-26, б). Перенос Т-ДНК из Agrobacterium в хромосому растительной клетки зависит от повторов длиной в 25 п. н. на концах Т-ДНК и от продуктов генов вирулентности (vir) в Ti-плазмиде (рис. 9-26, а).
Рис. 9-26. Перенос ДНК растительным клеткам с помощью бактерии-паразита. а) Ti-плазмида (от англ. tumor inducing) Agrobacterium tumefaciens. 6) Поврежденные растительные клетки образуют и высвобождают фенольное соединение ацетосирингон. При обнаружении этого соединения у р. Agrobacterium начинается экспрессия генов вирулентности (vir) Ti-плазмиды. Эти vir-гены кодируют ферменты, необходимые для встраивания сегмента Т-ДНК Ti-плазмиды в геном соседних растительных клеток. Образуется одноцепочечная копия Т-ДНК, которая переносится в растительную клетку, где превращается в двуцепочечную ДНК и встраивается в ее хромосому. Т-ДНК кодирует ферменты, синтезирующие как гормоны роста растения, так и опины (рис. 9-27). Последние соединения усваиваются (в качестве источника питания) только бактериями р. Agrobacterium. Таким образом, экспрессия генов Т-ДНК в трансформированных растительных клетках приводит как к аберрантному росту клеток растения (образование опухоли), так и к передаче бактерии питательных веществ растительной клетки.
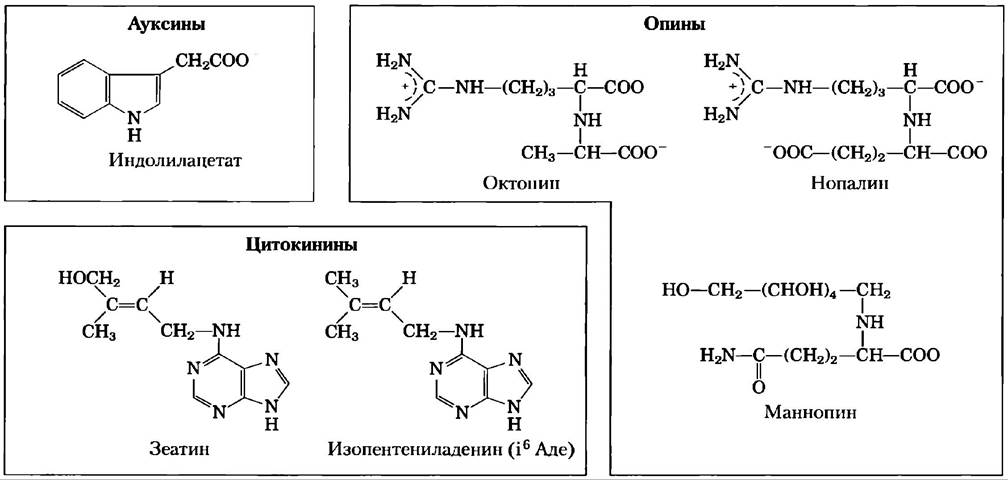
Т-ДНК кодирует ферменты, которые преобразуют растительные метаболиты в два класса соединений, выгодных бактерии (рис. 9-27). Во-первых, это гормоны роста растения (ауксины и цитокинины), стимулирующих рост трансформированных растительных клеток с образованием опухоли — корончатого галла. Во-вторых, это ряд редких аминокислот, названных овинами, которые служат в качестве источника питания для бактерии. В клетках опухоли онины образуются в больших количествах и секретируются в окружающую среду, где усвоить их может только Agrobacterium, используя ферменты, кодируемые в Тi-плазмиде. Таким образом, бактерия перенаправляет ресурсы растения, преобразуя их в форму, которая устраивает только ее саму.
Рис. 9-27. Метаболиты, образующиеся в растительных клетках, инфицированных бактерией р. Agrobacterium. Ауксины и цитокинины — гормоны роста растения. Наиболее распространенный ауксин, индолилацетат, синтезируется из триптофана. Цитокинины являются производными аденина. Опины обычно образуются из предшественников аминокислот; ферментами, кодируемыми Ti-плазмидами разных видов р. Agrobacterium, создается, по крайней мере, 14 различных опинов.
Этот необыкновенный пример передачи ДНК из прокариотической клетки в эукариотическую — природный генно-инженерный процесс, который исследователи могут использовать для передачи рекомбинантной ДНК (вместо Т-ДНК) геному растения. В распространенной методике клонирования используют колонии бактерии р. Agrobacterium с двумя разными рекомбинантными плазмидами. Первая — это Тi-плазмида, у которой искусственно удален сегмент Т-ДНК (рис. 9-28, а). Вторая — шаттл-вектор Agrobacterium-Е. соli, у которого повторы Т-ДНК в 25 п. н. фланкируют чужеродный ген, который нужно поместить в растительную клетку, вместе с селектируемым маркером, например, геном устойчивости к антибиотику канамицину (рис. 9-28, б). Сконструированная таким образом культура Аgrobacterium используется для инфицирования листа растения, но корончатые галлы не образуются из-за того, что из обеих плазмид удалены Т-ДНК гены ферментов биосинтеза ауксинов, цитокининов и опинов. Вместо этого продукты vir-гена из измененной Тi-плазмиды направляют трансформацию растительных клеток чужеродным геном, который фланкируется Т-ДНК повторами в 25 и. н. во второй плазмиде. Трансформированные клетки растений можно отобрать при выращивании на чашках с агаром, содержащих канамицин, а добавление гормонов роста ускорит образование новых растений с чужеродным геном в каждой клетке.
Рис. 9-28. Двухплазмидный метод создания рекомбинантных растений, а) Одна из плазмид — это модифицированная Тi-плазмида, которая содержит vir-гены, но не Т-ДНК. б) Другая плазмида содержит сегмент ДНК, несущий как чужеродный ген (интересующий ген, например, инсектицидного белка, изображенного на рис. 9-30), так и фактор устойчивости к антибиотику (в данном случае к канамицину), который фланкируется двумя Т-ДНК повторами в 25 п. н., необходимыми для передачи плазмидных генов хромосоме растения. В плазмиде также присутствует локус начала репликации (ori), необходимый для размножения бактерии р. Аgrobacterium.

Когда бактерия попадает в место повреждения (на границу разрезанного листа), vir-гены первой плазмиды опосредуют передачу геному растения сегмента второй плазмиды, который фланкируется повторами в 25 п. н. Фрагменты листа помещают на чашку с агаром, содержащую и канамицин, и соответствующие количества гормонов роста растения; таким образом из фрагментов с трансформированными клетками формируются новые растения, Нетрансформированные клетки уничтожаются канамицином. Чужеродный ген и фактор устойчивости к антибиотику обычно передаются вместе, так что клетки растения, которые растут в такой среде, как правило, содержат интересующий ген.
Успешный перенос рекомбинантной ДНК растениям был отчетливо продемонстрирован в эксперименте по встраиванию гена люциферазы светляка в клетки табака (рис. 9-29) — наиболее удобного растения для экспериментов по трансформации, так как его клетки чрезвычайно легко трансформировать клетками Аgrobacterium. Безусловно, возможности этой технологии не ограничиваются созданием светящихся в темноте растений. Такой же метод использовался для создания сельскохозяйственных культур, устойчивых к гербицидам, растительным вирусам и насекомым-вредителям (рис. 9-30). Возможная выгода заключается в повышении урожайности и снижении необходимости применения вредных для окружающей среды сельскохозяйственных химикатов.
Рис. 9-29. Растение табака, экспрессирующее ген люциферазы светляка. Свечение возникало после полива растения раствором люциферина, субстратом фермента люциферазы, вызывающего биолюминесценцию (см. доп. 13-1). Однако светящихся в темноте декоративных растений в наших рассадниках ожидать в скором времени не приходится. В действительности испускаемый свет довольно слаб; для получения приведенной фотографии потребовалась 24-часовая экспозиция. Однако таким образом демонстрируется истинное значение этой технологии, заключающееся в возможности передачи растениям новых свойств.

Рис. 9-30. Томаты, устойчивые к личинкам насекомых. Два растения томата подвергались воздействию одинакового числа личинок мотылька. Растение слева не было генетически измененным. В растении справа экспрессируется ген белка токсина из бактерии Bacillus thuringiensis. Этот белок, встроенный по схеме, приведенной на рис. 9-28, токсичен для личинок некоторых видов бабочек и безопасен для людей и других организмов. Устойчивость к насекомым была также генетически создана у хлопка и у других растений.

Биотехнология позволяет придавать растениям новые свойства намного быстрее традиционных методов селекции. Ярким примером является разведение сои, устойчивой к распространенному гербициду глифосату (активному ингредиенту в продукте RoundUp). Глифосат быстро распадается в окружающей среде (чувствительные к глифосату растения можно сеять на обработанной территории уже через 48 ч), и его применение обычно не приводит к загрязнению грунтовых вод или к сохранению остатков до следующего года. Поля с устойчивой к глифосату соей можно один раз обработать этим гербицидом во время летнего посевного периода для уничтожения практически всех сорняков на поле, не воздействуя при этом на саму сою (рис. 9-31). Однако возможные «подводные камни» технологии, например, появление устойчивых к глифосату сорняков или одичание трудноконтролируемых рекомбинантных растений, вызывают беспокойство ученых и общественности.
Рис. 9-31. Устойчивые к глифосату побеги сои. Два участка соевого поля в шт. Висконсин, США. а) Часть поля, не обработанная глифосатом, заросла сорняками, б) Устойчивые к глифосату соевые побеги бурно растут на обработанной этим гербицидом области поля. В окружающей среде глифосат быстро распадается. Использование в сельском хозяйстве генетически модифицированных растений, подобных этим, произойдет только после тщательного рассмотрения всех «за» и «против», уравновешивая исключительные перспективы новой технологии с необходимостью осмотрительного выбора новых свойств. И наука, и общество в целом заинтересованы в том, чтобы использование генетически модифицированных растений не оказало неблагоприятного воздействия на окружающую среду или здоровье человека.

Манипулирование с геномами клеток животных дает информацию о структуре хромосом и экспрессии генов
Трансформация клеток животных чужеродным генетическим материалом предоставляет нс только возможность расширения наших знаний о структуре и работе их геномов, но и важный способ выведения пород животных с новыми качествами. Такая перспектива стимулировала интенсивные исследования более совершенных методов клонирования животных.
Для большинства работ такого рода требуется источник клеток, в которые можно встроить ДНК. Несмотря на то что интактные ткани зачастую трудно сохранять и работать с ними in vitro, многие типы клеток животных можно выделить и вырастить в лабораторных условиях в том случае, если требования для их роста тщательно выполняются. Клетки, полученные из определенной ткани животного и выращиваемые в соответствующих для культуры ткани условиях, могут сохранять дифференцировку (например, гепатоциты (клетки печени) остаются гепатоцитами) в течение недель или даже месяцев.
Для введения ДНК в клетки животных не найдено подходящего вектора, подобного плазмидам, поэтому для трансформации, как пра
вило, требуется встраивание ДНК в хромосому клетки-хозяина. Эффективная доставка ДНК до клеточного ядра и встраивание этой ДНК в хромосому без повреждения каких бы то ни было важных генов остаются основной технической проблемой в генной инженерии клеток животных.
Разработанные методы переноса ДНК в клетку животного различаются по своей эффективности и удобству. Некоторый успех был достигнут в спонтанном введении ДНК или электропорации (эти методы отдаленно напоминают распространенные методы трансформации бактерий). Однако они неэффективны для клеток животных: трансформируется всего 1 из 100-10000 клеток. Микроинъекция — инъекция ДНК прямо в ядро при использовании очень тонкой иглы — обладает высокой результативностью в умелых руках, однако общее число клеток, которые можно обработать, невелико, потому что ДНК нужно вводить в каждую клетку по отдельности.
Самые эффективные и распространенные методы трансформации клеток животных основаны на липосомах или вирусных векторах. Липосомы представляют собой маленькие частицы, состоящие из липидного бислоя с заключенной внутри водой (см. рис. 11-4). Липосомы, несущие в себе молекулу рекомбинантной ДНК, можно слить с мембранами интересующих клеток, чтобы доставить ДНК внутрь. Иногда ДНК достигает ядра, где она может встроиться в хромосому (чаще всего в случайных положениях). Вирусные векторы еще более эффективны в доставке ДНК. У вирусов животных есть эффективные механизмы введения своих нуклеиновых кислот в клетки, а у некоторых видов также имеются механизмы встраивания своих ДНК в хромосому клетки-хозяина. Некоторые из них, например, ретровирусы (см. рис. 26-33) и аденовирусы, были модифицированы для работы в качестве вирусных векторов для встраивания чужеродных ДНК в клетки млекопитающих.
Использование ретровирусов иллюстрирует рис. 9-32. При попадании специально сконструированного ретровируса в клетку его РНК-геном транскрибируется в ДНК обратной транскриптазой, а затем встраивается в геном хозяина с помощью фермента вирусной интегразы. Для такой процедуры нужны особые участки ДНК: длинные повторяющиеся последовательности на концах (LTR-последовательности, от англ. long terminal repeat sequences) для встраивания ретровирусной ДНК в хромосому хозяина и Ψ (пси)-подпоследовательность для упаковки вирусной ДНК в вирусных частицах (см. рис. 26-34).
Рис. 9-32. Использование ретровирусных векторов в клонировании клеток млекопитающих. Типичный геном ретровируса (здесь приведен в несколько упрощенном виде), сконструированный так, чтобы нести чужеродный ген (окрашен в розовый цвет), добавляется в тканевую культуру клеток-хозяев. У вспомогательного вируса (здесь не показан) отсутствует упаковочная последовательность, Ψ, так что его РНК-транскрипты не могут упаковаться в вирусные частицы, но зато он предоставляет продукты генов gag, pol и еnv, необходимые для упаковки сконструированного ретровируса в функциональные вирусные частицы. Это дает возможность чужеродному гену, находящемуся в геноме рекомбинантного ретровируса, эффективно встроиться в клетки-мишени.
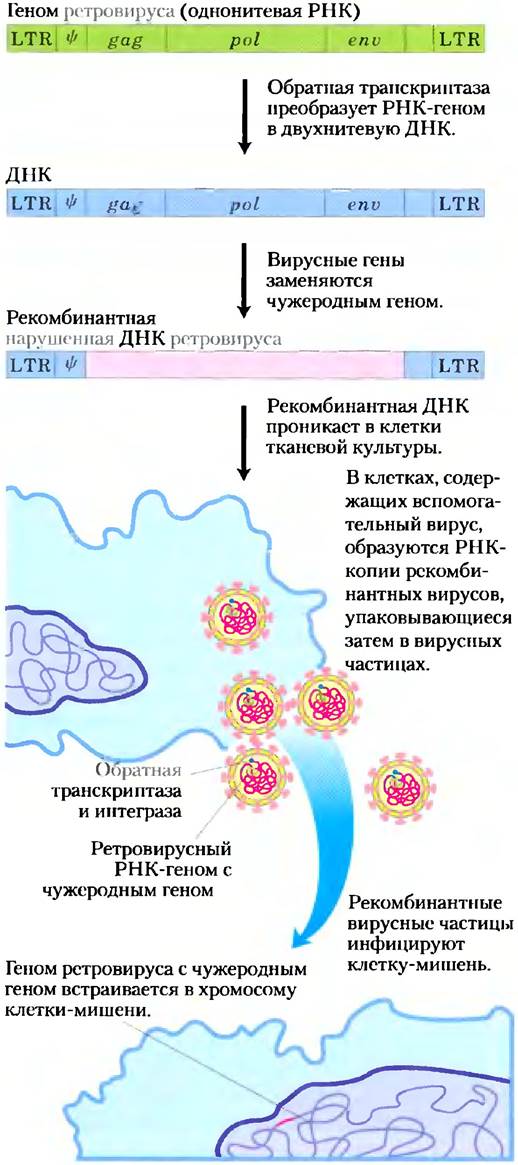
Гены gag, pol и еnv генома ретровируса, необходимые для его репликации и образования вирусных частиц, можно заменить чужеродной ДНК. Для образования вирусов с рекомбинантной генетической информацией необходимо ввести ДНК в культивированные клетки, инфицированные «вспомогательным вирусом», несущим гены для образования вирусных частиц, но не имеющим Ψ-последовательности, необходимой для упаковки. Таким образом удается транскрибировать ДНК и упаковывать ее РНК в вирусные частицы. Эти частицы могут действовать как векторы для введения рекомбинантной РНК в клетки-мишени. Вирусные ферменты обратная транскриптаза и интеграза (образующиеся с помощью вспомогательного вируса) тоже упаковываются в вирусную частицу и попадают в клетки-мишени. Как только специально сконструированный вирусный геном оказывается внутри клетки, эти ферменты создают ДНК-копию рекомбинантного вирусного РНК-генома и встраивают ее в хромосому хозяина. После этого встроенная рекомбинантная ДНК становится постоянной частью хромосомы клетки-мишени и реплицируется вместе с ней при каждом делении клетки. Сами по себе клетки не подвергаются опасности при встраивании вирусной ДНК, поскольку рекомбинантный вирус не содержит генов, необходимых для создания РНК-копий своего генома и упаковки их в новые вирусные частицы. Применение рекомбинантных ретровирусов зачастую является наилучшим способом введения ДНК в значительное число клеток млекопитающих.
МЕДИЦИНА. Геном человека и генная терапия человека
Как только биотехнология получила сильный толчок в 1980-х гг., стала весьма заманчивой идея профилактики генетических заболеваний. В принципе, в клетки человека можно ввести ДНК для корректировки наследственных генетических нарушений. Генетическую коррекцию можно даже осуществить на уровне отдельной ткани, заразив человека генетически сконструированным, тканеспецифичным вирусом, несущим в качестве полезного груза ДНК, которую нужно ввести в дефектные клетки. Такая задача выглядит чарующе, но на пути исследований полно преград.
Изменение хромосомной ДНК влечет за собой существенный риск — риск, который нельзя оценить на ранних стадиях открытия. В связи с этим первые попытки генной терапии человека были направлены всего лишь на небольшое число генетических заболеваний. Ученые и борцы за нравственность вместе разработали список из нескольких условий, которые должны быть соблюдены для оправдания сопутствующего риска. (1) Генетический дефект должен являться хорошо изученным нарушением в единственном гене. (2) И мутантный, и нормальный гены должны быть клонированы и секвенированы. (3) При отсутствии способа устранения существующего мутантного гена функциональный ген должен хорошо работать в присутствии мутантного. (4) Наконец, что наиболее важно, серьезность заболевания должна перевешивать риски, свойственные новой технологии. Соглашения по клиническим испытаниям на человеке были представлены учеными из нескольких стран и критически рассмотрены на предмет соответствия нормам этики и соблюдения научной строгости тщательно подобранными консультативными группами в каждой стране; только после этого испытания на человеке начались.
С самого начала генная терапия была нацелена на раковые и генетические заболевания, оказывающие воздействие на иммунную систему. Иммунитет контролируется лейкоцитами (белыми клетками крови) нескольких типов, берущих свое начало из недифференцированных стволовых клеток костного мозга. Эти клетки быстро делятся и обладают некоторыми метаболическими особенностями. По нескольким причинам дифференцировка может остановиться, приводя к состоянию под названием тяжелый комбинированный иммунодефицит (SCID, от англ. severe combined immune deficiency). Одна из форм SCID возникает из-за наследственных генетических нарушений в гене, кодирующем аденозиндезаминазу (ADA, от англ. adenosine deaminase), фермент, участвующий в биосинтезе нуклеотидов (обсуждается в гл. 22). Другая форма SCID возникает из-за дефекта в белке рецептора клеточной поверхности, связывающего сигнальные молекулы цитокины, запускающие дифференцировку. В обоих случаях стволовые клетки-предшественники не могут дифференцироваться в готовые клетки иммунной системы, такие как Т- и В-лимфоциты (см. с. 249). Дети с такими редкими заболеваниями чрезвычайно восприимчивы к бактериальным и вирусным инфекциям и очень часто страдают от целого ряда связанных с этим физиологических и неврологических проблем. В отсутствие эффективной терапии дети должны содержаться в стерильной обстановке. Примерно у 20% таких детей есть брат или сестра с идентичным антигеном лейкоцитов человека (HLA, от англ. human leukocyte antigen), который может служить донором при пересадке костного мозга. Для остальных детей нужны другие подходы.
Самая первая попытка генной терапии человека была осуществлена в Национальном институте здоровья в Бетесде, шт. Мэриленд, в 1990 г. Пациентом была четырехлетняя девочка, страдающая ADA- дефицитом. Клетки костного мозга ребенка трансформировали специально созданным ретровирусом, несущим функциональный ADA-ген; когда изменение клеток происходит таким образом — правда, в лаборатории, а не на живом пациенте, — говорят, что процедура осуществлена ex vivo. Обработанные клетки вводили обратно в костный мозг пациента. Через 4 года ребенок вел уже нормальную жизнь, ходил в школу и даже торжественно заявлял о своих переживаниях перед Конгрессом. Тем не менее восстановление девочки нельзя целиком приписать генной терапии. Перед началом клинических испытаний метода генной терапии исследователи разработали новый метод лечения недостатка ADA, в котором синтетическая аденозиндезаминаза вводилась в комплексе с полиэтиленгликолем (PEG, от англ. polyethylene glycol). Для многих пациентов с ADA-SCID введение комплекса ADA-PEG позволяет начать развитие иммунной системы наряду с увеличением массы тела и понижением частоты инфекционных заболеваний, хотя и не приводит к полному ее восстановлению.
Успешность новой генной терапии не была очевидна, поэтому отказываться от практики введения фермента в виде комплекса с PEG при проведении генно- терапевтического испытания было неэтично. Таким образом, участники испытаний получали сразу оба метода лечения, и было непонятно, какой из них в первую очередь стоит за положительными клиническими результатами. Тем не менее клиническое испытание предоставило ценную информацию: передача генов ex vivo большому числу лейкоцитов осуществима, причем клетки с перенесенным геном все еще наблюдались и через несколько лет после лечения, что означает возможность долговременной коррекции. Кроме того, риск, связанный с использованием ретровирусных векторов, оценивается как невысокий.
В течение 1990-х гг. были выполнены сотни клинических попыток генной терапии многих генетических заболеваний человека, но в большинстве случаев результаты были обескураживающими. Выяснилось, что главным препятствием было неэффективное введение новых генов в клетки. Трансформация многих клеток просто не удавалась, а число трансформированных клеток часто оказывалось недостаточным для исправления генетического нарушения. В экспериментах с ADA было чрезвычайно трудно получить достаточную популяцию трансформированных клеток из-за ведущейся в то же время ADA-PEG-терапии. Обычно стволовые клетки с правильным ADA-геном имеют преимущество в росте над необработанными клетками, расширяя свою популяцию и постепенно преобладая в костном мозге. Однако введение комплекса ADA-PEG тем же пациентам позволяло нетрансформированным (с дефицитом ADA) клеткам жить и развиваться, а у трансформированных клеток уже не было того необходимого преимущества в росте, чтобы расширить свою популяцию за счет других.
В 2000 г. ученые-медики из Франции, Италии и Великобритании сообщили, что лечение генной терапией, начатое в 1999 г., одной из форм SCID, вызванной дефектными цитокиновыми рецепторами (в частности, субъединицей ус), оказалось успешным. Они ввели исправленный ген ус-субъединицы цитокинового рецептора в клетки CD34' (стволовые клетки, из которых развиваются клетки иммунной системы, имеющие на своей поверхности белок под названием CD34; эти клетки можно отделить от остальных клеток костного мозга антителами к CD34). Трансформированные клетки помещались обратно п костный мозг пациента. В этом опыте введение исправленного гена давало трансформированным клеткам явное преимущество в росте над необработанными клетками. У четырех из пяти первых пациентов иммунная система начинала функционировать через 6-12 недель, а содержание зрелых Т-лимфоцитов иммунной системы достигало уровня контрольных субъектов того же возраста (у которых нет SCID) в течение 6-8 месяцев. Функция иммунной системы была восстановлена, и примерно через 4 года большинство детей уже вели нормальный образ жизни. Такие результаты были получены еще у четырех пациентов. Это дало весомое доказательство того, что генная терапия человека может излечить серьезное генетическое заболевание.
В начале 2003 г. пришла неудача. У двух из четырех первых пациентов, которым давали клетки с правильным геном нитокинового рецептора, развилась тяжелая форма лейкемии. На протяжении лечения генной терапией один из введенных ретровирусов сам спонтанно встроился в хромосому одной клетки СD34+, приведя к необычайно высокой экспрессии гена LМО-2. Пораженная клетка дифференцировалась в Т-клетку иммунной системы, а повышенная экспрессия гена LМО-2 привела к неконтролируемому делению клетки, вызвав лейкемию. У обоих пациентов была хорошая реакция на химиотерапию, у остальных проблема нс возникла. Однако инцидент подтвердил, что первоначальные беспокойства по поводу риска, связанного с использованием ретровирусных векторов, действительно имели под собой основу. После просмотра протоколов клинических испытаний генной терапии и консультаций с борцами за нравственность и родителями больных детей в дальнейшем все же планируется продолжить лечение детей, не являющихся кандидатами на пересадку костного мозга. Причина довольно проста. Было признано, что потенциальная польза детям в таком ослабленном состоянии преобладает над выявленным риском. По-видимому, развитие новых вирусных векторов является наиболее важным условием для успешного развития генной терапии.
Генная терапия человека не ограничивается наследственными заболеваниями. В раковые клетки можно ввести гены белков, которые способны уничтожить клетку или восстановить нормальную регуляцию клеточного деления. Клетки иммунной системы, связанные с опухолями и называющиеся противоопухолевыми эффекторными лимфоцитами, можно генетически модифицировать для образования фактора некроза опухоли (TNF, от англ. tumor necrosis factor, см. рис. 12-51). Если такие лимфоциты взять у ракового больного, модифицировать и вернуть обратно, рекомбинантные клетки обнаружат опухоль, а образуемый ими TNF вызовет сокращение опухоли. СПИД тоже можно лечить генной терапией. ДНК, которая кодирует молекулу РНК, комплементарную мРНК жизнеспособного вируса иммунодефицита человека (ВИЧ), можно поместить в клетки иммунной системы (мишени ВИЧ). РНК, которая транскрибируется из встроенной ДНК, должна комплементарно связаться с мРНК ВИЧ, предотвращая его трансляцию и препятствуя жизненному циклу вируса. Еще можно встроить ген, кодирующий неактивную форму одной субъединицы мультидоменного фермента ВИЧ; с одной нефункциональной субъединицей весь фермент может стать неактивным.
Растущее понимание генома человека и генетической основы некоторых заболеваний дает надежду на раннюю диагностику и конструктивное вмешательство. Однако если судить по первым результатам, то путь к эффективной терапии обещает быть долгим с многочисленными препятствиями. Необходимо узнать больше о клеточном метаболизме, о взаимодействии генов и о том, как справляться с рисками. Перспектива победы над опасными для жизни генетическими нарушениями и другими угрожающими заболеваниями дает повод продолжать активную работу.
Для вирусов каждого вида характерны свои особенности, поэтому при разработке векторов для трансформации клеток млекопитающих используют различные классы вирусов животных. Например, у аденовирусов нет механизма встраивания ДНК в хромосому. Поэтому рекомбинантная ДНК, доставленная с помощью аденовирусного вектора, экспрессируется всего лишь непродолжительное время, а затем разрушается. Но это может быть полезным, если требуется кратковременная экспрессия гена.
У животных трансформация клеток любым из вышеприведенных способов сопряжена со своими проблемами. Внедренная в клетку ДНК, как правило, встраивается в хромосому в произвольном месте. Даже если у чужеродной ДНК будет такая же последовательность, как и у хромосомы хозяина, позволяющая «прицелиться» к этому месту, негомологичные компоненты по величине все же на несколько порядков больше «мишени». Если такие встраивания разрывают важнейшие гены, то это иногда приводит к изменению функций клетки (тем не менее большинство клеток диплоидные или полиплоидные, поэтому при встраивании по крайней мере одна копия любого данного гена остается нетронутой). Чрезвычайно скверным результатом такого встраивания могла бы стать непреднамеренная активация гена, стимулирующего клеточное деление, что, вероятно, привело бы к образованию раковых клеток. Хотя когда-то и считалось, что такое событие маловероятно, недавние исследования подтвердили значительную его опасность (доп. 9-2). Наконец, место встраивания может определять уровень экспрессии встроенного гена, поскольку интегрированные компоненты не транскрибируются одинаковым образом по всему геному.
Несмотря на все эти проблемы, трансформация клеток животных широко использовалась для изучения структуры и функции хромосом, регуляции и экспрессии генов. Удачную передачу рекомбинантной ДНК животному можно проиллюстрировать на примере эксперимента, в котором перманентно менялась легко наблюдаемая физическая особенность, передаваемая по наследству. Микроинъекция ДНК в ядро оплодотворенной яйцеклетки мыши приводит к эффективной трансформации (хромосомному встраиванию). Если такие яйцеклетки ввести самке мыши и позволить им развиваться, то у некоторых из новорожденных мышей зачастую экспрессируется новый ген. Тех, у которых изменилась эмбриональная линия, можно обнаружить, анализируя их потомство. Аккуратным разведением таких мышей ученые могут положить начало новой линии трансгенных мышей, в которой все особи гомозиготны по новому гену или генам. На сегодняшний день получают трансгенных мышей с большим диапазоном генетических вариаций, многие из которых связаны с человеческими заболеваниями и их контролем, намечая путь к генной терапии человека (доп. 9-2). Похожий подход используется для создания мышей, у которых определенный ген инактивируется («нокаутные мыши») с целью выяснения его функции. Этот подход был использован для внесения дефектов в мышиные гены, регулирующие массу тела животного (см. рис. 23-34). Создание трансгенной мыши
Работы по изменению геномов животных проводятся не только на мышах. Важным модельным организмом является, например, рыба- зебра — тропическая аквариумная рыбка. Теперь в зоомагазинах можно найти новые линии рыбы- зебры (рис. 9-33), геном которых изменен таким образом, что в их клетках образуется один из вариантов зеленого флуоресцентного белка, излучающий свет в разных областях видимой части спектра (см. рис. 9-15).
Рис. 9-33. Клонирование в клетках позвоночных. Гены некоторых вариантов зеленого флуоресцентного белка вводили в геном рыбы-зебры различных линий, что делало этих рыб буквально светящимися в темноте. Каждый вариант зеленого флуоресцентного белка испускает свет в определенной части спектра, в результате рыбы светятся по-разному: красным, зеленым или желтым светом.

Новые технологии сулят скорое открытие новых лекарств
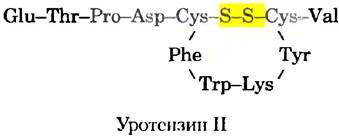
Трудно перечислить все способы, которыми геномика и протеомика могут влиять на создание лекарственных средств, однако несколько примеров иллюстрируют такие возможности. Гипертония, острая сердечная недостаточность, гиперхолестеринемия и ожирение лечатся лекарствами, изменяющими физиологию человека. Метод лечения находят, определяя ферменты или рецепторы, задействованные в процессе, и находя ингибиторы, препятствующие их действию. Протеомика будет играть все большую роль в выявлении потенциальных объектов действия лекарств. Например, известно, что самым мощным сосудосужающим средством является пептидный гормон уротензин II. Впервые найденный в спинномозговой жидкости рыбы, уротензин II представляет собой маленький циклический пептид с 11 аминокислотными остатками у человека и с 12 или 13 у некоторых других организмов. Сужение сосудов, к которому он приводит, может вызвать или обострить гипертонию, острую сердечную недостаточность или другое сердечно-сосудистое заболевание. Для демонстрации того, что уротензин II связывается с рецептором, сопряженным с G-белком, который называется GPR14 (от англ. G-protein-coupled receptor), использовали несколько методов, описанных в разд. 9.3 для объяснения белок-белковых взаимодействий. G-бслки играют важную роль во многих сигнальных путях (гл. 12). Но GPR14 был «сиротским» рецептором — при секвенировании генома человека его идентифицировали в качестве рецептора, сопряженного с G-белком, но с неизвестной функцией. Связывание уротензина II с GPR14 теперь делает последний из названных белков ключевым объектом терапии, направленной на вмешательство в действие уротензина II.
Еще одной целью медицинских исследований является обнаружение новых лекарственных средств для лечения заболеваний, вызванных патогенами человека. В настоящий момент это означает выявление ферментов в клетках патогенов, которые можно инактивировать новым лекарством. Идеальный микробный фермент-мишень должен (1) быть жизненно необходимым для клетки патогена, (2) встречаться у большого числа патогенов, (3) отсутствовать или значительно отличаться у людей. Задачу установления метаболических процессов, жизненно важных для микроорганизмов, но отсутствующих у людей, можно значительно облегчить с помощью сравнительной геномики, дополненной функциональной информацией, полученной из геномики и протеомики. ■
Технология рекомбинантных ДНК дает результаты и открывает новые перспективы
Продукты технологий рекомбинантных ДНК простираются от белков до «сконструированных» организмов. С помощью этих технологий можно создавать огромное число коммерческих белков, разрабатывать микроорганизмы для особых задач и создавать растения и животных с полезными свойствами для применения в сельском хозяйстве или медицине. Некоторые продукты этих технологий были одобрены для потребительского или профессионального использования, многие еще находятся в стадии разработки. Генная инженерия всего за несколько лет преобразовалась из многообещающей новой технологии в многомиллиардную индустрию, при этом наибольший рост произошел в фармацевтической промышленности. В табл. 9-4 приведены несколько основных классов новых продуктов технологии рекомбинантных ДНК.
Таблица 9-4. Некоторые продукты технологии рекомбинантных ДНК для медицины
Категория продукта |
Примеры/применения |
Антикоагулянты |
Тканевой активатор плазминогена (ТРА, от англ. tissueplasminogw actirotor): активирует плазмин, фермент, задействованный в растворении тромбов; эффективен при лечении сердечных приступов |
Факторы свертывания крови |
Фактор VIII; способствует свертыванию крови; его не хватает больным гемофилией; лечение фактором VIII, полученным с помощью технологии рекомбинантной ДНК, снижает риск заражения при переливании крови |
Колониестимулирующие факторы |
Факторы роста иммунной системы, стимулирующие образование лейкоцитов; лечение иммунодефицитов и заражений |
Эритропоэтин |
Стимулирует образование эритроцитов; лечение анемии у пациентов заболеванием почек |
Факторы роста |
Стимулируют дифференцировку и рост клеток разных видов; способствуют заживлению ран |
Гормон роста человека |
Лечение карликовости |
Инсулин человека |
Лечение диабета |
Интерфероны |
Препятствует размножению вирусов; используются для лечения некоторых видов рака |
Интерлейкины |
Активируют и стимулируют лейкоциты различных классов; можно использовать при лечении ранений, ВИЧ-инфекций, рака и иммунодефицитов |
Моноклональные антитела |
Исключительная специфичность связывания используется в диагностических тестах, для направленного транспорта лекарств, токсинов или радиоактивных соединений к опухолям при терапии рака; есть и много других применений |
Супероксиддисмутаза |
Предотвращает повреждение ткани активными формами кислорода, когда в ней, лишенной ненадолго О2 во время хирургического вмешательства, внезапно восстанавливается кровоток |
Вакцины |
Белки из оболочек вирусов более безопасны и также эффективны в «натаскивании» иммунной системы, как и мертвые вирусы, традиционно наиболее применяемые в качестве вакцин; самой первой была разработана вакцина от гепатита В |
■ Новейший продукт технологии рекомбинантной ДНК — эритропоэтин. Этот белковый гормон (Мr = 51000) стимулирует образование эритроцитов. Люди с заболеваниями, влияющими на работу почек, нередко испытывают недостаток этого белка, что приводит к анемии. Эритропоэтин, полученный по технологии рекомбинантной ДНК, может быть использован для лечения таких пациентов; тем самым снижается необходимость повторных переливаний крови. ■
Не перестают появляться другие приложения этой технологии. Ферменты, созданные на основе технологии рекомбинантных ДНК, уже используют в производстве моющих средств, сахара и сыра. Модифицированные белки используют в качестве пищевых добавок для придания питательных свойств, вкуса и запаха. Разрабатываются микроорганизмы с измененными или совершенно новыми метаболическими путями для добычи нефти и минералов из подземных месторождений, для ликвидации разливов нефти и детоксикации опасных мусорных свалок и сточных вод. Модифицированные растения с повышенной устойчивостью к засухе, морозу, насекомым-вредителям и заболеваниям повышают урожайность и снижают необходимость использования в сельском хозяйстве химикатов. Можно полностью клонировать животных, перенося целое ядро со всем его генетическим материалом в специально подготовленную яйцеклетку, из которой ее собственное ядро было удалено.
О необычайных перспективах современной биотехнологии идут дискуссии. Клонирование млекопитающих затрагивает нормы общественной морали и может сопровождаться серьезными проблемами со здоровьем и продолжительностью жизни клонированных животных. Если можно создавать полезные лекарственные вещества, то может оказаться, что и токсины станут биологическим оружием. Потенциальные опасности, связанные с попаданием модифицированных растений и других организмов в биосферу, продолжают тщательно отслеживаться. Весь спектр долговременных последствий этой технологии для человека как биологического вида и всей природной среды невозможно предвидеть без более ясного представления как о клеточном метаболизме, так и об экологии.
Краткое содержание раздела 9.4 Изменения генома и новые продукты биотехнологии
■ Успехи в секвенировании целого генома и в методах генной инженерии расширяют возможности модификации геномов у всех биологических видов.
■ Клонирование в растениях, при котором используется плазмидный вектор из бактерии р. Agrobacterium, позволяет придавать растениях новые свойства.
■ При клонировании животных ученые вводят чужеродную ДНК преимущественно с помощью вирусных векторов или микроинъекций. На основе этих методов можно создавать трансгенных животных и получить новые способы генной терапии человека.
■ Использование геномики и протеомики в фундаментальных и фармацевтических исследованиях сильно продвигает создание новых лекарств. Кроме того, с помощью биотехнологии создается все расширяющийся спектр иных продуктов и технологий.