ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 1. ОСНОВЫ БИОХИМИИ СТРОЕНИЕ И КАТАЛИЗ - 2011
ЧАСТЬ I. СТРОЕНИЕ И КАТАЛИЗ
12. БИОСИГНАЛИЗАЦИЯ
12.2. Рецепторы, сопряженные с G-белком, и вторичные мессенджеры
Передача сигнала посредством рецепторов, сопряженных с G-белком (GPCR, от англ. G-protein- coupled receptors), определяется тремя важными составляющими этой сигнальной системы: рецептор плазматической мембраны с семью спиральными трансмембранными сегментами, фермент в плазматической мембране, который генерирует внутриклеточный вторичный мессенджер и гуанозиннуклеотидсвязывающий белок (G-белок), активирующий фермент. Стимулированный активированным рецептором G-белок обменивает связанный GDP на GTP; комплекс GTP-белок покидает рецептор и связывается с расположенным поблизости ферментом, изменяя его активность. В геноме человека закодированы около 350 GPCR, распознающих гормоны, ростовые факторы и другие эндогенные лиганды, а также, наверное, 500 GPCR для рецепторов запахов и вкусов. Прототипом сигнальной системы этого вида могут служить p-адренергические рецепторы, которые опосредуют действие адреналина на многие ткани.
GPCR участвуют в развитии многих распространенных заболеваний человека, таких как аллергия, депрессия, слепота, диабет и различные сердечно-сосудистые заболевания. Почти половина всех выпускаемых лекарственных препаратов действуют на тот или иной GPCR. Например, бета-блокаторы, назначаемые при столь несхожих заболеваниях, как гипертензия, аритмия, глаукома, нервозность и мигрень, нацелены па взаимодействие с β-адренергическим рецептором, который опосредует действие адреналина. Около 150 GPCR, обнаруженных в геноме человека, все еще считаются «сиротскими рецепторами», а это означает, что их лиганды в организме пока не идентифицированы и, следовательно, ничего не известно об их биологической функции. β-Адренергический рецептор, биологическая и фармакологическая функции которого хорошо изучены, является прототипом всех GPCR. С него мы и начнем обсуждение систем передачи сигнала. ■
Система p-адренергического рецептора функционирует с участием вторичного мессенджера сАМР
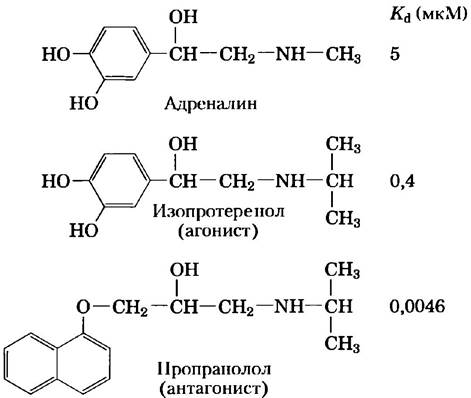
Действие адреналина начинается, когда гормон присоединяется к белковому рецептору в плазматической мембране гормончувствителыюй клетки. Адренергичесиерецепторы бывают четырех основных типов — α1, α2, β1 и β2; они несколько отличаются по сродству и ответам на действие агонистов и антагонистов. Агонисты — это структурные аналоги, которые связываются с рецептором и имитируют эффекты его природных лигандов; антагонисты — аналоги, которые связываются с рецептором, но не вызывают обычного ответа, а блокируют тем самым эффекты агонистов (рис. 12-3). Четыре типа адренергических рецепторов находятся в разных тканях-мишенях и опосредуют различные ответы на адреналин. В этом разделе мы сфокусируем внимание на β-адренергических рецепторах мышц, печени и жировой ткани. Эти рецепторы опосредуют изменения в энергетическом обмене, как описано в гл. 23, в том числе усиливают расщепление гликогена и жиров. Адренергические рецепторы подтипов β1 и β2 работают по одному и тому же механизму, поэтому мы будем употреблять слово «β-адренергический» в отношении обоих видов.
Рис. 12-3. Адреналин и его синтетические аналоги. Адреналин выделяется надпочечниками и регулирует энергетический метаболизм в мышцах, печени и жировой ткани. Он служит также нейромедиатором в адренергических нейронах. Его сродство к рецептору можно оценить константой диссоциации комплекса лиганд-рецептор. Изопротеренол и пропранолол — синтетические аналоги адреналина, один — агонист с большим сродством к рецептору, чем у адреналина другой — антагонист с очень низким сродством.
β-Адренергический рецептор является интегральным белком с семью гидрофобными областями из 20-28 аминокислотных остатков, которые, извиваясь, как змея, пронизывают мембрану семь раз (поэтому такие рецепторы называют еще серпентиновыми рецепторами или семиспиральными рецепторами). Связывание адреналина с участком рецептора, находящимся глубоко внутри мембраны (рис. 12-4, а, стадия (1)), способствует конформационным изменениям во внутриклеточном домене рецептора, что влияет на его взаимодействие со вторым белком сигнального пути — гетеротримерным GТР- связывающим стимулирующим G-белком, или Gs, на внутренней стороне плазматической мембраны. Альфред Г. Гилман и Мартин Родбел обнаружили, что при связывании GТР с Gs последний стимулирует образование сАМР аденилатциклазой (см. ниже) плазматической мембраны. Белок Gs является прототипом семейства G-белков, участвующих в биосигнализации (см. доп. 12-2);
это гетеродимер с субъединицами α, β и y. Когда GTP занимает нуклеотидсвязывающий сайт, Gs (α-субъединица), Gs поворачивается и может после этого активировать аденилатциклазу (АС на рис. 12-4, а). Когда с этим сайтом связан GDP, Gs нс работает. Активированный β-адренсргический рецептор взаимодействует с Gs, катализируя замещение связи с GDP на GTP и переводя Gs в активную форму (стадия (2)). По мере того как это происходит, β- и y-субъединицы Gs уходят от α-субъединицы, образуя βy-димер, a Gsα со связанным GTP передвигается в плоскости мембраны от рецептора к близлежащей молекуле аденилатциклазы (стадия (3)). Gsa удерживается в мембране, ковалентно связываясь с пальмитоильной группой (см. рис. 11-14).
Рис. 12-4. Действие адреналина: β-адренергический путь передачи сигнала, а) Механизм сопряжения связывания адреналина (А) с рецептором (Rес) с активацией аденилатциклазы (АС); в тексте обсуждаются семь этапов работы этого механизма. Та же молекула аденилатциклазы в плазматической мембране может регулироваться стимулирующим G-белком (СS), как показано на рисунке, или ингибирующим G-белком (Gi) (не показано). Gs и находятся под действием разных гормонов. Гормоны, индуцирующие связывание GТР с вызывают ингибирование аденилатциклазы, приводя к понижению внутриклеточной концентрации сАМР. б) Совместное действие ферментов, катализирующих стадии (4) и (7), приводит сначала к образованию, а затем к инактивации вторичного мессенджера — сАМР.
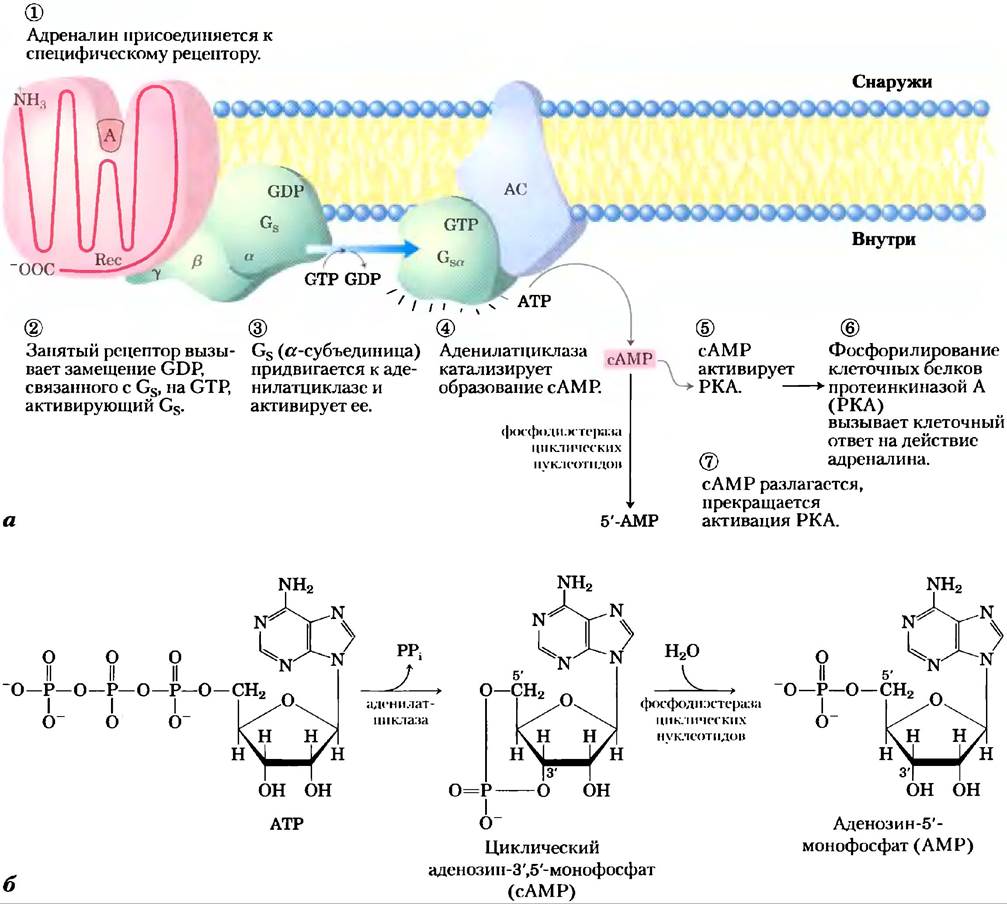
Аденилатциклаза — интегральный белок плазматической мембраны, се активный центр расположен на внутренней стороне клеточной мембраны. Связывание активного Gsα с аденилат- циклазой стимулирует циклазу катализировать синтез сАМР (рис. 12-4, а, стадия (4), см. также рис. 12-4, б), увеличивая концентрацию сАМР в цитозоле. Взаимодействие между Gsα и аденилат- циклазой становится возможным лишь тогда, когда области «переключателей» в белке Gsα в результате конформационных изменений, вызванных связыванием GTP, оказываются на поверхности.
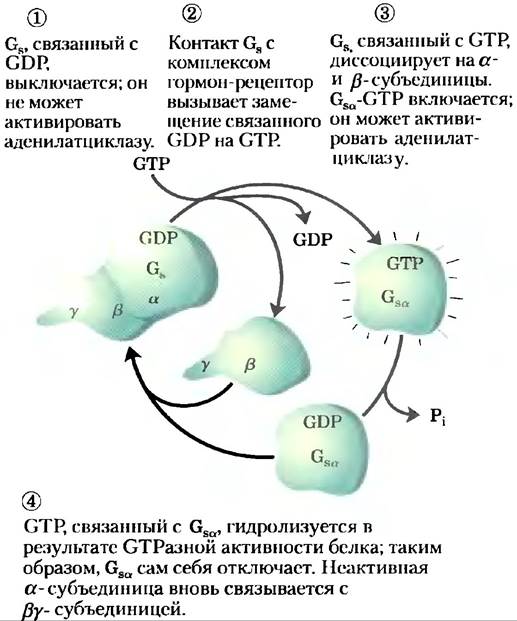
Это стимулирующее действие Gsα является самолимитируемым; Gsα — это СТРаза, которая сама себя выключает, превращая связанный GTP в GDP (рис. 12-5). После этого неактивный Gsα уходит от аденилатциклазы, делая циклазу неактивной. После того как Gsα снова связывается с β- и y-субъединицами (Gsβy), Gs опять способен взаимодействовать с рецептором, связанным с гормоном. Множество G-белков играют роль переключателей в системах передачи сигнала с участием GPCR и во многих процессах, в которых происходит слияние или расщепление клеточных мембран (доп. 12-2). Тримерные G-белки: молекулярные выключатели.
Рис. 12-5. Самоинактивация Gs. Стадии этого процесса описаны в тексте. Присущая белку СТРазная активность, стимулируемая во многих случаях RGS-белками (англ. regulators of G protein signalling), определяет, как быстро связанный GTP гидролизуется до GDP и, следовательно, как долго G-белок остается активным.
Адреналин действует, вызывая увеличение концентрации сАМР вследствие работы аденилатциклазы. Циклический АМР, в свою очередь, в результате аллостерической регуляции активирует сАМР-зависимую протеинкиназу, называемую иначе протеинкиназой А, или РКА (рис. 12-4, а, стадия (5)), которая катализирует фосфорилирование других белков, включая киназу гликогенфосфорилазы b. Этот фермент активен в фосфорилированной форме и при необходимости может начинать процесс использования запасенного гликогена из мышц и печени.
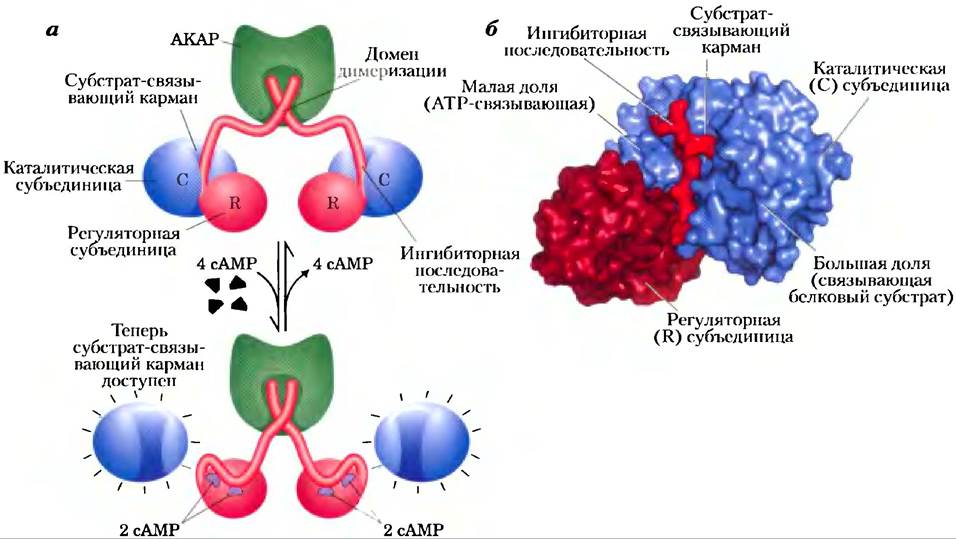
Неактивная форма РКА содержит две каталитические субъединицы (С) и две регуляторные субъединицы (R) (рис. 12-6, а). Тетрамерный комплекс R2С2 каталитически неактивен, поскольку аутоингибирующий домен каждой R-субъединицы занимает субстратсвязывающий центр каждой С-субъединицы. Когда сАМР связывается с двумя центрами на каждой R-субъединице, R-субъединица претерпевает конформационное изменение, и комплекс R2С2 диссоциирует, высвобождая две каталитически активные С-субъединицы. Тот же самый основной механизм — перемещение аутоингибирующего домена — опосредует аллостерическую активацию многих видов протеинкиназ их вторичными мессенджерами (как, например, на рис. 12-14 и 12-22). Строение субстрат- связывающего кармана в молекуле РКА аналогично таким же участкам во всех других известных протеинкиназах (рис. 12-6, б). Некоторые остатки в этом кармане встречаются и в тысяче других молекул протеинкиназ.
Рис. 12-6. Активация сАМР-зависимой протеинкиназы (РКА), а) При низкой концентрации сАМР две идентичные регуляторные субъединицы (R, изображены красным цветом) связаны с двумя идентичными каталитическими субъединицами (С; синие). В этом комплексе R2C2 ингибиторные последовательности R-субъединиц размещаются в субстрат- связывающем кармане С-субъединиц, что предотвращает связывание субстратов; таким образом, данный комплекс не проявляет каталитической активности. N-концевые последовательности R-субъединиц взаимодействуют между собой и образуют димер R2, с которым связывается описанный далее белок АКАР (англ. A kinase anchoring protein;зеленый). Когда в ответ на гормональный сигнал концентрация сАМР начинает расти, каждая R-субъ- единица связывает две молекулы сАМР и претерпевает значительную перегруппировку, в результате которой ингибиторные последовательности выталкиваются из субстратсвязы- вающих карманов С-субъединиц, а сами эти субъединицы оказываются в активной форме. б) Кристаллическая структура части комплекса R2C2 (PDB ID 1U7E) — одна С-субъединица (синяя) и часть R-субъединицы (два оттенка красного). Для простоты N-концевые последовательности R-субъединиц, образующие димер, не изображены. Малая доля С-субъединицы содержит участок связывания АТР, а большая доля образует и окружает карман, в котором происходит связывание и фосфорилирование (по остаткам Ser или Thr) белкового субстрата. В неактивной форме ингибиторная последовательность R-субъединицы (ярко-красная) блокирует участок связывания субстрата на С-субъединице.
Дополнение 12-2. МЕДИЦИНА. G-белки: двойное переключение в организме здорового и больного человека
Альфред Г. Гилман и Мартин Родбсл (рис. 1) установили ключевую роль гуанозиннуклеотидсвязывающих белков (G-белков) в многочисленных клеточных процессах, в числе которых чувственное восприятие, сигналы деления, роста и дифференцировки клеток, внутриклеточное перемещение белков и мембранных везикул, а также синтез белка. В геноме человека закодировано около 200 таких белков, различающихся размерами, субъединичной структурой, внутриклеточной локализацией и функциями. Но все G-белки имеют одну особенность: они обладают способностью активироваться, а затем спустя короткий промежуток времени инактивируют сами себя, исполняя роль молекулярных переключателей со «встроенными часами». К этому суперсемейству белков относятся тримерные G-белки, участвующие в адренергическом пути передачи сигнала (Gs и G¡) и зрительном восприятии (трансдуцин); малые G-белки, как те, что опосредуют действие инсулина (Ras), и другие, участвующие в везикулярном транспорте (ARF и Rab), в транспорте в ядро и из ядра (Ran; см. рис. 27-42), а также в регуляции клеточного цикла (Rho); наконец, некоторые белки, задействованные в биосинтезе белка (фактор инициации IF2 и факторы элонгации EF-Tu и EF-G; см. гл. 26).Многие G-белки ковалентно связаны с липидами, которые сообщают этим белкам сродство к мембранам и определяют их внутриклеточную локализацию.
Рис. 1. Альфред Г. Гилман (слева) и Мартин Родбел (1925-1998; справа). С их лекциями об открытии и изучении G-белков, прочитанными на церемонии вручения Нобелевской премии, можно познакомиться на сайте www.nobelprize.org.

Все G-белки имеют одинаковую общую структуру и используют один и тот же механизм переключения между неактивной конформацией, образующейся при связывании GDP, и активной конформацией, возникающей при связывании GTP. В качестве прототипа всех белков данного суперсемейства можно рассматривать небольшой сигнальный белок Ras (Мr ≈ 20 кДа; рис. 2).
Рис. 2. Белок Ras — прототип всех G-белков (PDB ID 5Р21). Mg2+-GTP (шаростержневая модель) удерживается ключевыми остатками фосфатсвязывающей Р-петли (синяя), а также остатком Thr35 в области переключателя I (красный) и остатком Gly60 в области переключателя II (зеленый). Остаток Ala146 обеспечивает специфичность связывания GTP, но не АТР.
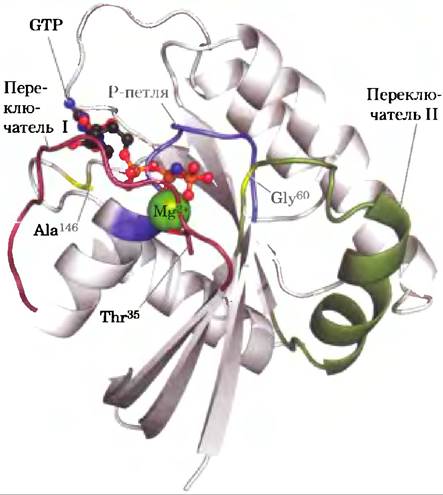
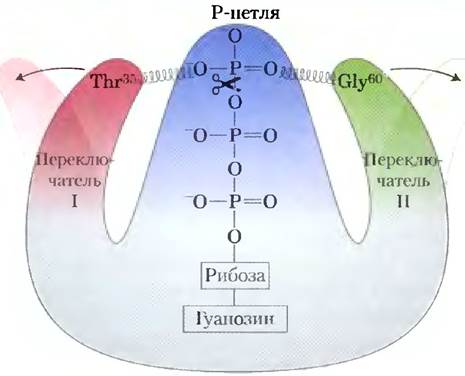
При связывании GTP G-белок переходит в такую конформацию, где некоторые ранее скрытые участки (называемые переключатель I и переключатель II) оказываются доступными для взаимодействия с белками, находящимися далее на пути передачи сигнала; это продолжается до тех пор, пока G-белок не инактивирует сам себя в результате гидролиза, связанного GTP до GDP. Конформацию G-белка определяет фосфатная группа в GTP, которая взаимодействует с участком, называемым Р-петлей (англ. phosphatebinding; рис. 3). Фосфатная группа в GTP связана с остатком Lys Р-петли, кроме того, атомы кислорода этой фосфатной группы образуют водородные связи с двумя другими важными остатками — остатком Thr35 в переключателе I и остатком Gly60 в переключателе II. Эти водородные связи, как пара пружин, удерживают белок в активной конформации. При расщеплении GTP до GDP с высвобождением P¡ водородные связи разрываются, а белок переходит в неактивную конформацию, скрывая те участки, которые в активной конформации взаимодействовали с другими веществами. Между остатком Ala146 и кислородом гуанина образуется водородная связь, что способствует связыванию именно GTP, а не АТР.
Рис. 3. Гидролиз связанного GTP под действием СТРазной активности Ras и соответствующего белка GAP приводит к разрушению водородных связей с остатками Thr35 и Gly60, в результате чего белок переходит в такую конформацию, в которой области переключателя I и переключателя II оказываются недоступными для взаимодействия с другими белками, например, с Raf.
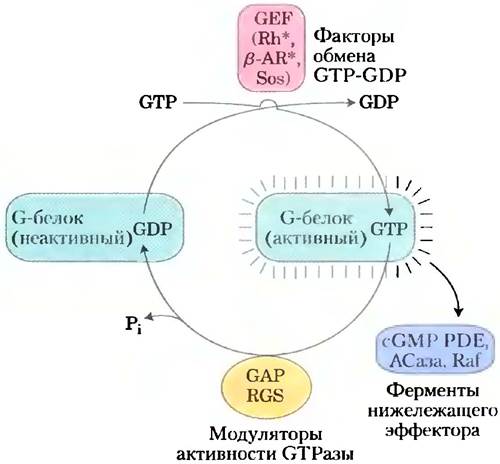
Собственная GТРазная активность G-белков примерно в 105 раз усиливается под действием активаторных белков GAP (англ. GTPase activator proteins), которые в случае гетеротримерных G-белков называют RGS (англ. regulators of G-protein signaling, рис. 4). Таким образом, белки GAP (и RGS) определяют продолжительность «включенного» состояния. Остаток Arg этих белков проникает в активный центр GTPaзы G-белка и участвует в катализе. Для ускорения процесса замены, связанного GDP на GTP, приводящего к переходу белка в активную конформацию, требуется участие связанных с G-белком факторов обмена гуаниновых нуклеотидов GEF (англ. guanosine nucleotide- exchange factors) (рис. 4).
Рис. 4. Факторы, регулирующие активность G-белков (изображены зеленым цветом). Неактивные G-белки (как маленькие, такие как Ras, так и гетеротримерные G-белки, такие как Gs) взаимодействуют с факторами обмена нуклеотидов (GEF; изображены красным цветом; часто они представляют собой активируемые рецепторы, такие как родопсиновый и β-адренергический рецепторы, и Sos) и активируются при связывании GTR Активированные G-белки далее активируют следующие в пути передачи сигнала эффекторные ферменты (изображены синим цветом; сюда относятся такие ферменты, как cGMP фосфодиэстераза, аденилатциклаза и Raf). Активаторные белки (GAP в случае небольших G-белков) и регуляторы передачи сигнала с участием G-белков (RGS, изображены желтым цветом) модулируют GTPaзную активность G-белков, определяя длительность их нахождения в активном состоянии.
Поскольку G-белки играют ключевую роль во множестве путей передачи сигнала, неудивительно, что дефекты этих белков приводят к развитию различных заболеваний. Примерно в 25% всех видов рака человека (а в некоторых видах рака — в гораздо большей пропорции) имеет место мутация белка Ras (обычно она затрагивает один из ключевых остатков в области участка связывания GTP или в Р-петле), практически уничтожающая GТРазную активность белка. Белок Ras, активированный в результате связывания GTP, продолжает постоянно находиться в активной конформации, стимулируя деление клеток, которым делиться не следует. Ген опухолевого супрессора NF1кодирует белок GAP, усиливающий GТРазную активность нормального белка Ras. Мутации в области NF1, приводящие к образованию нефункционального GAP, лишают Ras внешней помощи и оставляют со своей собственной GТРазной активностью. Таким образом, активированный в результате связывания GTP белок Ras остается активным и продолжает посылать клеткам сигнал к делению.
Дефект гетеромерного G-белка также может вести к развитию заболевания. Мутации гена, кодирующего субъединицу Gs(ответственную за изменение концентрации сАМР в ответ на гормональный стимул), могут привести к образованию Gα, находящуюся в постоянно активном или постоянно неактивном состоянии. «Активирующие» мутации обычно затрагивают важные для GТРазной активности остатки и вызывают постоянное повышение концентрации сАМР с серьезными последствиями, включая нежелательную пролиферацию клеток. Например, такие мутации обнаруживаются в 40% случаев аденомы гипофиза. У людей с «инактивирующими» мутациями Ga не происходит реакции на гормональные сигналы (например, на сигналы гормона щитовидной железы), передаваемые при участии сАМР. Мутации гена субъединицы трансдуцина Тα, участвующей в передаче зрительных сигналов, ведут к нарушению ночного зрения (куриной слепоте), вероятно, в результате нарушения взаимодействия между активированной субъединицей Та и фосфодиэстеразой внешнего сегмента палочек сетчатки (см. рис. 12-38). Вариации последовательности гена, кодирующего β-субъединицу гетеротримерного G-белка, часто обнаруживают у людей с повышенным кровяным давлением; возможно также, что именно этот ген участвует в развитии ожирения и атеросклероза.
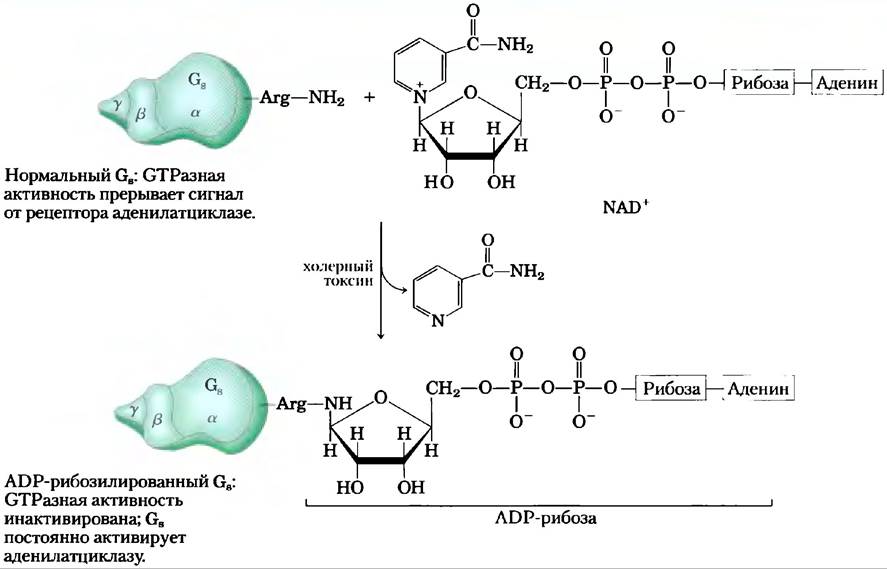
Патогенные бактерии, вызывающие холеру и коклюш, продуцируют токсины, действующие на G-белки и мешающие нормальной передаче сигнала в клетке. Холерный токсин,секретируемый Vibrio cholerae в кишечнике зараженного человека, представляет собой гомодимерный белок. Субъединица В связывается со специфическими ганглиозидами на поверхности эпителиальных клеток кишечника, обеспечивая вход в клетку субъединицы А. После вхождения в клетку субъединица А распадается на две части — фрагмент А1 и фрагмент А2. Далее А1 связывается с фактором рибозилирования ADP (ARF6; представляет собой небольшой G-белок клетки-хозяина) через аминокислотные остатки в области переключателей I и II, которые доступны только в том случае, если ARF6 находится в активной форме, т. е. со связанным GTR Связывание с ARF6 активирует фрагмент А1, который катализирует перенос ADP-рибозы от NAD+на остаток Arg в Р-петле субъединицы Gы (рис. 5). ADP-рибозилирование блокирует GТРазную активность Gs, делая Gsпостоянно активной. Это приводит к постоянной активации аденилатциклазы эпителиальных клеток кишечника, повышает концентрацию сАМР и активирует РКА. РКА фосфорилирует хлорный канал CFTR (см. доп. 11-3) и Na+/H--обменник в эпителиальных клетках кишечника. Происходящий в результате этих событий отток NaCl вызывает массивный выход воды через кишечник, поскольку клетки стремятся предотвратить надвигающееся нарушение осмотического давления. Поэтому основным и наиболее опасным проявлением холеры является выраженная потеря организмом воды и электролитов. При отсутствии усиленной регидратационной терапии подобное состояние может закончиться летальным исходом.
Рис. 5. Бактериальные токсины, вызывающие холеру и коклюш, — это ферменты, катализирующие перенос ADP-рибозной группы с NAD+ на аргинин в Gs (при холере; показано на рисунке) или на цистеин в Gi (при коклюше). Модифицированные таким образом G-белки не способны воспринимать нормальный гормональный сигнал. Причиной нарушений при обоих заболеваниях является дефект регуляции аденилатциклазы и образование избытка сАМР.
Коклюшный токсин, выделяемый бактерией Bordetella pertussis, катализирует ADP-рибозилирование субъединицы Gi предотвращая тем самым обмен GDP на GТР и блокируя ингибирование аденилатциклазы под действие Gi. Бактерия поселяется в дыхательных путях, где разрушает клетки мерцательного эпителия, которые в норме должны уничтожать слизь. Необходимость очистки дыхательных путей при отсутствии соответствующей активности эпителия приводит к сильнейшему кашлю; этот кашель с удушьем и есть основной симптом заболевания, кроме того, при кашле бактерии попадают в воздух и в организмы других людей. Каким образом дефект сигнального пути с участием G-белка приводит к уничтожению мерцательного эпителия, до сих пор окончательно не установлено.
Принимая во внимание большое число сопряженных с G-белком рецепторов в геноме человека, можно прогнозировать с уверенностью, что в результате новых исследований появятся дополнительные примеры того, как дефекты сигнальных путей с участием G-белков влияют на здоровье человека.
Как показано на рис. 12-4, а (стадия (6)), РКА регулирует несколько ферментов, участвующих в сигнальных путях (табл. 12-2). Хотя белки, регулируемые посредством сАМР-зависимого фосфорилирования, выполняют различные функции, все они имеют сходную аминокислотную последовательность вблизи остатков Ser или Thr, подвергающихся фосфорилированию. Именно эта область обусловливает регуляцию таких белков протеинкиназой А. Субстратсвязывающий карман РКА узнает эти последовательности и фосфорилирует остаток Ser или Thr. В результате сравнения последовательностей различных белковых субстратов РКА была выявлена консенсусная последовательность —специфические соседние остатки, необходимые, чтобы «пометить» остаток Ser или Thr как мишень для фосфорилирования (см. табл. 12-2).
Таблица 12-2. Некоторые ферменты и другие белки, регулируемые сАМР-зависимым фосфорилированием (протеинкиназой А (РКА))
Фермент/белок |
Фосфорилируемая последовательность* |
Регулируемый метаболический путь/процесс |
Гликогененитаза |
RASCTSSS |
Синтез гликогена |
Киназа фосфорилазы b |
||
α-субъединца |
VEFRRLSI |
Распад гликогена |
β-субьединица |
RTKRSGSV |
|
Пируваткиназа (печени крысы) |
GVLRRASVAZL |
Гликолиз |
Комплекс пируватдегидрогеназы (тип L) |
GYLRRASV |
Пируват для ацетил-СоА |
Гормончувствительная липаза |
PMRRSV |
Мобилизация триацилглицерина и окисление жирных кислот |
Фосфофруктокиназа-2/ фруктозо-2,6-бисфосфатаза |
LQRRRGSSIPQ |
Гликолиз/глюконеогенез |
Тирозингилроксилаза |
FIGRRQSL |
Синтез L-ДОФА, дофамина, норадреналина и адреналина |
Гистон Н1 |
AKRKASGPPVS |
Конденсация ДНК |
Гистон H2В |
KKAKASRKESYSVVVYK |
Конденсация ДНК |
Сердечный фосфоламбан (регулятор сердечного насоса) |
AIRRAST |
Коннентрация внутриклеточного Са2+ |
Ингибитор-1 протеинфосфатазы |
IRRRRPTP |
Дефосфорилирование белков |
Консенсусная последовательность РКА** |
xR[RK]x[ST]B |
Многие |
* Фосфорилируемый остаток S или Т выделен красным. Для обозначения аминокислот использован однобуквенный код (см. табл. 3-1).
**Х любая аминокислота; В — любая гидрофобная аминокислота.
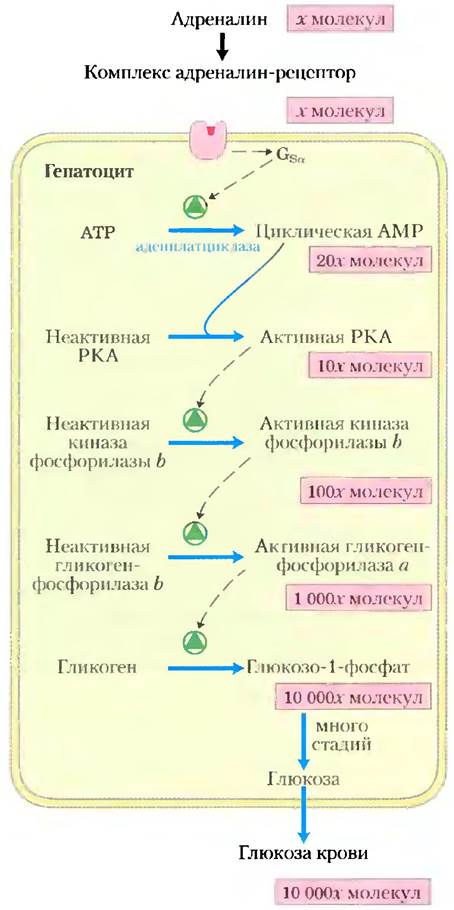
Передача сигнала посредством аденилатциклазы включает несколько стадий, которые усиливают первоначальный гормональный сигнал (рис. 12-7). Связывание одной молекулы гормона с одним рецептором каталитически активирует несколько молекул Gs. Затем, активируя молекулу аденилатциклазы, каждая активная молекула Gsстимулирует каталитический синтез множества молекул сАМР. Далее вторичный мессенджер сАМР активирует РКА, каждая молекула которой в свою очередь катализирует фосфорилирование многих молекул белка-мишени киназы фосфорилазы b (рис. 12-7). Эта киназа активирует фосфорилазу b, которая обеспечивает быструю мобилизацию глюкозы из гликогена. Суммарный эффект этого каскада — усиление гормонального сигнала на несколько порядков, которое объясняет, почему для гормональной активности требуется чрезвычайно низкая концентрация адреналина (или любого другого гормона).
Рис. 12-7. Каскад адреналина. Адреналин запускает серию реакций в гепатоцитах, при которых одни катализаторы активируют другие катализаторы, приводя к многократному усилению сигнала. Связывание небольшого числа молекул адреналина со специфическими β-адренергическими рецепторами на поверхности клетки активирует аденилатциклазу. Количество участвующих молекул приведено, только чтобы проиллюстрировать усиление, вероятно, эти данные сильно занижены. (Так как 2 молекулы сАМР активируют 1 каталитическую субъединицу РКА, на этой стадии сигнал не усиливается.)
Существует несколько механизмов завершения β-адренергического ответа
Нормально действующая система передачи сигнала должна выключаться после того, как заканчивается действие гормонального или другого стимула, так что все сигнальные системы обладают механизмами выключения сигнала. Большинство сигнальных систем, кроме того, способны адаптироваться к продолжительному действию сигнала и становятся менее чувствительными к нему (происходит десенсибилизация). β-Адренергическая система передачи сигнала обладает этими двумя способностями. При падении концентрации адреналина в крови ниже значения Кd для его рецептора, гормон диссоциирует из комплекса с рецептором, и рецептор принимает неактивную конформацию, в которой он более нс способен активировать Gs. Второй способ остановить реакцию на адренергический стимул — это гидролиз GТР, связанного с субъединицей Gα, катализируемый собственной GTPaзной активностью G-белка. Превращение связанного GTP в GDP благоприятствует возвращению Gα в такую конформацию, в которой она связывается с субъединицами Gβy и в которой G-белок не может взаимодействовать с аденилатциклазой или стимулировать ее. Это приводит к завершению синтеза сАМР. Скорость инактивации Gs зависит от СТРазной активности, которая у субъединицы Gα очень низкая. Однако активаторные белки GAP в значительной степени повышают СТРазную активность, приводя к ускорению инактивации G-белка (см. доп. 12-2). Белки GAP в свою очередь регулируются другими факторами, что обеспечивает достаточно высокую степень чувствительности ответа на адренергический стимул. Третий механизм прекращения ответа состоит в удалении вторичного мессенджера, т. е. в гидролизе сАМР до 5'-АМР (который не может выполнять функции вторичного мессенджера) под действием фосфодиэстеразы циклических нуклеотидов (рис. 12-4, а, стадия (7); 12-4, б).
Наконец, в конце сигнального пути метаболическое действие, вызванное фосфорилированием ферментов, аннулируется фосфопротеинфосфатазами, которые гидролизуют фосфорилированные остатки Ser, Thr или Туг, высвобождая неорганический фосфат (P¡). В геноме человека обнаружено около 150 генов фосфопротеинфосфатаз, что меньше числа генов протеинкиназ (500). Известно, что некоторые из этих фосфатаз регулируются, а другие могут действовать конститутивно. Когда концентрация сАМР падает, а РКА возвращается в неактивное состояние (стадия (7) на рис. 12-4, а), баланс между фосфорилированием и дефосфорилированием сдвигается под действием этих фосфатаз в сторону продуктов дефосфорилирования.
Десенсибилизация β-адренергического рецептора происходит в результате фосфорилирования или связывания с аррестином
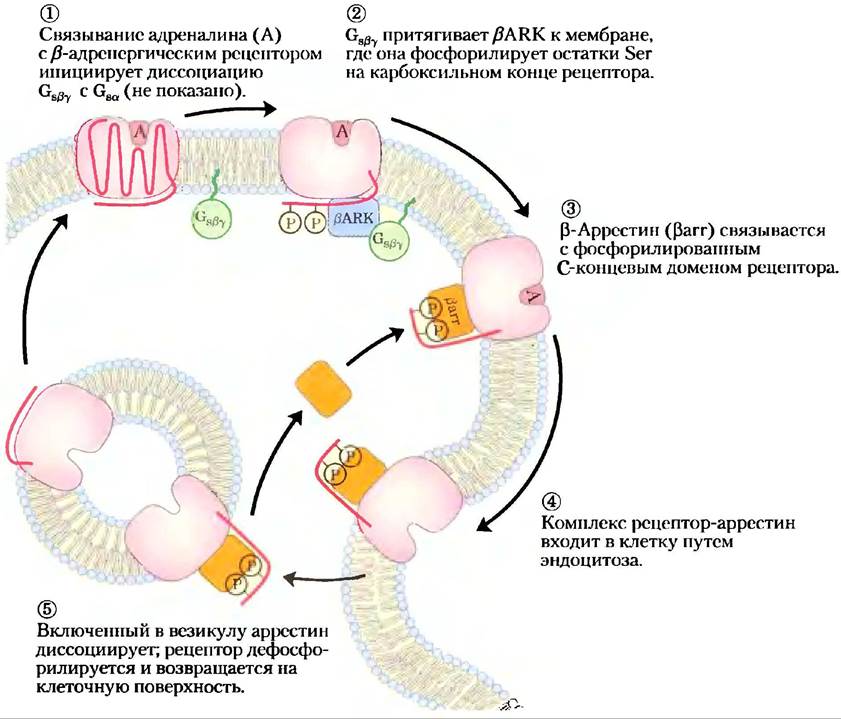
Описанные выше механизмы завершения сигнала работают в тех случаях, когда стимул прекращается. Механизм десенсибилизации позволяет ослабить ответ даже тогда, когда стимул продолжает действовать. Десенсибилизация β-адренергического рецептора опосредуется протеинкиназой, которая фосфорилирует рецептор во внутриклеточном домене, обычно взаимодействующем с Gs(рис. 12-8). Когда рецептор связан с адреналином, киназа β-адренергического рецептора (βARK, она же GRK2, см. ниже) фосфорилирует остатки Ser вблизи С-конца рецептора. Локализованная обычно в цитозоле, βARK притягивается к плазматической мембране, связываясь с Сsβy-субъединицами и таким образом занимает удобную позицию для фосфорилирования рецептора. Фосфорилирование создает центр связывания для белка β-аррестина (βаrr),называемого также аррестин 2, а связывание β-аррестина эффективно препятствует взаимодействию между рецептором и G-белком. Связывание β-аррестина также облегчает секвестрацию рецепторов — удаление рецепторов с плазматической мембраны путем эндоцитоза в малые внутриклеточные везикулы. Рецепторы в этих везикулах дефосфорилируются, затем возвращаются в плазматическую мембрану, цикл завершается, и система вновь приобретает чувствительность к адреналину. Киназа p-адренергического рецептора — член семейства рецепторных киназ GRK, сопряженных с G-белком, все они фосфорилируют серпентиновые рецепторы в их С-концевых цитозольных доменах и участвуют, подобно βАRК, в де- и ресенситизации рецепторов. В геноме человека закодированы по крайней мере пять различных GRК и четыре аррестина; каждая GRК способна десенситизировать многие серпентиновые рецепторы, а каждый аррестин может взаимодействовать с многими фосфорилированными рецепторами разного типа.
Рис. 12-8. Десенсибилизация β-адренергического рецептора при непрерывном действии адреналина. Этот процесс опосредуется двумя белками: β-адренергической протеинкиназой (βАКЛ) и β-аррестином (βarr, аррестин 2).
Циклический АМР действует как вторичный мессенджер для некоторых регуляторных молекул
Адреналин — только один из многих гормонов, факторов роста и других регуляторных молекул, которые действуют, изменяя концентрацию сАМР внутри клетки и соответственно активность РКА (табл. 12-3). Например, глюкагон связывается со своим рецептором на плазматической мембране адиноцитов, активируя (через Gs- белок) аденилатциклазу. РКА, активированная в результате увеличения концентрации сАМР, фосфорилирует и активирует два белка (перилипин и гормонзависимую триацилглицеринлиназу; см. рис. 17-3), ключевые для превращения депонированного жира в жирные кислоты, что приводит к мобилизации жирных кислот. Аналогичным образом пептидный гормон АКТГ (адренокортикотропный гормон, называемый также кортикотропином), производимый передней долей гипофиза, связывается со специфическими рецепторами коры надпочечника, активируя аденилатциклазу и вызывая таким образом увеличение концентрации сАМР. Затем РКА фосфорилирует и активирует несколько ферментов, необходимых для синтеза кортизола и других стероидных гормонов. Во многих типах клеток каталитическая субъединица РКА также может проникать в ядро, где она фосфорилирует белок CREB (от англ. сАМР response element binding protein), который изменяет экспрессию специфических генов, регулируемых сАМР.
Таблица 12-3. Некоторые сигналы, использующие сАМР в качестве вторичного мессенджера

* В квадратных скобках указаны подтипы рецепторов. Рецепторы разных подтипов могут иметь неодинаковые механизмы передачи сигнала. Например, в некоторых тканях рецепторы серотонина относятся к подтипам 5-НТ1а и 5-НТ-1b, которые работают через адепилатциклазу и с АМР, а в других тканях — рецепторы подтипа 5-HТ-1с, действующие по механизму, включающему фосфолипазу С-IР3 (табл. 12-4)
Некоторые гормоны действуют, ингибируя аденилатциклазу, понижая уровень сАМР и подавляя фосфорилирование белка. Например, связывание соматостатина с рецептором приводит к активации ингибиторного G-белка Gi, гомологичного белку Gs; Gi ингибирует аденилатциклазу и понижает концентрацию сАМР. Эффект соматостатина, таким образом, служит противовесом действию глюкагона. В жировой ткани простагландин E1 (PGE1; см. рис. 10-18) ингибирует аденилатциклазу, вследствие этого концентрация сАМР понижается, а мобилизация липидных резервов иод влиянием адреналина и глюкагона замедляется. В некоторых других тканях PGE1 стимулирует синтез сАМР, так как его рецепторы сопряжены с аденилатциклазой через стимулирующий G-белок Gs. В тканях с а2-адренергическими рецепторами адреналин понижает концентрацию сАМР, поскольку а2-рецепторы сопряжены с аденилатциклазой через ингибирующий G-белок Gi. Короче говоря, внеклеточное сигнальное вещество, такое как адреналин или PGE1, может оказывать совершенно различные эффекты на разные ткани или типы клеток в зависимости от трех факторов: типа рецепторов в ткани, типа G-белка (Gs или Gi), с которым сопряжен рецептор, и набора ферментов, являющихся мишенями РКА в клетках. Используя все факторы, приводящие к повышению и понижению концентрации сАМР, клетка достигает той интеграции сигналов, которую мы определили, как основную особенность механизмов передачи сигнала (рис. 12-1, г).
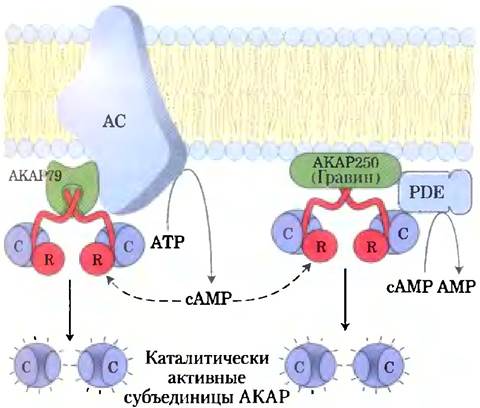
Четвертый фактор, объясняющий, как один вторичный мессенджер (сАМР) может опосредовать так много сигналов, — это ограничение процесса сигнализации определенной областью клетки с помощью белков-адаптеров (некаталитических белков, которые удерживают вместе другие белковые молекулы, работающие согласованно; см. ниже). Белки, заякоривающие киназу А (от англ. A kinase anheoring proteins — АКАР), являются «бивалентными»; одна часть связывается с R-субъединицей РКА (рис. 12-6, а), а другая со специфической структурой внутри клетки, удерживая РКА вблизи этой структуры. Например, специфические АКАР связывают РКА с микротрубочками, актиновыми фи- ламентами, Са2+-капалами, митохондриями и ядром. Разные типы клеток содержат различные АКАР, так что сАМР имеет возможность стимулировать фосфорилирование митохондриальных белков в одной клетке и фосфорилирование актиновых филаментов в другой. В некоторых случаях АКАР связывает РКА с ферментом, вызывающим активацию РКА (аденилатциклаза) или останавливающим ее действие (сАМР- фосфодиэстераза или фосфопротеинфосфатаза) (рис. 12-9). Близкое соседство активирующих и ингибирующих ферментов, по всей вероятности, необходимо для достижения очень быстрого локального ответа. В дальнейшем мы увидим, что некоторые сигнальные мембранные белки (включая аденилатциклазу) локализованы в определенных участках мембраны в рафтах или кавеолах (см. разд. 12-5).
Рис. 12-9. Нуклеация надмолекулярных комплексов белками, эаякоривающими киназу А (АКАР). Несколько типов АКАР (зеленый) выступают в роли многовалентных каркасов, удерживая каталитические субъединицы РКА (синий) путем взаимодействия с регуляторными субъединицами РКА (красный) вблизи определенных органелл или участков клетки. АКАР79 на цитоплазматической стороне плазмалеммы связывает РКА и аденилатциклазу (АС). сАМР, который производит аденилатциклаза, быстро и практически без потерь достигает находящейся поблизости РКА. АКАР79 также может связывать саму РКА (не показано), ее целевой белок (ионный канал) и фосфопротеинфосфатазу, дефосфорилирующую целевой белок. АКАР250 (гравин) прикрепляет РКА к плазмалемме и связывает сАМР-фосфодиэстеразу (РDЕ), которая подавляет сигнал РКА, превращая сАМР в АМР. В обоих случаях АКАР создает высокую локальную концентрацию ферментов и вторичных мессенджеров, сильно локализуя таким образом сигнальную цепь.
Для проведения исчерпывающего анализа механизмов передачи сигнала исследователь должен владеть достаточно точными инструментами, позволяющими изучать пространственно- временные аспекты функционирования системы передачи сигнала на уровне субклеточной организации и в режиме реального времени. При анализе внутриклеточной локализации биохимических процессов биохимия смыкается с клеточной биологией, а находящиеся на стыке этих областей методы играют неоценимую роль в изучении путей передачи сигналов. Например, в таких исследованиях широко используются флуоресцентные зонды. Связывание функциональных белков с такими метками, как зеленый флуоресцентный белок (GFP), позволяет установить их локализацию в клетке (см. рис. 9-15, а). Изменения в связывании двух белков (например, R- и С-субъединиц РКА) можно наблюдать путем измерения прямого переноса энергии между флуоресцентными метками, связанными с каждым из белков (этот метод называется резонансным переносом энергии флуоресценции, FRET, см. доп. 12-3).
Диацилглицерин, инозиттрисфосфат и Са2+ играют сходные роли вторичных мессенджеров
Еще один большой класс GPCR — рецепторы, через G-белки, сопряженные с фосфолипазой С(PLC) плазматической мембраны, которая специфична в отношении содержащегося в плазматической мембране липида фосфатидилинозит- 4,5-бисфосфата (см. рис. 10-16). Когда гормон этого класса (табл. 12-4) связывается с соответствующим специфическим рецептором на плазматической мембране (рис. 12-10, стадия (1)), комплекс гормон-рецептор катализирует обмен GTP-GDP на ассоциированном G-белке Gq (стадия (2)), активируя его практически так же, как β-адренергический рецептор активирует Gs (рис. 12-4). Активированный Gqв свою очередь активирует специфичную для PIP2 PLC (рис. 12-10, стадия (3)), которая катализирует (стадия (4)) образование двух мощных вторичных мессенджеров: диацилглицерина и инозит-1,4,5-трисфосфата, или IР3 (не путать с РIР3, с. 622).
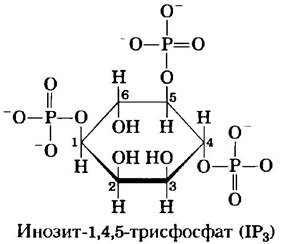
Таблица 12-4. Некоторые сигнальные вещества, которые действуют посредством фосфолипазы С и IР3

* В квадратных скобках подтипы рецепторов; см. примечание к табл. 12-3.
Рис. 12-10. Активируемая гормоном фосфолипаза С и IР3. Два внутриклеточных вторичных мессенджера производятся в гормончувствительной фосфатидилинозитной системе: инозит-1,4,5-трисфосфат (IР3) и диацилглицерин. Оба вещества вносят вклад в активацию протеинкиназы С. Увеличивая концентрацию Са2+ в цитозоле, IР3 активирует также другие Са2+-зависимые ферменты; таким образом, Са2+ тоже действует как вторичный мессенджер.
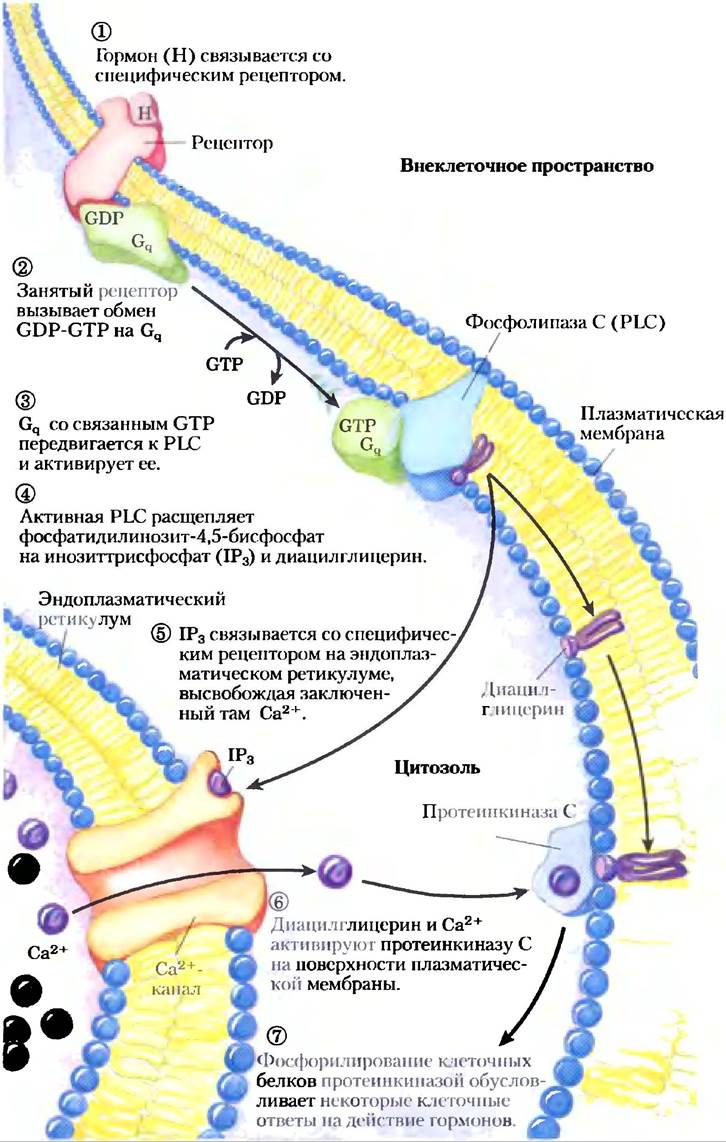
Растворимый в воде инозиттрисфосфат диффундирует из плазматической мембраны в эндоплазматический ретикулум, где связывается со специфическими рецепторами IР3 и заставляет открыться Са2+-каналы, находящиеся в ЭР. Вследствие этого в цитозоль высвобождается Са2+ (стадия (5)), концентрация Са2+ в цитоплазме резко возрастает до -10-6 М. Одним из эффектов увеличения концентрации Са2+ является активация протеинкиназы С (РКС). При активации РКС диацилглицерин кооперируется с Са2+, также действуя как вторичный мессенджер (стадия (6)). РКС фосфорилирует остатки Ser или Тhr специфических белков-мишеней, изменяя их каталитическую активность (стадия (7)). Существует целый ряд изоферментов РКС, каждый имеет характерное распределение по тканям, специфичность к белкам-мишеням и различные функции в клетке. Среди мишеней — белки цитоскелета, ферменты и ядерные белки, регулирующие экспрессию генов. Все это семейство ферментов отличается широким спектром активностей, например, они влияют на процессы в нервной и иммунной системах, а также регулируют деление клеток.
Действие группы соединений, известных как промоторы опухолей, определяется их влиянием на РКС. Наиболее изучены форболовые эфиры — синтетические соединения, мощные активаторы РКС. По-видимому, они имитируют действие клеточного диацилглицерина как вторичного мессенджера, но, в отличие от природных диацил глицеринов, не могут быстро разрушаться. Путем непрерывной активации РКС эти синтетические промоторы опухолей вмешиваются в нормальную регуляцию роста и деления клеток (см. обсуждение в разд. 12.12) и таким образом провоцируют развитие опухолей. ■
Кальций является вторичным мессенджером для многих сигнальных путей
Существует множество вариантов сигнализации с участием ионов кальция. Во многих клетках, отвечающих на внеклеточные сигналы, Са2+ служит вторичным мессенджером, приводящим в действие внутриклеточные ответы, такие как экзоцитоз в нейронах и клетках эндокринной системы, сокращение мышц и перестройку цитоскелета в процессе амебоидного движения. В норме концентрация Са2+ в цитозоле сохраняется очень низкой (<10-7 М) благодаря действию Са2+-насосов в эндоплазматическом ретикулуме ЭР, митохондриях и плазматической мембране. Гормональные сигналы, нервные импульсы или другие стимулы вызывают либо вход Са2+ в клетку через специфические Са2+-каналы в плазматической мембране, либо высвобождение кальция из ЭР или митохондрий, в каждом случае происходит увеличение содержания Са2+ в цитозоле и запуск клеточного ответа.
Изменения концентрации Са2+ воспринимаются Са2+-связывающими белками, регулирующими множество Са2+-зависимых ферментов. Кальмодулин (СаМ; Мт = 17000) — кислый белок с четырьмя высокоаффинными Са2+-связывающими центрами. Когда содержание Са2+ в клетке повышается до -10-6 М (1 мкМ), присоединение Са2+ к кальмодулину вызывает в этом белке конформационное изменение (рис. 12-11, а). Кальмодулин связывается с множеством белков и при присоединении к нему Са2+модулирует их активность (рис. 12-11, б). Кальмодулин — член семейства Са2+-связывающих белков, туда же относится тропонин (с. 247), инициирующий сокращение скелетных мышц в ответ на увеличение концентрации ионов кальция. Для этого семейства характерна Са2+-связывающая структура — «ЕF-рука» (рис. 12-21, в).
Дополнение 12-3. МЕТОДЫ. FRET: Биохимия, которую можно увидеть в живой клетке
Флуоресцентные зонды широко используются для обнаружения быстрых биохимических изменений в отдельных живых клетках. Их можно использовать для мгновенной (в пределах наносекунд) регистрации изменений внутриклеточной концентрации вторичного мессенджера или активности протеинкиназы. Более того, флуоресцентная микроскопия имеет достаточно высокое разрешение, что позволяет выявить, где именно в клетке происходят такие изменения. В одной из широко применяемых методик флуоресцентные зонды делают из природного белка — зеленого флуоресцентного белка (GFP, от англ,. green fluorescent protein) медузы Aequorea Victoria (рис. 1).
Рис. 1. Медуза Aequorea victoria, часто встречающаяся в Пьюджет Саунд, шт. Вашингтон, США.
При поглощении кванта света GFP затем испускает фотон (т. е. флуоресцирует) в зеленой области спектра. Белок GFP состоит из 11 нитей, собранных в β-цилиндр, в центре этой структуры находится хромофор (поглощающий и испускающий фотоны) — трипептид Ser65-Tyr67-Gly67 (рис. 2). Окисление трипептида катализируется самим зеленым флуоресцентным белком GFP (рис. 3), так что для осуществления реакции нс требуется никакого дополнительного белка или кофактора (кроме молекулярного кислорода). Поэтому GFP можно клонировать практически в любой клетке, где он может служить в качестве флуоресцентного маркера, например, в виде слитого белка с каким-либо другим белком (см. рис. 9-15, а).
Рис. 2. Зеленый флуоресцентный белок (GFР) и шаростержневая модель его флуорохрома (из РDВ ID GFL).
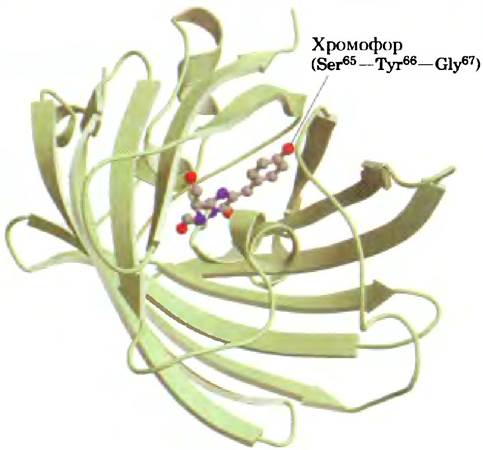
Рис. 3. Основу хромофорной группы GFР составляет последовательность аминокислот: -Sеr65-Туr66-Glу67-. При созревании хромофора происходит внутренняя перегруппировка, сопряженная с окислительной реакцией, протекающей в несколько стадий. Здесь представлен механизм этого процесса в сокращенном виде.
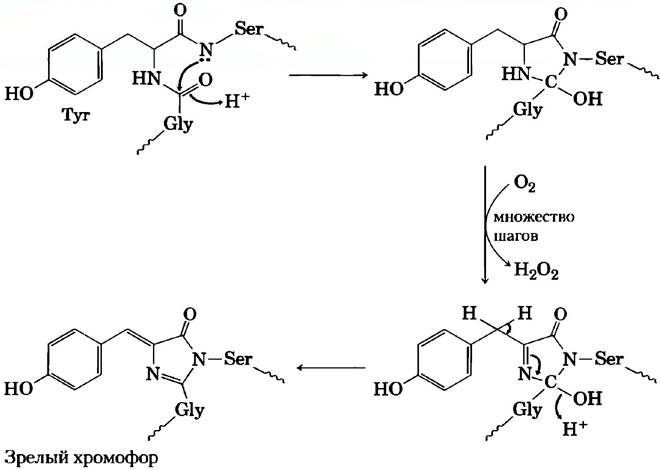
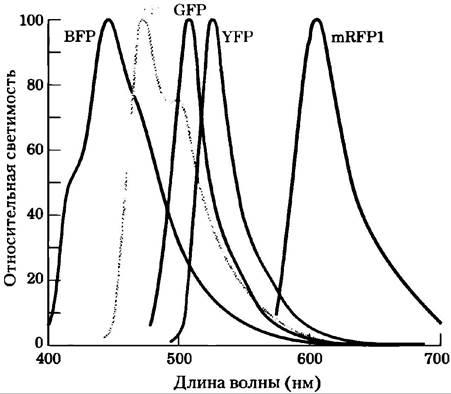
Генно-инженерными манипуляциями с геном GFP созданы варианты этого белка с различными спектрами флуоресценции. Например, в желтом (yellow) флуоресцентном белке (YFP) при замещении остатка Ala206на Lys изменяются длины волны поглощения света и флуоресценции. Другие варианты GFP испускают синий (blue, BFP) или голубой (cyan,GFP) свет, а родственный белок (mRFP1) флуоресцирует в красной области (рис. 4). GFP и его варианты — это компактные структуры, которые сохраняют способность при укладке принимать нативную конформацию β-цилиндра даже при слиянии с другим белком. Исследователи используют эти гибридные флуоресцентные белки в качестве «спектральных линеек», чтобы определять расстояния между взаимодействующими компонентами клетки и (косвенно) измерять концентрацию веществ, вызывающих изменение расстояния между двумя белками.
Рис. 4. Спектры испускания для вариантов GFP.
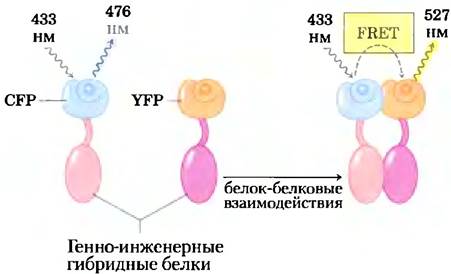
Возбужденная флуоресцирующая молекула, такая как GFР или YFР, может освобождать энергию поглощенного фотона по одному из двух путей: (1) путем флуоресценции — испускается фотон с немного большей длиной волны (с более низкой энергией), чем возбуждающий свет, или (2) путем неизлучательного флуоресцентного резонансного переноса энергии (FRET от англ. fluorescence resonance energy transfer), когда энергия возбужденной молекулы (донора) переходит прямо к соседней молекуле (акцептору), без эмиссии фотона, переводя акцептор в возбужденное состояние (рис. 5). Теперь акцептор может вернуться в основное состояние путем флуоресценции; испущенный фотон имеет большую длину волны (более низкую энергию), чем имели как первоначальный возбуждающий свет, так и флуоресценция донора. Этот второй путь гашения возбуждения (FRET) возможен только в случае, если донор и акцептор расположены поблизости друг от друга (на расстоянии от 1 до 50 Â); эффективность FRET обратно пропорциональна шестой степени расстояния между донором и акцептором. Таким образом, очень малые изменения расстояния между донором и акцептором регистрируются как очень большие изменения FRET в виде флуоресценции молекулы акцептора при возбуждении донора. При наличии достаточно чувствительных световых детекторов этот флуоресцентный сигнал можно измерять в заданных участках отдельной живой клетки.
Рис. 5. Когда белок-донор (CFP) возбуждается монохромным светом с длиной волны 433 нм, он флуоресцирует при 476 нм (слева). Когда белок (красный цвет), слитый с CFP, взаимодействует с белком (фиолетовый), слитым с YFP, это взаимодействие сближает CFP и YFP в достаточной степени, чтобы стал возможным флуоресцентный резонансный перенос энергии (FRET) между ними. Теперь, поглощая свет с длиной волны 433 нм, CFP без флуоресценции при 476 нм передает энергию напрямую YFP, который затем флуоресцирует на характерной длине волны 527 нм. Отношение интенсивностей излучения при 527 нм к таковой при 476 нм является мерой взаимодействия красного и фиолетового белков.
Метод FRET использовали для измерения концентрации сАМР в живых клетках. Ген GFP слили с геном регуляторной субъединицы (R) сАМР-зависимой про- теинкиназы, а ген BFP слили с геном каталитической субъединицы (С) (рис. 6). Когда эти два гибридных белка экспрессируются в клетке, BFP (донор; возбуждение при 380 нм, испускание при 460 нм) и GFP (акцептор; возбуждение при 475 нм, испускание при 545 нм) в неактивной РКА (тетрамер R2C2) достаточно близки, чтобы использовать FRET. Везде, где в клетке увеличивается содержание с АМР, комплекс R2C2 диссоциирует на R2и 2С, и сигнал FRET пропадает, поскольку донор и акцептор теперь слишком удалены друг от друга. При наблюдении с помощью флуоресцентного микроскопа в области с более высокой концентрацией сАМР обнаруживается минимальный сигнал GFP и больший сигнал BFP. Измерение отношения испускания при 460 нм и 545 нм позволяет точно измерить изменение концентрации сАМР. Определяя это отношение для всех областей клетки, исследователь может создать искусственное вспомогательное цветное изображение клетки, где относительная концентрация сАМР выражается интенсивностью цвета. Изображения, регистрируемые через определенные временные интервалы, дают картину изменений содержания сАМР во времени.
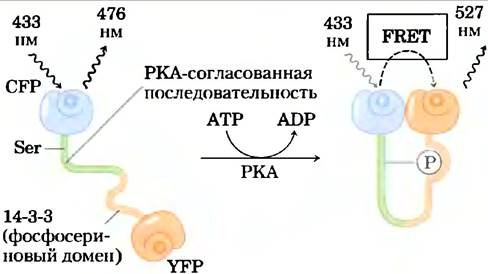
Вариант этой технологии использовали для измерения активности РКА в живой клетке (рис. 7). Исследователи создали мишень для РКА, синтезировав гибридный белок, содержащий четыре элемента: YFP (акцептор); короткий пептид с остатком Ser, окруженным консенсусной последовательностью для РКА;![]() Ser-связывающий домен (называемый 14-3-3); и CFP (донор). Когда остаток Ser не фосфорилирован, домен 14-3-3 не обладает сродством к нему, и гибридный белок существует в вытянутой форме, при этом донор и акцептор слишком удалены друг от друга, чтобы генерировать сигнал FRET. Повсюду, где в клетке активна РКА, она фосфорилирует остаток Ser в гибридном белке, и 14-3-3 связывается с -Ser. При
Ser-связывающий домен (называемый 14-3-3); и CFP (донор). Когда остаток Ser не фосфорилирован, домен 14-3-3 не обладает сродством к нему, и гибридный белок существует в вытянутой форме, при этом донор и акцептор слишком удалены друг от друга, чтобы генерировать сигнал FRET. Повсюду, где в клетке активна РКА, она фосфорилирует остаток Ser в гибридном белке, и 14-3-3 связывается с -Ser. При ![]() этом он соединяет вместе YFP и CFP, и сигнал FRET фиксируется с помощью флуоресцентного микроскопа, указывая на присутствие активной РКА.
этом он соединяет вместе YFP и CFP, и сигнал FRET фиксируется с помощью флуоресцентного микроскопа, указывая на присутствие активной РКА.
Рис. 7. Измерение активности РКА методом FRET. Созданный с помощью генной инженерии белок связывает YFP и CFP через пептид, содержащий остаток Ser, рядом с которым находятся консенсусная последовательность для фосфорилирования РКА и фосфосеринсвязывающий домен 14-3-3. Активная РКА фосфорилирует остаток Ser, который состыковывается с 14-3-3-связывающим доменом, что приводит флуоресцирующие белки в достаточную близость для возникновения FRET, что указывает на присутствие активной РКА.
Кальмодулин является также интегральной субъединицей семейства ферментов, Са2+/ кальмодулинзависимых протеинкиназ (СаМ- киназыI—IV). Когда в ответ на какой-либо стимул внутриклеточная концентрация Са2+ увеличивается, кальмодулин связывает Са2+, претерпевает конформационное изменение и активирует СаМ-киназу. Эта киназа затем фос- форилирует ряд ферментов-мишеней, регулируя их активность. Кальмодулин служит также регуляторной субъединицей мышечной киназы фосфорилазы b, которая активируется ионами Са2+. Таким образом, Са2+ вызывает АТР- зависимые сокращения мышц, активируя в то же время и распад гликогена, обеспечивающий «топливом» синтез АТР. Известно, что многие другие ферменты тоже регулируются ионами Са2+ при помощи кальмодулина (табл. 12-5). Активность Са2+ как вторичного мессенджера, подобно активности сАМР, можно ограничить на какой-либо территории; после того как его высвобождение вызвало локальный ответ, Са2+ обычно удаляется, прежде чем диффундирует в отдаленные части клетки.
Рис. 12-11. Кальмодулин — белковый посредник для многих ферментативных реакций, стимулируемых ионами Са2+. Кальмодулин содержит четыре высокоаффинных Са2+-свяэывающих центра (Кd ≈ 0,1 — 1 мкМ). а) Ленточная модель кристаллической структуры кальмодулина (РDВ ID 1GLL). Четыре Са2+-связывающих центра заняты ионами кальция (фиолетовый). Слева — N-концевой домен; справа — С-концевой домен. б) Кальмодулин, связанный со спиральным доменом (красный цвет) одного из многих белков, которые он регулирует, — кальмодулинзависимой протеинкиназой II (РDВ ID 1GDl). Заметим, что длинная центральная α- спираль, видимая на (а), изгибается назад при связывании со спиральным доменом субстрата. Центральная спираль, разумеется, в растворе более подвижна, чем в кристалле, в) Каждый из четырех Са2+-свяэывающих центров находится во фрагменте спираль-петля-спираль, называемом «ЕF-рукой», который присутствует также во многих других Са2+-связывающих белках.
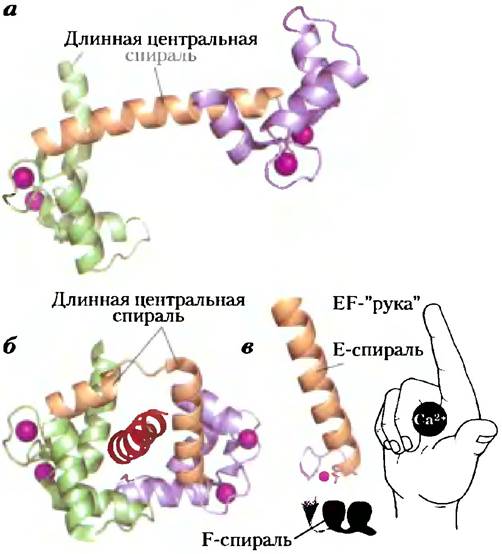
Таблица 12-5. Некоторые белки, регулируемые Са2+ и кальмодулином
Са2+-АТРаза плазматической мембраны (Са2+-насос) |
Са2+-высвобождающий канал саркоплазматического ретикулума |
Са2+-зависимый Na+-канал (у Paramecium) |
Са2/ кальмодулинзависимые протеинкиназы (СаМ-киназы с I по IV) |
сАМР-регулируемый обонятельный канал |
сAMР-фосфодиэстераза |
cGMP-регулируемые Na+-, Са2+-каналы (клетки палочек и колбочек) |
NAD+-киназа |
NO-синтаза (синтаза оксида азота) |
Аденилатциклаза (в головном мозге) |
Глутаматдекарбоксилаза |
Кальцинейрин (фосфопротеинфосфатаза 2В) |
Киназы легкой цепи миозина |
РНК-хеликаза (р68) |
Фосфоинозитид-3-киназа |
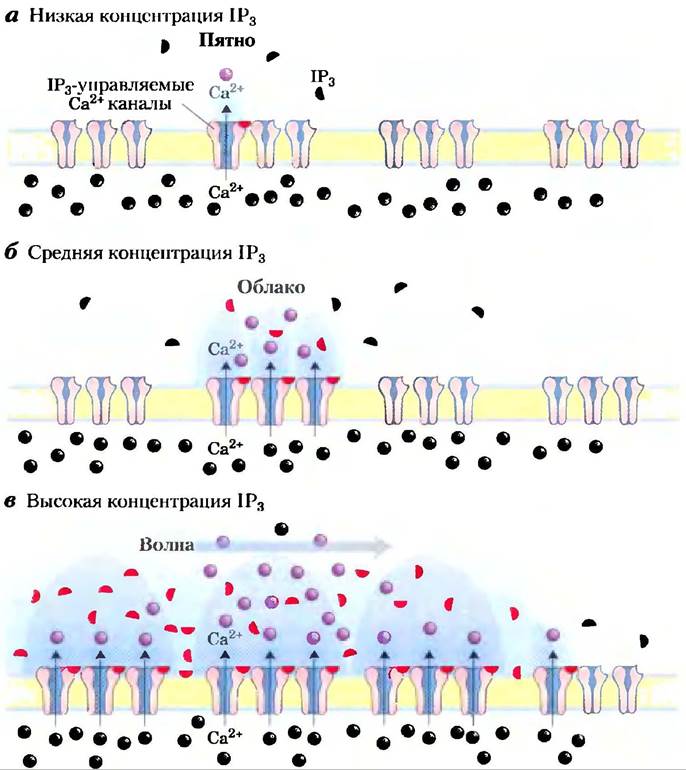
Очень часто концентрация Са2+ не просто увеличивается и потом уменьшается, а, скорее, колеблется с периодом в несколько секунд (рис. 12-12), даже когда концентрация гормона снаружи клетки остается постоянной. Механизм, лежащий в основе колебания концентрации ионов кальция, по-видимому, связан с регуляцией по типу обратной связи либо фосфолипазы, которая генерерирует IР3, либо ионного канала, который отвечает за высвобождение Са2+ из ЭР, либо и того, и другого. Каким бы ни был механизм, эффект заключается в том, что один вид сигнала (например, концентрация гормона) превращается в другой (частота и амплитуда колебаний внутриклеточного содержания Са2+). Другим возможным изменением являются локальные «пятна», «облака» или «волны» ионов кальция — временное увеличение концентрации ионов Са2+, ограниченные определенным отделом клетки (рис. 12-13). Сигнал Са2+ ослабевает по мере того, как ионы кальция диффундируют от источника (кальциевого канала), удерживаются в ЭР или выкачиваются из клетки.
Рис. 12-12. Запуск колебаний внутриклеточной концентрации Са2+ внеклеточными сигналами. а) Красителю (фура), флуоресценция которого меняется при связывании с Са2+, давали возможность диффундировать в клетки, и тут же измеряли интенсивность флуоресценции методом флуоресцентной микроскопии. Интенсивность флуоресценции показана цветом; концентрацию Са2+ можно оценить по цветовой шкале. В данном случае тимоциты (клетки тимуса — вилочковой железы) стимулировали экзогенным АТР, который повышает в них внутреннюю концентрацию Са2+. По своим ответам клетки гетерогенны; некоторые имеют высокую внутриклеточную концентрацию Са2+ (красный цвет), другие — гораздо более низкую (голубой цвет), б) Когда такой зонд используется для измерения содержания Са2+ в отдельном гепатоците, мы наблюдаем, что агонист норадреналин (время добавления показано стрелкой) вызывает колебания концентрации Са2+ от 200 до 500 нм. Подобные колебания индуцируются в других типах клеток другими внеклеточными сигналами.
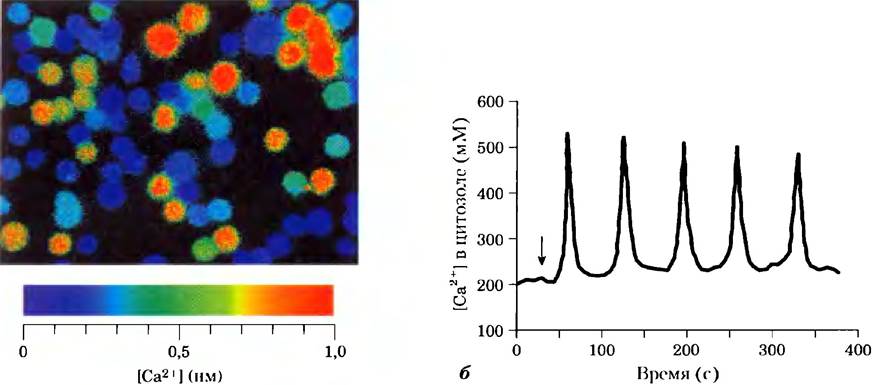
Рис. 12-13. Временное и строго локализованное повышение концентрации Са2+. а) IР3-управляемые кальциевые каналы эндоплазматического ретикулума организованы в виде кластеров, но каждый канал может независимо от остальных реагировать на сигнал IР3. Сравнительно слабый стимул, вызывающий незначительное повышение концентрации IР3, может заставить один канал быстро открыться, что приводит к временному и локальному появлению «пятна» кальция. б) Несколько более мощный стимул, вызывающий более сильное повышение концентрации IР3, может заставить открыться все кальциевые каналы данного кластера, в результате чего образуется «облако» Са2+, причем увеличение концентрации, его длительность и охват больше, чем в первом случае. в) Достаточно большое «облако» повышенной концентрации кальция может захватить соседние кластеры кальциевых каналов. Открытие каналов соседних кластеров приводит к усилению эффекта, в результате чего вдоль ЭР движется волна повышенной концентрации ионов кальция.
Сигнальные системы с участием Са2+ и сАМР связаны между собой. В некоторых тканях ионы кальция стимулируют как аденилатциклазу, производящую сАМР, так и фосфодиэстеразу, разрушающую сАМР. Следовательно, временные и локальные изменения концентрации ионов кальция могут приводить к временным и локальным изменениям концентрации сАМР. Мы уже упоминали, что сАМР-зависимый фермент РКА часто входит в состав строго локализованного надмолекулярного комплекса, образующегося вокруг каркасных белков, таких как АКАР. Внутриклеточная локализация ферментов-мишеней в сочетании с временным и пространственным градиентами концентрации Са2+ и сАМР позволяет клетке отвечать на один или несколько сигналов соответствующими метаболическими изменениями, локализованными во времени и в пространстве.
Краткое содержание раздела 12.2 Рецепторы, сопряженные с G-белком, и вторичные мессенджеры
■ Сопряженные с G-белком рецепторы (GPCR) действуют через гетеротримерные G-белки. При связывании лиганда эти рецепторы катализируют обмен GTP на GDP, связанный с ассоциированным G-белком, вызывая отделение α-субъединицы G-белка. Эта субъединица стимулирует или ингибирует целевой фермент, изменяя концентрацию продукта его деятельности — вторичного мессенджера.
■ β-Адренергический рецептор активирует стимулирующий G-белок Gs, таким образом активируя аденилатциклазу и повышая концентрацию вторичного мессенджера сАМР Циклический АМР стимулирует сАМР-зависимую протеинкиназу, она в свою очередь фосфорилирует ключевые белки, изменяя их активность.
■ Ферментативные каскады, в которых одна молекула гормона активирует катализатор, который в свою очередь активирует другой катализатор и так далее, приводит к огромному усилению сигнала; это является характерной чертой большинства систем, активируемых гормонами.
■ Циклический АМР в конечном итоге уничтожается фосфодиэстеразой cAMP, a G, сам себя выключает путем гидролиза, связанного GTP до GDP, действуя как ограничивающий себя бинарный выключатель.
■ Если сигнал адреналина длительный, специфичная к β-адрепергическому рецептору протеинкиназа и β-аррестин временно десенсибилизируют рецептор и заставляют его переместиться во внутриклеточные везикулы.
■ Некоторые рецепторы стимулируют аденилатциклазу посредством Gs; другие ингибируют ее посредством Gi. Таким образом, клеточная концентрация сАМР является общим ответом на действие двух (или более) сигналов.
■ Некаталитические адаптерные белки, такие как АКАР, удерживают рядом белки, участвующие в одном сигнальном пути, что повышает эффективность взаимодействия этих белков, а в некоторых случаях определяет место протекания процесса внутри клетки.
■ Некоторые GРСR действуют через фосфолипазу С плазматической мембраны, которая расщепляет РIР2, образуя диацил- глицерин и IР3. Открывая Са2+-каналы в эндоплазматическом ретикулуме, IР3, повышает концентрацию Са2+ в цитозоле. Диацилглицерин и Са2+, действуя совместно, активируют протеинкиназу С, которая
фосфорилирует специфические клеточные белки и изменяет их активность. Внутриклеточная концентрация Са2+ также регулирует (часто при участии кальмодулина) активность многих других ферментов и белков, участвующих в процессах секреции, перестройки цитоскелета или сокращения.