ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 2. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ - 2014
ЧАСТЬ II. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ
При добавлении цитрата скорость клеточного дыхания часто увеличивается... и при этом потребление кислорода даже значительно больше, чем могло бы быть при полном окислении цитрата... Поскольку лимонная кислота участвует в каталитических реакциях в тканях, возможно, она расходуется в первой реакции, но вновь образуется в последующих реакциях.
X. А. Кребс и В. А. Джонсон, из статьи в журнале Enzymologia, 1937
16. ЦИКЛ ЛИМОННОЙ КИСЛОТЫ
Как мы видели в гл. 14, некоторые клетки получают энергию (АТР) в результате брожения, т. е. расщепляют глюкозу в отсутствие кислорода. Для большинства эукариотических клеток и многих бактерий, живущих в аэробных условиях и окисляющих органические молекулы до СO2 и воды, гликолиз — это лишь первая стадия полного окисления глюкозы. При этом пируват, образующийся при гликолизе, окисляется далее до СO2 и Н2O, а не восстанавливается до лактата, этилового спирта или другого продукта брожения. Эту аэробную фазу катаболизма в биохимии называют дыханием. В более общем физиологическом, или макроскопическом, смысле под дыханием подразумевают потребление кислорода и выделение углекислого газа многоклеточными организмами. Однако в биохимии и цитологии этот термин используют в более узком смысле — для описания молекулярных процессов поглощения O2 и выделения СO2 клеткой; данный процесс точнее можно назвать клеточным дыханием.
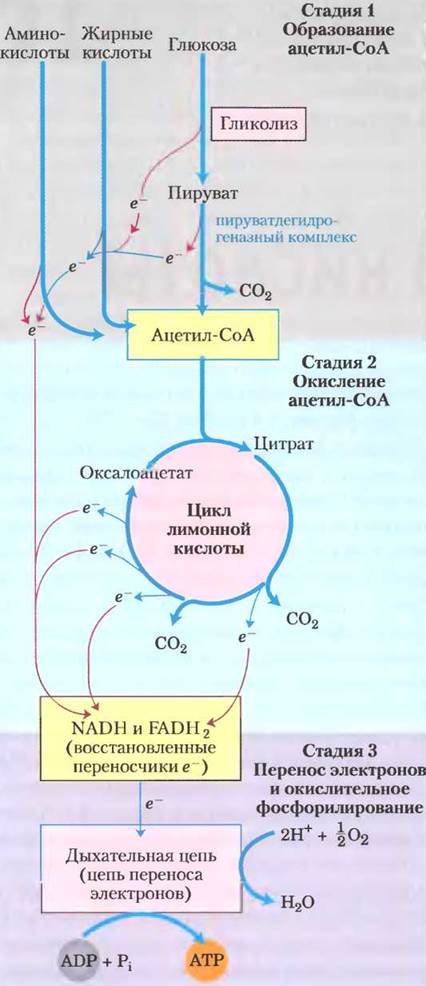
Клеточное дыхание включает три основные стадии (рис. 16-1). На первой стадии топливные органические молекулы глюкоза, жирные кислоты и некоторые аминокислоты окисляются до двух углеродных фрагментов, а именно до ацетогруппы ацетилкофермента А (ацетил-СоА). Далее (во второй стадии) ацетогруппа поступает в цикл лимонной кислоты, где ферментативным путем окисляется до СO2; высвобождающаяся при этом энергия сохраняется в форме восстановленных переносчиков электронов NADH или FADH2. На третьей стадии клеточного дыхания эти восстановленные формы коферментов в свою очередь окисляются, при этом образуются протоны (Н+) и электроны, которые затем передаются по цепи переноса электронов, иначе называемой дыхательной цепью, на финальный акцептор электронов — молекулярный кислород. Процесс переноса электронов называется окислительным фосфорилированием (гл. 19) и сопровождается выделением большого количества энергии, которая запасается в форме АТР. Клеточное дыхание гораздо сложнее, чем гликолиз; принято считать, что в ходе эволюции дыхание появилось намного позже гликолиза — после возникновения цианобактерий. Метаболическая активность цианобактерий сыграла важную роль в повышении содержания кислорода в атмосфере Земли, что и стало поворотным пунктом в эволюции.
Рис. 16-1. Катаболизм белков, жиров и углеводов в трехстадийном процессе клеточного дыхания. Стадия 1 — окисление жирных кислот, глюкозы и некоторых аминокислот приводит к образованию ацетил-СоА. Стадия 2 — окисление ацетогрупп в цикле лимонной кислоты включает четыре реакции, сопряженные с удалением электронов. Стадия 3 — электроны с помощью NADH и FADH2 поступают в дыхательную цепь (цепь переноса электронов в митохондриях или на плазматической мембране у бактерий), восстанавливая в итоге O2 до Н2O. Поток электронов обеспечивает образование АТР.
В первую очередь мы рассмотрим превращение пирувата в ацетогруппу, а затем обратимся к изучению включения ацетогруппы в цикл лимонной кислоты, иначе называемый циклом трикарбоновых кислот или циклом Кребса — по имени открывшего его Ханса Кребса. Далее остановимся на изучении реакций цикла Кребса и участвующих в нем ферментов. Поскольку интермедиаты цикла Кребса выводятся из цикла в качестве предшественников для синтеза других веществ, мы рассмотрим некоторые пути воСполнения этих интермедиатов. Цикл лимонной кислоты — ключевой в метаболизме: к нему приводят пути катаболизма, от него начинаются пути анаболизма, и его регуляция осуществляется в соответствии с другими метаболическими путями. Заключительная часть данной главы посвящена глиоксилатному пути — последовательности метаболических реакций для синтеза глюкозы из запасных триацилглицеринов у некоторых видов организмов, в которой используются отдельные реакции и ферменты, задействованные в цикле лимонной кислоты.
Ханс Кребс, 1900-1981

16.1. Образование ацетил-СоА — активированного ацетата
У аэробных организмов глюкоза и другие сахара, а также жирные кислоты и многие аминокислоты в цикле лимонной кислоты и в дыхательной цепи окисляются в итоге до СO2 и Н2O. Однако прежде чем войти в цикл лимонной кислоты, углеродный скелет сахара или жирной кислоты должен быть разрушен с образованием ацетогруппы ацетилкофермента А, поскольку большая часть топливных молекул вступает в цикл именно в этой форме. Многие аминокислоты начинают этот путь аналогичным образом, хотя некоторые из них разлагаются до других интермедиатов цикла. Для начала рассмотрим окисление образованного в процессе гликолиза из глюкозы или других сахаров пирувата до ацетил-СоА и СO2 под действием пируватдегидрогеназного (ПДГ) комплекса, который состоит из множества копий трех ферментов и локализован в митохондриях эукариотических клеток и в цитозоле бактерий.
Тщательное изучение этого ферментного комплекса полезно по нескольким причинам. Пируватдегидрогеназный комплекс представляет собой классический и известный в деталях пример полиферментного комплекса, в котором интермедиаты остаются связанными с молекулами ферментов по мере превращения субстрата в конечный продукт. В данном процессе принимают участие пять кофакторов, четыре из которых — производные витаминов. На примере этого ферментного комплекса можно также показать, каким образом комбинация ковалентной модификации и аллостерической регуляции позволяет четко регулировать поток метаболитов через определенную стадию пути. Наконец, пируватдегидрогеназный комплекс выступает в качестве прототипа двух других важных ферментных комплексов — α-кетоглутаратдегидрогеназы в цикле лимонной кислоты и дегидрогеназы α-кетокислот с разветвленной цепью в процессе окисления некоторых аминокислот (см. рис. 18-28). Удивительное сходство белковой структуры этих трех комплексов, потребность в кофакторах и механизмы реакций — все это однозначно говорит об их эволюционном родстве.
Пируват окисляется до ацетил-СоА и СO2
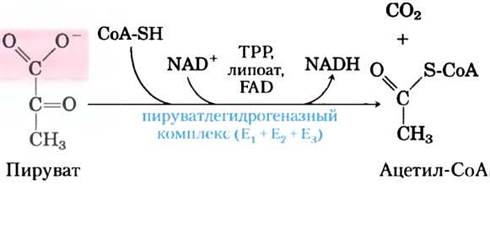
Суммарная реакция окислительного декарбоксилирования, катализируемая пируватдегидрогеназным комплексом, представляет собой необратимый процесс окисления, при котором карбоксильная группа пирувата удаляется в виде молекулы СO2, а два оставшихся атома углерода формируют ацетогруппу ацетилкофермента А (рис. 16-2). Образующийся в этой реакции NADH поставляет в дыхательную цепь гидрид-ион (:Н), который переносит два электрона на кислород или у анаэробных организмов на другой акцептор электронов (нитрат или сульфат) (рис. 16-1). Перенос электронов от NADH на кислород в итоге приводит к образованию 2,5 молекул АТР в расчете на пару электронов. Необратимость реакции, катализируемой пируват- дегидрогеназным комплексом, была подтверждена с помощью экспериментов с изотопной меткой: данный комплекс не способен присоединять к ацетил- СоА радиоактивно меченный СO2 с образованием меченного по карбоксильной группе пирувата.
Рис. 16-2. Суммарная реакция, катализируемая пиру- ватдегидрогеназным комплексом. В тексте обсуждаются пять коферментов, участвующих в данной реакции, и три фермента, входящие в состав комплекса.
∆G'° = -33,4 кДж/моль
В работе пируватдегидрогеназного комплекса участвуют пять коферментов
Дегидрирование и декарбоксилирование пирувата с образованием ацетогруппы ацетил-СоА (рис. 16-2) требует последовательного участия трех различных ферментов и пяти различных коферментов, или простетических групп, — тиаминпирофосфата (ТРР), флавипадениндинуклеотида (FAD), кофермента А (СоА, который иногда обозначают как CoA-SH, что подчеркивает роль его SH-группы), никотинамидадениндинуклеотида (NAD) и липоевой кислоты (липоата). Среди компонентов данной системы четыре витамина, которые человек должен получать с пищей: тиамин (для ТРР), рибофлавин (для FAD), ниацин (для NAD) и иантотенат (для СоА). Мы уже говорили о роли FAD и NAD в качестве переносчиков электронов (гл. 13), а с ТРР мы сталкивались ранее как с коферментом пируватде- карбоксилазы (см. рис. 14-14).
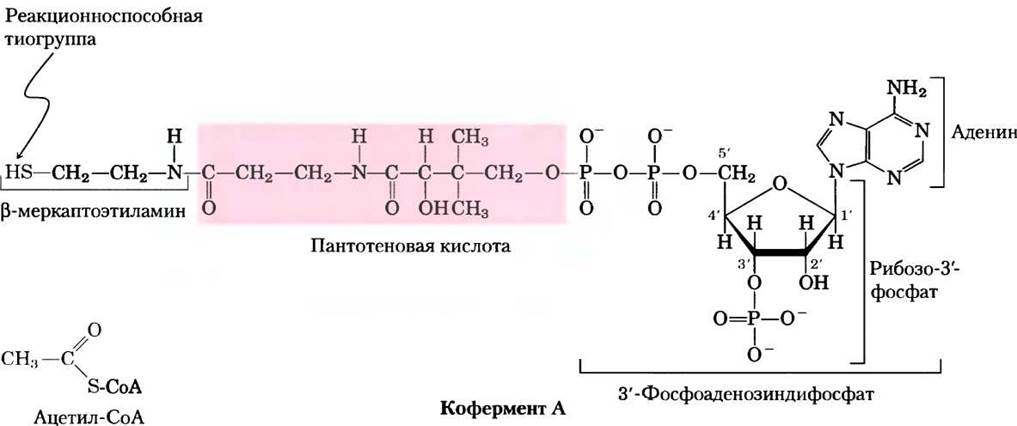
Кофермент А (рис. 16-3) содержит реакционноспособную тиоловую группу (-SH), которая играет важнейшую роль в осуществлении функции СоА в качестве переносчика ацильной группы в ряде метаболических реакций. Ацил ковалентно связывается с тиолом, образуя тиоэфир. Благодаря относительно большим величинам стандартной свободной энергии гидролиза тиоэфиров (см. рис. 13-6, 13-7) они способны переносить ацильные группы и передавать их различным акцепторным молекулам. Таким образом, ацил, связанный с коферментом А, можно рассматривать в качестве «активированной» группы.
Рис. 16-3. Кофермент А (СоА). Гидроксильная группа пантотеновой кислоты соединена с модифицированным остатком ADP фосфоэфирной связью, а ее карбоксильная группа соединена с p-меркаптоэтиламином амидной связью. Гидроксильная группа в 3'-положении остатка ADP связана с фосфорильной группой, отсутствующая в свободном ADP. SH-группа меркаптоэтиламина образует тиоэфир с ацетогруппой ацетилкофермента А (ацетил-СоА; внизу слева).
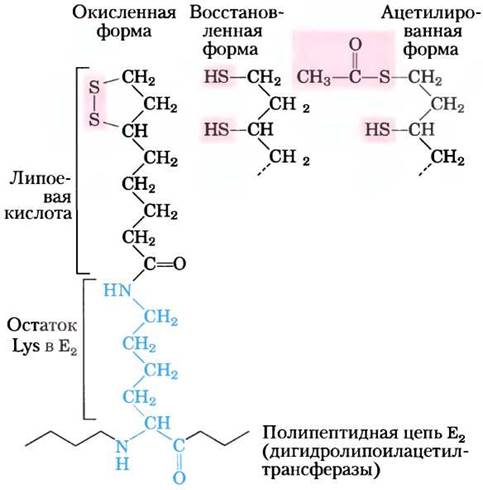
Пятый кофактор пируватдегидрогеназного комплекса липоат (рис. 16-4) содержит две тиоловые группы, которые могут обратимо окисляться, образуя дисульфидную связь (-S-S-), аналогичную дисульфидному мостику между двумя остатками Суs в белках. Благодаря своей способности подвергаться окислительновосстановительным превращениям липоат может выполнять функцию переносчика как водорода, так и ацильной группы, что мы увидим далее.
Рис. 16-4. Липоевая кислота (липоат) образует амидную связь с остатком лизина. Липоиллизиновая группа является простетической группой дигидролипоилацетилтрансферазы (фермента Е2 в комплексе ПДГ). Липоильная группа может существовать в окисленной (дисульфидной) и восстановленной (дитиоловой) форме и поэтому способна действовать как переносчик водорода и ацетильных (или других ацильных) групп.
Пируватдегидрогеназный комплекс состоит из трех разных ферментов
В ПДГ-комплекс входят три фермента: пируватдегидрогеназа (Е1), дигидролипоилацетилтрансфераза (Е2) и дигидролипоилдегидрогеназа (Е3), причем каждый фермент может присутствовать в виде множества копий. У разных видов организмов число копий каждого фермента и, следовательно, размер этого комплекса различаются. Диаметр ПДГ-комплекса, выделенного из тканей млекопитающих, около 50 нм, что более чем в 5 раз превышает размер рибосомы, и его можно «увидеть» в электронный микроскоп (рис. 16-5, а). В ферментном комплексе быка 60 одинаковых копий Е2 образуют пентагональный додекаэдр (ядро), диаметр которого
составляет около 25 нм (рис. 16-5, б). Ядро ферментного комплекса в клетках Escherichia coli содержит 24 копии Е2. Белок Е2 служит участком прикрепления липоата, образующего амидную связь с ε-аминогруппой остатка Lys (рис. 16-4). В белке Е2 три функционально различимых домена (рис. 16-5, в): N-концевой липоильный домен, содержащий остатки Lys; центральный домен, отвечающий за связывание E1 и Е3; а также внутреннее ядро — ацилтрансферазный домен, содержащий активный центр ацилтрансферазы. ПДГ-комплекс дрожжей имеет единственный липоильный домен, с которым связывается липоат, в ферментных комплексах млекопитающих два таких домена, а в клетках Е. coli их обнаружено три (рис. 16-5, в). Домены в молекуле Е2 разделены линкерными последовательностями длиной от 20 до 30 аминокислотных остатков, для которых характерно высокое содержание Ala и Pro, а также заряженных остатков. Линкерные последовательности находятся в развернутой форме, благодаря чему три белковых домена удалены друг от друга.
Рис. 16-5. Пируватдегидрогеназный комплекс, а — криоэлектронная микрофотография ПДГ-комплекса из почки быка. При проведении криоэлектронной микроскопии биологические образцы исследуют при экстремально низких температурах, что позволяет избежать артефактов обезвоживания фиксации и окрашивания. 6 — трехмерное изображение ПДГ-комплекса, позволяющее увидеть строение субъединиц: пируватдегидрогеназы (Е1), дигидроли- поилацетилтрансферазы (Е2) и дигидролипоилдегидрогеназы (Е3). Изображение создано на основе обработки большого числа снимков, аналогичных а, а также по данным кристаллографического исследования отдельных субъединиц. Ядро комплекса (выделено зеленым цветом) состоит из 60 молекул Е2, организованных в 20 тримеров и образующих пентагональный додекаэдр. Липоильные домены Е2(синие) направлены наружу и достигают активных центров молекул Е3 (желтые), окружающих ядро Е2. Некоторые субъединицы Е3 (красные) также связаны с ядром, при этом подвижное плечо Е2 может достичь их активных центров. Звездочкой обозначен участок, в котором липоильная группа прикрепляется к липоильному домену Е2. Направленная к читателю внешняя половина комплекса не показана. Данная модель была предложена в работе [Z. Н. Zhou et al. (2001)]; в другой модели [J. L. S. Milne et al. (2002)] субъединицы Е3 расположены ближе к периферии комплекса (см. дополнительную литературу), в — белок Е2 содержит домены трех типов, связанные короткими полипептидными линкерами: каталитический ацилтрансферазный домен, домен связывания Е1 и Е3 с Е2, а также один или несколько липоильных доменов.
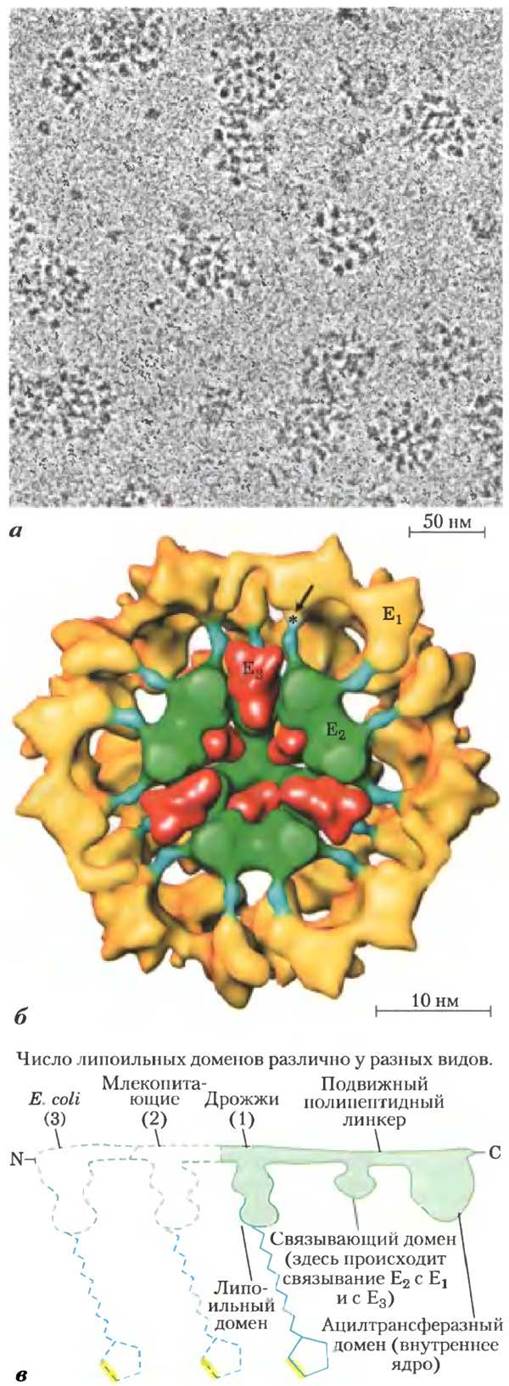
В активном центре белка E1 связан ТРР, а в активном центре Е3 — FAD. Кроме того, в состав комплекса входят два регуляторных белка — протеинкиназа и фосфопротеинфосфатаза (см. ниже). В процессе эволюции структура комплекса Е1-Е2-Е3 в основном сохранилась; она присутствует в ряде схожих метаболических процессов, в том числе в окислении α-кетоглутарата в цикле лимонной кислоты (см. ниже) и в окислении α-кетокислот, образующихся при разложении аминокислот с разветвленным углеродным скелетом, таких как валин, изолейцин и лейцин (см. рис. 18-28). В пределах одного вида белок Е3 из ПДГ-комплекса идентичен белку Е3, входящему в состав двух других ферментных комплексов. Связывание липоата с боковой цепью Lys в молекуле Е2 приводит к образованию длинного и гибкого «плеча», способного перемещаться от активного центра E1 к активным центрам Е2 и Е3, которые отстоят друг от друга на 5 нм или более.
Промежуточные вещества, образующиеся в процессе превращения субстрата, не покидают поверхности фермента
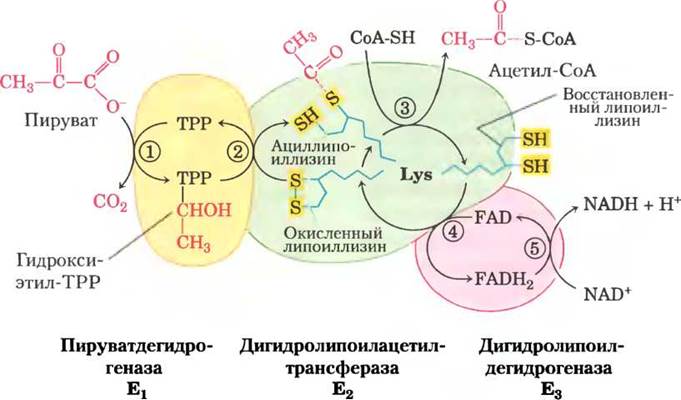
На рис. 16-6 показано действие пируватдегидрогеназного комплекса, осуществляющего пять последовательных реакций декарбоксилирования и дегидрирования пирувата. Стадия (1) практически идентична реакции, катализируемой пируватдекарбоксилазой (см. рис. 14-14, в); атом С-1 молекулы пирувата высвобождается в виде СО2, а атом С-2, который в молекуле пирувата находится в такой же степени окисления, как в альдегиде, присоединен к ТРР в составе гидроксиэтильной группы. Эта стадия самая медленная и, следовательно, она лимитирует скорость суммарного процесса. Кроме того, именно в этой реакции проявляется субстратная специфичность ПДГ-комплекса. На стадии (Dгидроксиэтильная группа окисляется до карбоксильной группы (ацетата). Два электрона, удаляемые в этой реакции, восстанавливают связь -S-S- в липоильной группе белка Е2с образованием двух SH-групп. Ацетогруппа, возникающая в результате этой окислительно-восстановительной реакции, сначала образует эфирную связь с одной из липоильных SH-групп, а затем при трансэтерификации переносится на СоА с образованием ацетил-СоА (стадия (3)). Таким образом, энергия окисления способствует образованию богатого энергией ацетилтиоэфира. На заключительных стадиях, катализируемых ферментом Е3 ПДГ-комплекса (стадии (4) и (5)), происходит перенос электронов, необходимый для регенерации, окисленной (дисульфидной) формы липоильных групп Е2, и возвращение ферментного комплекса к исходному состоянию. Электроны гидроксиэтильной группы, образовавшейся из пирувата, передаются на FAD, а затем на NAD+.
Очень важную роль в функционировании пируватдегидрогеназного комплекса играет смещение липоиллизинового «плеча» белка Е2, которое принимает от E1 два электрона и ацетогруппу, образующуюся из пирувата, и переносит их на Е3. Все перечисленные ферменты и коферменты организованы в кластерную структуру, что позволяет интермедиатам быстро взаимодействовать, не уходя с поверхности ферментного комплекса. Последовательность из пяти реакций, изображенная на рис. 16-6 — пример туннелирования субстрата. В многостадийном процессе интермедиаты никогда не покидают комплекс, и локальная концентрация субстрата для фермента Е2 все время очень высокая. Туннелирование, кроме того, предотвращает «похищение» активированной ацетогруппы другими ферментами, использующими ее в качестве субстрата. Как мы увидим далее подобный ограничительный механизм туннелирования субстрата между активными центрами реализуется и в некоторых других ферментах, использующих в качестве кофакторов липоевую кислоту, биотин или СоА-подобные вещества. Понятно, что мутации генов, кодирующих субъединицы пируватдегидрогеназного комплекса, или недостаточность поступающего с пищей тиамина имеют весьма серьезные негативные последствия. Животные с тиаминовой недостаточностью не могут нормально окислять пируват. Особенно сильное влияние это оказывает на головной мозг, который получает всю необходимую энергию от аэробного окисления глюкозы по метаболическому пути, включающему окисление пирувата. В результате тиаминовой недостаточности возникает болезнь бери-бери, которая характеризуется нарушением работы нервной системы. Это заболевание в первую очередь встречается среди населения, основной пищей которого является белый очищенный рис, поскольку в рисе тиамин в основном содержится именно в рисовой шелухе. Тиаминовая недостаточность может развиваться у людей, постоянно употребляющих большие дозы алкоголя, поскольку значительную часть их рациона составляют не содержащие витаминов «пустые» калории из спирта. Признаком нарушения окисления пирувата, вызванного одной из этих причин, часто является повышенный уровень пирувата в крови. ■
Рис. 16-6. Окислительное декарбоксилирование пирувата до ацетил-СоА под действием пируватдегидрогеназного комплекса. Изменения, происходящие с молекулой пирувата, выделены красным цветом. На стадии (1) пируват реагирует с тиаминпирофосфатом (ТРР), связанным с пируватдегидрогеназой (Е3), и претерпевает декарбоксилирование с образованием гидроксиэтильного производного (см. рис. 14-13). Пируватдегидрогеназа осуществляет также стадию (D, а именно, перенос двух электронов и ацетогруппы от ТРР на окисленную липоиллизиновую группу центрального фермента дигидролипоилацетилтрансферазы (Е2) с образованием ацетилтиоэфира восстановленной липоильной группы. Стадия (3) представляет собой реакцию трансэтерификации, при которой SH-группа СоА замещает SH-группу фермента Е2, в результате чего образуется ацетил-СоА и полностью восстановленная (дитиоловая) форма липоильной группы. На стадии (4) дигидролипоилдегидрогеназа (Е3) обеспечивает перенос двух атомов водорода от восстановленных липоильных групп Е2 на простетическую группу (FAD) молекулы Е3, что вновь приводит к появлению окисленной формы липоиллизиновой группы Е2. На стадии (D восстановленный FADH2 в белке Е3 переносит гидрид-ион на молекулу NAD+ с образованием NADH. Теперь ферментный комплекс готов к следующему каталитическому циклу. Цвета субъединиц соответствуют таковым на рис. 16-5, б.
Краткое содержание раздела 16.1 Образование ацетил-СоА — активированного ацетата
■ Образующийся в результате гликолиза пируват под действием пируватдегидрогеназного комплекса (ПДГ) превращается в ацетил- СоА — исходное соединение в цикле лимонной кислоты.
■ В состав пируватдегидрогеназного комплекса может входить множество копий трех ферментов: пируватдегидрогеназы (E1) со связанным кофактором ТРР, дигидроли- поилацетилтрансферазы (Е2) с ковалентно связанной липоильной группой, а также дигид рол ипоилдегидрогеназы (Е3) с ее кофакторами FAD и NAD.
■ Фермент Е1 катализирует сначала декарбоксилирование пирувата, что приводит к образованию гидроксиэтил-ТРР, а затем окисляет гидроксиэтильную группу до ацетогруппы. Электроны, высвобождающиеся в этом окислительном процессе, восстанавливают дисульфидную связь липоата, связанного с Е2, а ацетогруппа переносится на тиоэфирную связь с одной SH-группой восстановленного липоата.
■ Фермент Е2 катализирует перенос ацетогруппы на кофермент А, что приводит к образованию ацетил-СоА.
■ Фермент Е3 катализирует регенерацию окисленной (дисульфидной) формы липоата; электроны сначала передаются на FAD, а оттуда на NAD+.
■ Длинное липоиллизиновое плечо перемещается между активными центрами Е1, Е2 и Е3, удерживая интермедиаты на поверхности ферментного комплекса и способствуя туннелированию субстрата.
■ Организация пируватдегидрогеназного комплекса очень похожа на организацию ферментных комплексов, катализирующих окисление α-кетоглутарата и α-кетокислот с разветвленной цепью.