ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 2. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ - 2014
ЧАСТЬ II. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ
16. ЦИКЛ ЛИМОННОЙ КИСЛОТЫ
16.3. Регуляция цикла лимонной кислоты
Как мы видели в гл. 15, регуляция ключевых ферментов метаболических путей как при помощи аллостерических модуляторов, так и в результате ковалентной модификации обеспечивает образование интермедиатов с такой скоростью, которая необходима для поддержания в клетке устойчивого (стационарного) состояния без избыточного производства этих интермедиатов. Поток атомов углерода от пирувата до цикла лимонной кислоты и через него строго контролируется на двух уровнях: при превращении пирувата в стартовый метаболит цикла ацетил-СоА (реакция, катализируемая пируватдегидрогеназным комплексом), а также при вхождении ацетил-СоА в цикл (цитратсинтазная реакция). Ацетил-СоА образуется не только в результате действия ПДГ- комплекса, поскольку большинство клеток получают ацетил-СоА, окисляя жирные кислоты и некоторые аминокислоты, и доступность интермедиатов этих метаболических путей играет важную роль в регуляции окисления пирувата и в регуляции цикла лимонной кислоты. Кроме того, цикл регулируется на уровне реакций, катализируемых изоцитратдегидрогеназой и α-кетоглутаратдегидрогеназой.
Образование ацетил-СоА под действием пируватдегидрогеназного комплекса регулируется аллостерическими и ковалентными взаимодействиями
У млекопитающих действие ПДГ-комплекса сильно ингибируется АТР, а также ацетил-СоА и NADH — продуктами катализируемой комплексом реакции (рис. 16-18). Аллостерическое ингибирование окисления пирувата значительно усиливается при наличии длинноцепочечных жирных кислот. Напротив, АМР, СоА и NAD+, накапливающиеся при очень низкой скорости поступления ацетата в цикл лимонной кислоты, в результате аллостерических взаимодействий активируют ПДГ- комплекс. Таким образом, данная ферментативная активность снижается при наличии достаточного количества топливных молекул — жирных кислот и ацетил-СоА, а также при высоких значениях отношений [ATP]/[ADP] и [NADH]/[NAD+] в клетке, и усиливается вновь при увеличении энергетических запросов клетки и при необходимости интенсифицировать поступление ацетил-СоА в цикл лимонной кислоты.
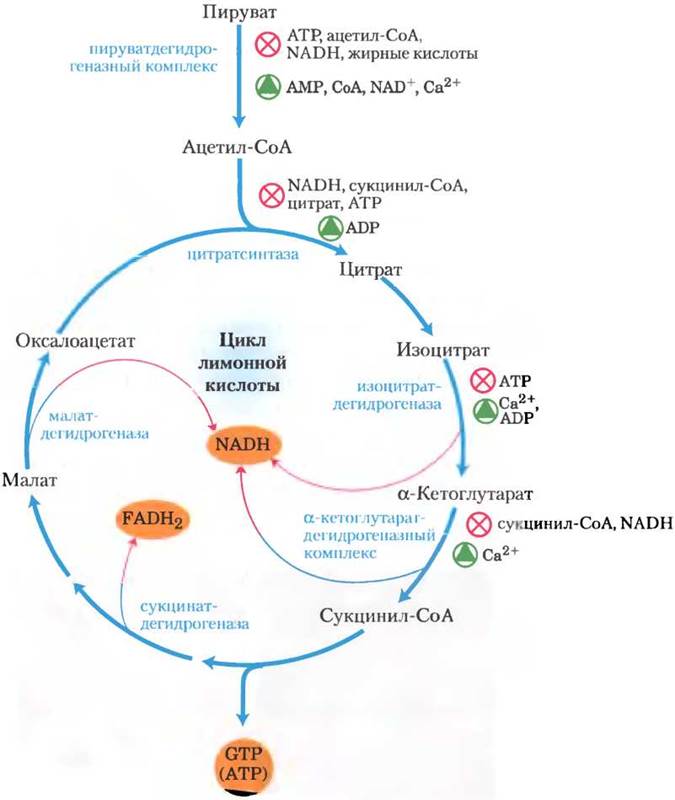
Рис. 16-18. Регуляция потока метаболитов от ПДГ- комплекса в цикле лимонной кислоты у млекопитающих. Аллостерическое ингибирование ПДГ-комплекса наблюдается при высоких значениях отношений [ATP]/[ADP], [NADH]/[NAD+] и [ацетил-СоА]/[СоА], что соответствует достаточному энергетическому запасу клетки. При уменьшении этих значений происходит аллостерическая активация окисления пирувата. Скорость потока метаболитов в цикле лимонной кислоты может ограничиваться доступностью субстратов цитратсинтазы (оксалоацетата и ацетил-СоА) или NAD+, который расходуется при превращении в NADH, что снижает скорость трех NAD-зависимых окислительных стадий. Ингибирование по принципу обратной связи, оказываемое сукцинил-СоА, цитратом и АТР, также замедляет цикл, тормозя его начальные стадии. В мышечной ткани ионы Са2+служат сигналом мышечного сокращения и, как показано на рисунке, стимулируют выработку энергии для восполнения запасов АТР, затраченных при сокращении мышц.
У млекопитающих эти аллостерические механизмы регуляции дополняются вторым уровнем регуляции ковалентной модификацией белков. ПДГ-комплекс ингибируется в результате обратимого фосфорилирования специфического остатка Ser на одной из двух субъединиц белка E1. Как отмечалось ранее, ПДГ-комплекс млекопитающих содержит не только белки E1, Е2 и Е3, но и два регуляторных белка, чья единственная функция состоит в регуляции активности комплекса. Специфическая протеинкиназа фосфорилирует и тем самым инактивирует E1, а специфическая фосфопротеинфосфатаза удаляет фосфорильную группу и тем самым реактивирует Е1. Киназа активируется путем аллостерического взаимодействия с АТР: при высокой концентрации АТР (свидетельствующей о достаточных запасах энергии) ПДГ-комплекс инактивируется в результате фосфорилирования E1. При снижении концентрации АТР активность киназы уменьшается и фосфатаза удаляет фосфорильную группу от Е1, активируя комплекс.
У растений ПДГ-комплекс, расположенный в митохондриальном матриксе и в пластидах, ингибируется продуктами катализируемой им реакции — NADH и ацетил-СоА. Кроме того, ферментативная активность у растений также регулируется при помощи обратимого фосфорилирования: пируват ингибирует киназу, активируя ПДГ-комплекс, а NH4+стимулирует киназу, способствуя инактивации комплекса. В клетках Е. coli ПДГ-комплекс регулируется в результате аллостерических взаимодействий примерно так же, как в клетках млекопитающих, но, по- видимому, регуляция фосфорилированием отсутствует.
Регуляция цикла лимонной кислоты осуществляется на трех экзергонических стадиях
Поток метаболитов по циклу лимонной кислоты строго регулируется. Скорость потока в цикле определяется тремя факторами: доступностью субстратов, ингибированием продуктами реакций и аллостерическим ингибированием ферментов, катализирующих начальные стадии цикла, которое осуществляется по принципу обратной связи.
Любая из трех экзергонических стадий цикла, катализируемая цитратсинтазой, изоцитратдегидрогеназой или α-кетоглутаратдегидрогеназой (рис. 16-18), может в определенных условиях лимитировать скорость всего процесса. Доступность субстратов цитратсинтазы (ацетил-СоА и оксалоацетата) в клетке изменяется в зависимости от условий, что может ограничивать скорость образования цитрата. Возникающий в результате окисления изоцитрата и α-кетоглутарата NАDН при определенных условиях может накапливаться, а согласно закону действующих масс, при большом значении отношения [NАDН]/[NАD+] обе дегидрогеназные реакции сильно ингибируются. Малатдегидрогеназная реакция в клетке также происходит практически в стационарных условиях (ее скорость ограничена концентрацией субстратов) — и при больших значениях отношения [NADH]/[NAD+] концентрация оксало- ацетата низкая, отсюда и скорость первой стадии цикла мала. Накопление продуктов тормозит все три лимитирующие стадии цикла: сукцинил-СоА ингибирует α-кетоглутаратдегидрогеназу (а также цитратсинтазу), цитрат блокирует цитратсинтазу, а АТР ингибирует как цитратсинтазу, так и изоцитратдегидрогеназу. Ингибирующее действие АТР по отношению к цитратсинтазе снимается в присутствии ADP — аллостерического активатора данного фермента. В мышцах позвоночных ионы Са2+, которые служат сигналом мышечного сокращения и роста потребности в АТР, активируют как изоцитратдегидрогеназу, так и α-кетоглутаратдегидрогеназу, и ПДГ-комплекс. Короче говоря, концентрации субстратов и интермедиатов цикла лимонной кислоты устанавливают скорость потока по этому пути на таком уровне, чтобы обеспечить оптимальные концентрации АТР и NADH.
В обычных условиях скорости гликолиза и цикла лимонной кислоты связаны таким образом, что из глюкозы образуется лишь то количество пирувата, которое нужно для снабжения цикла лимонной кислоты необходимым «топливом» — ацетильными группами для ацетил- СоА. Концентрации пирувата, лактата и ацетил- СоА обычно поддерживаются на стационарном уровне. Скорость гликолиза приводится в соответствие со скоростью цикла лимонной кислоты не только путем ингибирования высокими концентрациями АТР и NADH (а это обычно бывает при окислении глюкозы в процессах гликолиза и дыхания), но также путем изменения концентрации цитрата. Цитрат, продукт первой стадии цикла лимонной кислоты, — важный аллостерический ингибитор фосфофруктокиназы-1 в процессе гликолиза (см. рис. 15-14).
В цикле лимонной кислоты может происходить туннелирование субстрата, характерное для полиферментных комплексов
О ферментах цикла лимонной кислоты обычно говорят, как о растворимых компонентах митохондриального матрикса (за исключением мембраносвязанной сукцинатдегидрогеназы), однако появляется все больше доказательств того, что в митохондриях эти ферменты существуют в виде полиферментного комплекса. При изучении ферментов цикла лимонной кислоты был успешно использован классический метод энзимологии — выделение и очистка отдельных ферментов из экстракта разрушенных клеток. Однако при разрушении клеток страдает в первую очередь сложная внутриклеточная организация — нековалентные связи, образуемые при обратимых взаимодействиях между белками (ферментами) в таких клеточных структурах, как мембраны, микротрубочки или микрофиламенты. При разрушении клеток их содержимое, в том числе ферменты, разбавляются в 100-1000 раз (рис. 16-19).
Рис. 16-19. Разбавление раствора, содержащего комплекс нековалентно связанных белков (в данном случае состоящего из трех ферментов), способствует диссоциации комплекса на составляющие.

Существует несколько доказательств того, что полиферментные комплексы в клетке обеспечивают эффективное продвижение продукта одной ферментативной реакции к следующему ферменту данного метаболического пути (подобные комплексы было предложено называть метаболонами). Некоторые ферменты цикла лимонной кислоты образуют надмолекулярные комплексы; они связаны с внутренней митохондриальной мембраной или скорость их диффузии в митохондриальном матриксе ниже, чем скорость перемещения для индивидуальных ферментов в растворе. Существуют неоспоримые доказательства туннелирования субстрата в полиферментных комплексах в других метаболических путях, и многие ферменты, которые принято считать «растворимыми», на самом деле в клетке функционируют как высокоорганизованные комплексы, осуществляющие туннелирование интермедиатов. Мы столкнемся с другими примерами туннелирования в гл. 22 при обсуждении биосинтеза аминокислот и нуклеотидов.
Некоторые мутации генов ферментов, участвующих в цикле лимонной кислоты, способствуют развитию рака
При серьезных метаболических нарушениях, затрагивающих регуляцию таких важных процессов, как цикл лимонной кислоты, могут развиваться тяжелые заболевания. У человека и других млекопитающих очень редко наблюдаются мутации генов ферментов, задействованных в цикле лимонной кислоты, но если они происходят, последствия чрезвычайно опасны. Дефект гена фумаразы приводит к развитию опухолей гладких мышц (лейома) и почек, мутации гена сукцинатдегидрогеназы — к опухолям надпочечников (феохромоцитома). В культурах клеток с данными мутациями накапливается фумарат (при мутации гена фумаразы) или в меньших количествах сукцинат (при мутации гена сукцинатдегидрогеназы), в результате чего активируется фактор транскрипции HIF-1α, индуцируемый гипоксией (см. доп. 14-1). Развитие опухоли, возможно, вызывает состояние псевдогипоксии. В клетках с подобными мутациями наблюдается повышение уровня экспрессии генов, в норме регулируемых HIF-1α. Подобная роль мутаций генов фумаразы и сукцинатдегидрогеназы указывает на то, что эти гены являются опухолевыми супрессорами (см. с. 670, т. 1). ■
Краткое содержание раздела 16.3. Регуляция цикла лимонной кислоты
■ Общая скорость цикла лимонной кислоты определяется скоростью превращения пирувата в ацетил-СоА, а также потоком метаболитов через стадии цикла, катализируемые цитратсинтазой, изоцитратдегидрогеназой и a-кетоглутаратдегидрогеназой. В свою очередь эти потоки в значительной степени зависят от концентраций субстратов и продуктов: конечные продукты АТР и NADH ингибируют реакции, а субстраты NAD+ и ADP стимулируют их.
■ Образование исходного субстрата цикла лимонной кислоты ацетил-СоА под действием ПДГ-комплекса подвержено аллостерическому ингибированию некоторыми метаболитами, избыток которых говорит о достаточном уровне метаболической энергии в клетке (АТР, ацетил-СоА, NADH и жирные кислоты), и стимулируется метаболитами, накопление которых говорит о снижении уровня энергии (AMP, NAD+, СоА).
■ В комплексах ферментов, действующих последовательно в определенном метаболическом пути, возможно туннелирование промежуточных продуктов метаболизма.