ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 2. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ - 2014
ЧАСТЬ II. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ
19. ОКИСЛИТЕЛЬНОЕ ФОСФОРИЛИРОВАНИЕ И ФОТОФОСФОРИЛИРОВАНИЕ
19.9. Синтез АТР в процессе фотофосфорилирования
У растений при взаимосогласованной работе двух фотосистем происходит перенос электронов от воды к NADP+, что приводит к превращению поглощенной световой энергии в энергию химических связей NADPH (см. рис. 19-56). Одновременно с переносом электронов в фотосистемах растений возникает транспорт протонов через тилакоидную мембрану, что создает трансмембранный электрохимический потенциал, который служит хранилищем энергии, высвобождающейся при переносе электронов. Теперь интересно узнать, каким образом под действием энергии протонного градиента происходит образование АТР — высокоэнергетического продукта световых реакций.
В 1954 г. Даниэль Арнон с сотрудниками обнаружил, что при переносе электронов в освещаемых хлоропластах шпината происходит образование АТР из ADP и фосфата. Независимо от них Альберт Френкель наблюдал синтез АТР в освещаемых мембранных пигментсодержащих структурах (хроматофорах), выделенных из фотосинтезирующих бактерий. Обе группы исследователей пришли к выводу, что часть световой энергии, поглощаемой фотосинтетическими системами этих организмов, превращается в энергию фосфатной связи АТР. Этот процесс стали называть фотофосфорилированием в отличие от окислительного фосфорилирования, протекающего в дыхательной цепи митохондрий.
Даниэль Арнон, 1910-1994

Протонный градиент связывает процессы фосфорилирования и переноса электронов
Сходство переноса электронов при фотосинтезе и фотофосфорилировании в хлоропластах с переносом электронов и окислительным фосфорилированием в митохондриях указывает на то, что протонный градиент играет одинаковую роль в обоих процессах. Сходство этих процессов проявляется в следующем. (1) Реакционные центры, переносчики электронов и ферменты, участвующие в синтезе АТР, находятся в непроницаемой для протонов Н+ тилакоидной мембране. Необходимым условием фотофосфорилирования является целостность тилакоидных мембран. (2) Фотофосфорилирование можно разобщить с переносом электронов при помощи реагентов, способных стимулировать проход протонов Н+ через тилакоидную мембрану. (3) Фотофосфорилирование можно блокировать вентурицидином и другими аналогичными препаратами, подавляющими в митохондриях синтез АТР из ADP и фосфата, катализируемый ATP-синтазой (табл. 19-4). (4) Синтез АТР осуществляется ферментными комплексами F0F1, находящимися на наружной поверхности тилакодных мембран. По своей структуре и функции они очень напоминают аналогичные комплексы митохондрий.
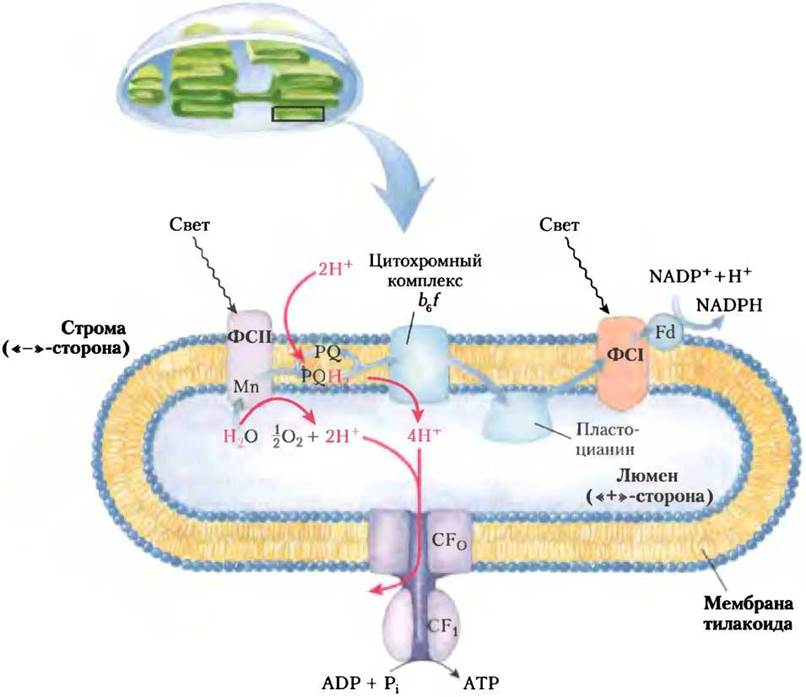
Тилакоидная мембрана асимметрична по своему молекулярному строению. Молекулы переносчиков в цепи переноса электронов, ведущей от фотосистемы II к фотосистеме I, ориентированы в тилакоидной мембране таким образом, что перенос электронов создает реальный поток протонов Н+ через тилакоидную мембрану, направленный снаружи (из стромы) в тилакоидный люмен (рис. 19-63). Адрэ Яген- дорф, ранее получивший экспериментальное подтверждение правильности хемиосмотической гипотезы Митчелла, в 1966 г. поставил эксперимент, доказавший, что источником энергии для синтеза АТР действительно может служить трансмембранный градиент pH (с более щелочной средой снаружи).
Андрэ Ягендорф

Рис. 19-63. Пути протонов и электронов в тилакоидной мембране. Индуцированный светом поток электронов, путь которого показан голубыми стрелками, направляется от Н2Oчерез ФСII, промежуточную цепь переносчиков, и ФСI к NADP+. Перенос электронов через цепь переносчиков, связывающих ФСI и ФСII, вызывает перекачивание протонов (красные стрелки) в тилакоидный люмен. Возврат ионов Н+ наружу в строму происходит через протонные каналы компонента F0 ферментного комплекса ATP-синтазы, обозначаемого GF0. Компонент F1 ATP-синтазы, или GF1, катализирует синтез АТР.
В этом эксперименте хлоропласты сначала инкубировали в темноте в буферном растворе (pH 4), который медленно проникал во внутренний компартмент тилакоидов, снижая pH их содержимого. Затем после добавления к этой темновой суспензии хлоропластов ADP и фосфата быстро доводили pH среды до 8, добавляя к ней щелочной буфер, т. е. создавали большой трансмембранный градиент pH мгновенно. Когда этот градиент начинал уменьшаться вследствие выхода протонов Н+, происходило образование АТР из ADP и фосфата. Поскольку АТР синтезировался в темноте (без доступа энергии света) эксперимент доказывал, что трансмембранный градиент pH создает высокоэнергетическое состояние, посредством которого, как и при окислительном фосфорилировании в митохондриях, энергия переноса электронов преобразуется в энергию химических связей АТР.
Установлена стехиометрия процесса фотофосфорилирования
В хлоропластах растений индуцированный светом поток электронов от воды к NАDР+ при переносе каждых четырех электронов (что соответствует образованию одной молекулы O2 при расщеплении воды) примерно 12 ионов Н+ перекачивается из стромы в тилакоидный люмен. Четыре из этих 12 протонов переносит кислород-образующий комплекс, а остальные восемь — цитохромный комплекс b6f. В результате возникает 1000-кратная разница в концентрации протонов по обе стороны тилакоидной мембраны, что соответствует ∆рН = 3. Как известно, энергия протонного градиента (электрохимического потенциала) включает два компонента: химический, обусловленный разностью концентраций протонов (АрН) по обе стороны тилакоидной мембраны, и электрический потенциал (∆Ψ), возникший из-за появления заряда между двумя сторонами мембраны. В хлоропластах градиент pH (∆рН) вносит больший вклад в электрохимический потенциал. В основном энергия электрического потенциала, по-видимому, расходуется на передвижение ионов Н+. В освещенных хлоропластах энергия градиента pH в расчете на 1 моль протонов составляет
∆G = 2,3 RT ∆рН + ZJ ∆Ψ = -17 кДж/моль.
Следовательно, в результате прохода 12 моль протонов через тилакоидную мембрану запасается около 200 кДж энергии, за счет которой синтезируется несколько молей АТР (для синтеза АТР ∆G'° = 30,5 кДж/моль). Полученные данные показывают, что индуцированный светом перенос электронов дает 3 молекулы АТР на каждую образовавшуюся молекулу O2.
Относительно квантового выхода фотосинтеза известно, что фотосинтезирующие клетки должны получить по меньшей мере 8 квантов видимого света, чтобы передать четыре электрона от молекулы Н2O на NADPH, т. е. при переносе одного электрона каждый реакционный центр должен принять по одному фотону. Энергии восьми поглощенных фотонов видимого света более чем достаточно для образования трех молекул АТР.
У растений при фотосинтезе поглощенная энергия видимого света запасается не только в форме АТР, но и как NADPH — другого высокоэнергетического продукта, образующегося на конечном этапе переноса электронов в хлоропластах, и близкого аналога митохондриального NADH. Суммарное уравнение для нециклического фосфорилирования, которое подробнее рассмотрено в следующем разделе, таково:
2 Н2O + 8 фотонов + 2 NADP+ + ~3 ADP + ~3 Pi —> O2 + ~3 АТР + 2 NADPH (19-17)
АТР-синтаза хлоропластов по строению и функциям напоминает ферментативный комплекс в митохондриях
Синтез АТР в хлоропластах осуществляется большим ферментным комплексом, включающим два функциональных компонента CF0 и CF1 (С от лат. chloroplast — хлоропласт). Несколько интегральных белков компонента CF0, аналогичных белкам митохондриального комплекса F0, образуют протонный канал, пронизывающий мембрану. Компонент CF1, находящийся на наружной поверхности тилакоидной мембраны, по белковому составу, строению и функции очень напоминает митохондриальный компонент F1.
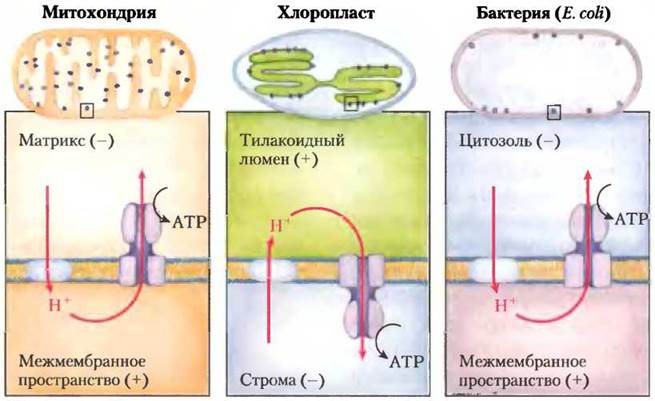
Электронные микрофотографии срезов хлоропластов показывают, что ферментный комплекс АТР-синтазы, осуществляющий синтез АТР, имеет «грибовидную» форму и расположен на внешней, или стромальной, отрицательно заряженной поверхности тилакоидной мембраны. По структуре и функции АТР- синтаза хлоропластов напоминает комплекс АТР-синтазы на внутренней, или матриксной, отрицательно заряженной поверхности внутренней мембраны митохондрий. Комплекс АТР-синтаза в тилакоидной и митахондриальной мембранах ориентирован таким образом, что направление перекачивания протонов через мембрану в обоих случаях одинаково. Возврат ионов Н+ по градиенту концентрации происходит как в хлоропластах, так и в митохондриях через компонент F1 АТР-синтазы, расположенной на более щелочной, отрицательно заряженной стороне мембраны в направлении от «+» к «-» (рис. 19-64).
Рис. 19-64. Сравнение топологии движения протонов по протонному градиенту и ориентации АТР-синтазного комплекса в мембранах митохондрий, хлоропластов и бактерий Е. coli. Во всех случаях головка АТР-синтазного комплекса обращена в сторону движения протонов по протонному градиенту.
Механизмы каталитического действия ATP-синтазного комплекса в хлоропластах и митохондриях совершенно идентичны. Реакция образования АТР из ADP и фосфата протекает на поверхности фермента. Высвобождение молекулы АТР с поверхности фермента происходит за счет энергии протон-движущей силы. Каждая из трех β-субъединиц АТР-синтазы последовательно катализирует синтез АТР, высвобождение АТР с поверхности фермента и взаимодействие ADP с фосфатом (см. рис. 19-26 и 19-27).
Краткое содержание раздела 19.9 Синтез АТР в процессе фотофосфорилирования
■ Во время фотосинтеза у растений реакции расщепления воды и процесс переноса электронов через цитохромный комплекс b6f сопровождаются перекачиванием протонов через мембрану тилакоидов. Создаваемая при этом протон-движущая сила служит источником энергии для синтеза АТР ферментным комплексом CF0CF1, строение и функция которого аналогичны митоходриальному комплексу F0F1.
■ ATP-синтаза хлоропластов (CF0CF1) по структуре и каталитическому механизму очень напоминает ATP-синтазу из митохондрий и бактерий. Физическое вращение, направляемое градиентом протонов, сопровождается синтезом АТР в участках, находящихся поочередно в трех конформациях: с высоким сродством к АТР, с высоким сродством К ADP + Piи с низким сродством к обоим нуклеотидам.